SÍNTESE DA ASPIRINA: Resultado de Aula Prática
- Home
- Trabalhos
ÁREA
Química Orgânica
Autores
Feitosa, J. (CEULM/ULBRA) ; Vasconcelos, W. (CEULM/ULBRA) ; Fernandes, A.N. (CEULM/ULBRA) ; Viana, C. (CEULM/ULBRA) ; Sarah, E. (CEULM/ULBRA) ; Oliveira, L.G. (CEULM/ULBRA)
RESUMO
O ácido acetilsalicílico (AAS), conhecido como aspirina , é uma das drogas mais antigas e usadas. Encontrada naturalmente em folhas de murta e em cascas de salgueiro, essa substância tem propriedades analgésicas, antitérmicas e anti- inflamatórias. O objetivo deste trabalho foi sintetizar essa substância, na aula prática de “Análise e Síntese Orgânica”. Os reagentes utilizados foram: ácido salicílico P.A.; anidrido acético 95% P.A; ácido fosfórico concentrado 85% P.A., e água destilada. Com atenção especial às etapas de homogeneização , aquecimento e resfriamento de forma eficaz, garantindo um bom rendimento da AAS, na ordem de 96,5% por HPLC e prático de 87,6%. Assim pôde-se visualizar precipitados bem formados, bem como compreender suas etapas de formação no mecanismo de reação.
Palavras Chaves
SÍNTESE; ASPIRINA; AULA PRÁTICA
Introdução
O ácido acetilsalicílico (AAS), é um medicamento utilizado por muito tempo pela humanidade. Antes da descoberta de sua síntese, já se utilizava folhas do salgueiro, de onde se extrai a salicina, composto no qual deriva o ácido acetilsalicílico (MENEGATTI;FRAGA; BARREIRO, 2001). O AAS, tem massa molar de 180,13g/mol e é um analgésico muito utilizado em tratamento de patologias como trombose cerebral, derrames, infartos, nevralgia, dores na cabeça, corpo e até mesmo febre, mas há mais utilidades para ele. Esses analgésicos são agentes depressores do sistema nervoso central com o objetivo de aliviar as dores sem causar perda de consciência. Pode se encontrado com concentração de 100g e 500g (CONSTANTINO;SILVA; DONATE, 2004).A aspirina funciona como agente anti- inflamatório porque é capaz da reação de transesterificação, inativar as enzimas das prostaglandinas, que são substâncias biológicas que estimulam a inflamação (BRUICE, 2014).A aspirina é composta de 60% de carbono, 4,5% de hidrogênio e 35,5% de oxigênio por massa, independentemente de sua origem, essa composição é constante (BROWN, 2005). A reação de acetilação do ácido salicílico ocorre através do ataque nucleofílico do grupo -OH fenólico sobre o carbono carbonílico do anidrido acético, seguido de eliminação de ácido acético, formado como um sub-produto da reação. É importante notar a utilização de ácido fósfórico como um catalisador desta reação de esterificação, tornando-a mais rápida e prática do ponto de vista comercial (MENDES, 2012).Uma das etapas mais importantes da síntese de AAS é o resfriamento, no qual durante o processo de recristalização, deve ser feito lentamente para que se permita a disposição das moléculas em retículos cristalinos, com formação de cristais grandes e puros (SOLOMONS,2009).
Material e métodos
Preparou-se um banho-maria, adicionando água até ¾ do volume de um béquer de 1000 mL na chapa aquecedora. Foi pesado 2g de ácido salicílico P.A. (marca Neon; P.M-138,12) , em um erlenmeyer seco. Em seguida adicionado 5 mL de anidrido acético 95% P.A. (marca Nuclear; P.M-102,09), e 5 gotas de ácido fosfórico concentrado 85% P.A. (marca Neon; P.M-98,00). Foi introduzido o erlenmeyer no banho maria, segurando com os dedos. Aqueceu-se durante 5 minutos, agitando a mistura com bastão de vidro. Após esse tempo, foi adicionado ao erlenmeyer 2 mL de água destilada, vagarosamente, para eliminar o excesso de anidrido acético que se transforma em ácido acético (se sente o odor característico de vinagre). Retirou-se o erlenmeyer do banho-maria e foi acrescentado 20 mL de água destilada. Em seguida esse erlenmeyer foi colocado no banho de gelo e foi homogeneizado com bastão de vidro até a formação de um precipitado branco (volumoso), para depois ser filtrado em papel de filtro (previamente pesado). Pesou-se em um papel filtro (marca Whatman Cat No 1442 125 ) e anotou-se sua massa (Montou-se o kit de filtragem-Funil+papel de filtro+suporte universal). Deixou-se o resíduo sólido secar (in natura) totalmente no papel filtro, para ser pesado. E por fim, foi calculado o rendimento teórico e prático da Aspirina e Analisado por HPLC (marca Agilent 1260 Infinity II/Detector VWD).
Resultado e discussão
Finalizado os procedimentos, obteve-se um precipitado (ppto) branco, a aspirina.
O mecanismo de reação descreve a síntese com detalhes, Fig.1.O anidrido acético,
nucleófilo, recebe um próton, comportando-se como base de Bronsted. O ácido
fosfórico, catalisador, doa um próton, agindo como ácido de Bronsted, formando o
carbocátion (anidrido acético protonado). O ácido salicílico, um nucleófilo
(rico em elétrons), ataca o carbocátion, um eletrófilo (deficiente em elétrons).
Com a migração do próton, formou o ácido acético. Com a heterólise, ele recebe
um par de elétrons, (ácido de Lewis). O intermediário, doa esse par de elétrons,
(base de Lewis),formando a AAS e o ácido acético (subproduto). Segundo Bruice
(2006), a primeira etapa da síntese da AAS, é conhecida como carboxilação de
Kolbe-Shmitt. A acetilação com ácido acético forma o ácido acetilsalicílico.
Após a formação do ppto da AAS, filtrou-se os cristais. Essa etapa é importante,
devido a retirada das impurezas da substância (Picolo , 2014). Após a secagem do
ppto, foi pesado, obtendo os seguintes resultados :Massa do papel filtro (m’):
1,030 g ; Massa do papel filtro + ppto (m’’): 3,310 g ; Massa do ppto (m’’ –
m’): 3, 310 g – 1,030 g = 2,28 g (rendimento experimental) (1). A partir do PM
do Ácido Salicílico - 138,12 g/mol (2) e o da Aspirina - 180,15 g/mol (3),
calcula-se o rendimento teórico (x) : Produto entre a massa do ácido salicílico
(2g) por (3) e dividido por (2) , resultando em x = 2,60 g de AAS. E rendimento
percentual da AAS obtida é (y): 87,6 % , resultante do cálculo do produto entre
(1) e 100 (%), dividido por x. A análise cromatográfica por HPLC ,mostrou o
tempo de retenção em 4,13 min., com grau de pureza de 96.5 % (das duplicatas –
96.8002 e 96.1565) , de AAS sintetizada em aula prática, Fig.2.
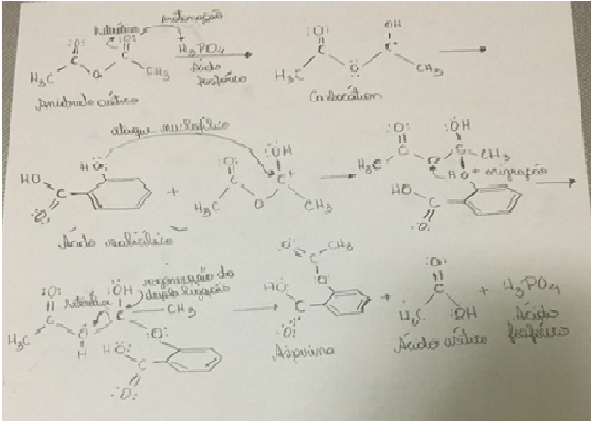
Figura 1 – Mecanismo da Reação da Síntese da Aspirina.
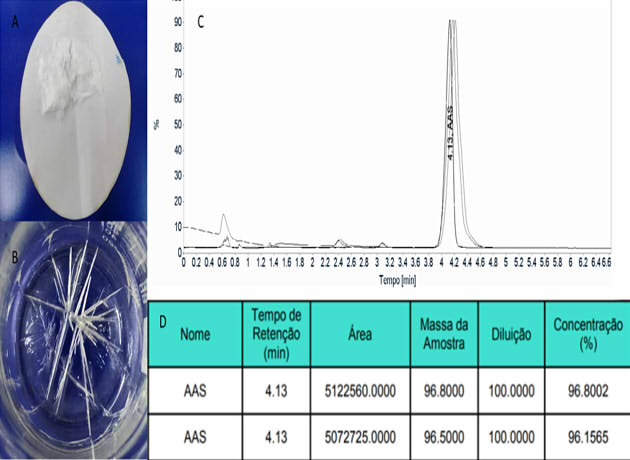
Figura 2- A) Aspirina Filtrada; B) Cristais de Aspirina; C) Cromatograma ; D) Tabela com o percentual de obtenção da Aspirina (em duplicada).
Conclusões
O fazer “Química”, se torna bem mais interessante, quando se oportuniza essa experiência pelas aulas práticas presenciais, ambiente esse de muitas descobertas para nós acadêmicos. Foi possível compreender a forma como a síntese da aspirina ocorre através do mecanismo dessa reação, de acordo com cada etapa realizada. Além disso, notou-se também que o valor do rendimento experimental (2,28 g) possuiu diferenças quando comparado ao rendimento teórico (2,60 g), tendo um rendimento percentual de 87,6 %. Contudo, o percentual de Aspirina foi de 96,5%, em média, por análise cromatográfica.
Agradecimentos
Ao CEULM-ULBRA pela realização do experimento, pelo uso do HPLC de uma Empresa do Polo Industrial de Manaus (prefere Anonimato) e pelo companheirismo dos colegas, em meio a essa pandemia de Covid-19.
Referências
BRUICE, P. Y. Química orgânica. 4. ed. São Paulo: Pearson Prentice Hall, 2006. v.1.
BRUICE, P. Y. Fundamentos de Química Orgânica. 2. ed. São Paulo: Pearson Education do Brasil, 2014.
BROWN, T.L. Química a ciência central. 9. ed. São Paulo: Pearson Prentice Hall, 2005.
CONSTANTINO, M.; SILVA, G.; DONATE, P. Fundamentos de química experimental. ed. Edusp, 2004. 79.p.
MENDES, S.A. Síntese e Purificação do Ácido Acetilsalicílico através da Recristalização utilizando diferentes tipos de solventes. Trabalho Científico da Estácio. Santa Catarina, 2012.
MENEGATTI, R.; FRAGA, C. A. M.; BARREIRO, E.J. A importância da síntese dos fármacos: Cadernos Temáticos de Química Nova na Escola. 2001.
PICOLO, K.C. Química Orgânica. São Paulo: Pearson Education do Brasil, 2014.
SOLOMONS. T,W.G; Química Orgânica. Rio de Janeiro: LTC, 2009.


