Estudo preliminar das substâncias por caracterização de ATR- FTIR, dos extratos Alcóolico e Aquoso da folha in natura e seca de (Arrabidaea chica) – Crajiru
- Home
- Trabalhos
ÁREA
Química Orgânica
Autores
Feitosa, J. (CEULM/ULBRA) ; Rodrigues, A. (CEULM/ULBRA) ; Justino, R. (CEULM/ULBRA) ; Araújo, I. (IFAM) ; Amaral, M. (UFAM) ; Oliveira, L. (CEULM/ULBRA)
RESUMO
A Arrabidaea chica, planta pertencente à família Bignoniaceae, popularmente conhecida como Crajiru, é tida, em algumas regiões do país como uma planta medicinal utilizada em tratamento e prevenção de algumas doenças. A planta em questão possui característica arbustiva e trepadeira. Quando secas, as folhas adquirem uma coloração avermelhada. Este estudo teve como principal objetivo caracterizar, por espectroscopia IR, extratos das folhas do Crajiru, tanto in natura quanto secas, extraído em meio alcóolico e aquoso. Os espectros analisados dos extratos das folhas in natura e secas mostrou a presença de grupos de hidrocarbonetos, carboxilato, ésteres, ácidos sulfônicos, além de o surgimento de duas nova bandas, relativamente de intensidade média característica de grupos carbonila e aldeídos.
Palavras Chaves
Crajiru; Soxhlet; FT-IR
Introdução
A crescente demanda por espécies medicinais indica o surgimento de um mercado com alto potencial para consumo, exigindo uma consistente e prontamente oferta disponível de matéria-prima de alta qualidade. No entanto, para suprir esta demanda, é necessário o aumento do número de áreas de cultivo em várias regiões do Brasil (SILVA & CASALI, 2000). Uma análise do índice de novos medicamentos aprovados para uso terapêutico mostra que cerca de 50% destes são derivados de produtos naturais e estima-se que mais de 50% dos medicamentos prescritos devem conter ingredientes naturais e pelo menos 25% contêm apenas substâncias ativas isoladas. Os fitoterápicos respondem por 25% das prescrições nos países desenvolvidos e cerca de 80% nos países em desenvolvimento (NEWMAN & CRAGG, 2007); ( SIMÕES, et al., 2007); (BALUNAS & KINGHORN, 2005). Na região amazônica, existe uma grande biodiversidade de plantas medicinais usadas empiricamente, porém, cuja prescrição foi consolidada através de séculos de cultura. Desta maneira, as plantas medicinais têm sido um recurso para a cura em comunidades locais (BUGNO, 2006). Neste contexto, a espécie vegetal utilizada nesse estudo é a Arrabidaea chica (A. chica). Esta planta é popularmente conhecida como crajiru, pariri e chica, geralmente encontrada em regiões tropicais da América do Sul, especificamente no Norte do Brasil (BARBOSA, 2001). A referida espécie é composta de substâncias coloridas polares, chamadas de desoxiantocianinas, similares às antocianinas encontradas em folhas, flores e frutos (BARA, 2006). A extração de seus compostos metabólicos, os chamados secundários, são por meio de rotas simples, como meio alcóolico e até mesmo uma simples fervura. O extrato obtido caracteriza-se por ser uma fonte rica em flavonóides, antocianinas e taninos que, quando em conjunto, resultam em uma mistura com estimáveis propriedades biológicas (PIRES, et al., 2015). Os pigmentos pertencentes ao grupo dos flavonoides são geralmente responsáveis por uma grande variedade de cores de frutas, flores e folhas que vão do vermelho-alaranjado, ao vermelho vivo, roxo e azul, as antocianinas, pigmentos pertencentes a este grupo, possui comprovadamente efeitos antiinflamatórios, antifúngicos e antioxidantes (ARO, 2013). Dados na literatura apontam que a população local utiliza o extrato de A. chica diretamente na pele como corante, repelente de mosquitos e no tratamento de doenças, como feridas crônicas, infecções fúngicas como a Candida albicans e herpes (BERLA, 2008); (BUENO, 2018). Em relação a extração, utilizado farmacológica e quimicamente para a separação de porções de componentes ativos ou inertes de tecidos vegetais utilizando solventes aquoso ou alcóolico no procedimento padrão. Isso inclui classes de preparações conhecidas como infusão, tinturas, extratos pilulares (semisólidos) e extratos em pó ( SIMÕES et al., 2007). As folhas in natura e/ou secas dessa planta são usadas como uma infusão que resulta na imersão destas folhas em água quente, para substituir a bebida diária normal, eventualmente usada para tratamentos de doenças internas e externas (PINTO, 2004). Quando aplicado em feridas, o extrato auxilia em todo o processo de cicatrização e, além disso, pode fornecer uma camada protetora no tecido lesionado (ZHANG, 2013). O controle de doenças causadas por fungos, dentre os métodos utilizados, as substâncias bioativas presentes em plantas podem desempenhar funções importantes nas interações planta-patógeno, seja pela ação antimicrobiana direta, seja por ativar mecanismos de defesa das plantas (BARA, 2006). O tipo de procedimento de extração também desempenha um papel decisivo na hora de determinar a composição qualitativa e quantitativa do extrato, como por exemplo, quanto mais exaustiva for a extração, melhor será o seu rendimento das substâncias extraídas, outros fatores também podem interferir na qualidade do extrato como, o tempo de extração, a temperatura e a quantidade de solvente e amostras (HANDA et al., 2008). Um dos métodos mais utilizados para uma extração eficaz é por via Soxhlet, sua vantagem é que grandes quantidades de fármaco podem ser extraídas com uma quantidade muito menor de solvente. Isso resulta em um processo econômico em termos de tempo, energia e consequentimentes investimento financeiros (EMEA, 2005).
Material e métodos
As folhas da A. chica foram coletadas em propriedade particular (latitude -3.114009; longitude -59.980758) na cidade de Manaus, separadas pela Prof. Dra. Liliam Gleicy de Souza Oliveira. O processo de extração foi realizado no laboratório de Engenharia Química, localizado no Centro Universitário Luterano de Manaus – CEULM/ULBRA, e analisadas no Centro de Tecnologia Professor Harlan Julu Guerra Marcelice (CTHM), no Instituto Federal do Amazonas – IFAM, localizada no Campus Manaus Distrito Industrial (CMDI). Para a extração alcóolica e aquosa, foram coletadas e selecionadas as folhas completamente verdes, enquanto as folhas frescas foram secas em estufa, aproximadamente à 60 °C, durante 20 minutos. Triturou-se manualmente e pesou-se 5g de folhas frescas. Em um balão de 250 mL, adicionou-se 150 mL de Álcool Etílico 96% GL de pH 7,16, segundo a especificação técnica do fabricante, e no corpo extrator colocou-se o filtro em formato de cone com as folhas in natura trituradas e por último, montou-se o processo de extração via Soxhlet. Aqueceu-se à uma temperatura de ebulição aproximadamente 87°C e depois de alguns minutos iniciou-se a contagem dos refluxos que duraram 1h, no total foram 3 refluxos para cada amostra. Repetiu-se o mesmo processo para a extração alcóolica das folhas secas. Para a extração aquosa, as folhas frescas foram trituradas manualmente e pesou-se 5g de folhas para 150 mL, utilizando água de poço à um pH 6,0, segundo a verificação em laboratório. Em seguida, dentro do corpo do extrator colocou- se o filtro com as folhas frescas, montou-se o sistema de extração via Soxhlet, aqueceu-se à uma temperatura de ebulição aproximadamente 96 °C, depois de alguns minutos, iniciou-se os refluxos que duraram 1 h (Figura 1). Logo após a extração, concentrou-se o extrato alcóolico e aquoso em chapa térmica à 100 °C, até secar completamente e ser transferido para placa de petri. Paras as análises de FTIR- ATR (Espectroscopia de Infravermelho com Transformada de Fourier - Refletância Total Atenuada), não foi necessárias etapas de preparação longas das amostras e o uso de produtos químicos que são utilizados tradicionalmente em FTIR. O ATR é um método simples usado em combinação com a espectroscopia IR (ELZEY, 2018), por isso foi possível realizar a varredura diretamente na superfície do extrato concentrado seco (placa de petri), por fim, tratou-se os seus resultados no Origin 9Pro.
Resultado e discussão
Neste estudo, os espectros FTIR- ATR foram obtidos a partir de 4 amostras de
extrato de Crajiru por dois solventes diferentes, sendo uma a extração
alcóolica e a outra aquosa, em um equipamento de FTIR da marca Agilent,
modelo Cary 630 FTIR com dispositivo de ATR – Refletância total atenuada, na
resolução 8 cm-1 e na faixa de varredura de 4000 à 650 cm-1. Nesta técnica,
a qualidade da varredura, depende fortemente do contato direto entre a
superfície da amostra e a superfície do cristal ATR (SMITH, 2011). A figura
2 mostra os espectros de FTIR das amostras de extrato alcóolico das folhas
in natura e secas, bem como do extrato aquoso destas folhas. As
caracterizações dos picos mais relevantes destes espectros foram realizadas
utilizando comparações com a literatura. Em relação a análise dos espectros
do extrato alcóolico das folhas frescas e secas, observou-se a forte banda
de absorção presente na faixa de 3328 cm-1, comparado com os dados de Silva
Júnior, (2006), 3376 cm-1, indicam a presença do grupo hidroxila (-OH)
presentes em muitos constituintes do extrato alcóolico presente na solução
extratora, nesta faixa aproximadamente mostra as bandas características para
os flavonoides. Na faixa de 2113 cm-1, indica o grupo dos alcinos, como uma
vibração de estiramento C≡C que possui característica proeminente no
espectro de um alcino terminal, aparecendo aproximadamente nesta banda, a
mesma também será muito fraca ou ausente do espectro, comparado com os dados
de Oliveira e colaboradores (2016), 2117 cm-1. A faixa 1725 cm-1 apresenta
uma banda de absorção do grupo éster saturado (C═O), e está sujeita a
efeitos de conjugação e de efeito indutivo, comparados com os dados de Ilza
(2013) e Tavares (2012), 1723 cm-1. A forte banda de absorção no intervalo
de 1602 cm-1, representa o grupo dos alcenos (C=C), de acordo com a banda
de referência, 1600 cm-1 (PAVIA, et al., 2010), nessa região indica uma
banda intensa pertencente ao anel aromático. A banda localizada na região
1572 cm-1 aparece como uma intensidade média para forte, conforme os dados
da literatura à banda de referência 1574 cm-1, segundo Medina e
Colaboradores (2015), essa região representa o grupo das aminas primárias
(N-H) em modo de dobramento (scissoring), respectivamente possui um
estiramento assimétrico muito forte. Observou-se que a banda de 1394 cm-1
tem a característica do grupo dos alcanos que indicam picos de dobramento
CH3, por apresentar uma frequência relativamente baixa e alongada, nesse
sentido os alcanos possuem poucos espectros na região do infravermelho, esse
intervalo está localizada na banda de C═C do anel (SMITH, 2011), bandas
relativamente fortes nessa região possuem compostos aromáticos que são os
hidrocarbonetos possuem um ou mais anéis benzênicos. Para a faixa no
intervalo de 1036 cm-1, as bandas próximas desta faixa possuem um
alongamento das vibrações de ésteres e ácidos sulfônicos, respectivamente,
segundo os dados de referência, 1038 cm-1 (BERLA, 2008). E finalmente a
última faixa no intervalo de 827 cm-1, bandas nessa região indicam a
presença da vibração angular fora do plano de C-H de aromáticos (SKOOG et
al, 2010), de acordo com a comparação dos dados, 894 cm-1. Vale ressaltar o
surgimento de duas novas bandas de intensidade média na faixa de 2918 cm-1 e
2847 cm-1, nos espectros da amostra de extrato aquoso das folhas secas, devido à
presença do grupo formila de aldeídos, estas bandas em torno dessa região
aparecem em quase todos os espectros de compostos orgânicos, pois, segundo
Medina e colaboradores (2015) são decorrentes da presença do estiramento (-
CH), visto que, são insolúveis em solventes fortemente polarizado, como a
água, no entanto, são solúveis em solventes fracamente polarizados, como o
álcool. Para as análises preliminares dos espectros dos extratos aquoso e
alcóolicos das folhas in natura e secas, não foi observado mudanças no
comprimento de onda, exceto a intensidade das frequências dos espectros
apresentado. Destacando-se as bancas com maior intensidade presente no
extrato alcóolico das folhas in natura e secas ( 3328 cm-1; 1572 cm-1 ; 1394
e 1036 cm-1), seguido das bandas do extrato aquoso das folhas in natura e
secas (2918 cm-1; 2847 cm-1; 1725 cm-1; 1602 cm-1 e 827 cm-1).

Extração por Soxlet/Das Folhas in natura - a) Alcoólica ; b) Aquosa ; Das Folhas Secas - c) Alcoólica; d) Aquoso. Fonte: Autor
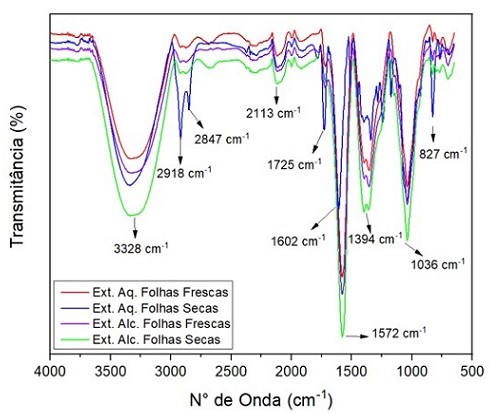
Espectros obtidos atráves da espectroscopia FTIR- ATR, dos extratos alcóolico e aquoso das folhas frescas e secas da planta A. chica.
Conclusões
Os resultados da espectroscopia de infravermelho obtidos colaboram para a ampliação do conhecimento acerca do gênero A. chica, por ser um procedimento analítico e contínuo. Nesse sentido, foi possível identificar a presença de grupos dos hidrocarbonetos, alcinos (C≡C), alcanos (CH3), alcenos (C=C), hidroxilas (-OH), carboxilato, ésteres saturado (C═O), aminas primárias (N-H), ácidos sulfônicos e núcleos aromáticos que possuem um ou mais anéis benzênicos, identificados através da comparação do comprimento de onda com as amostras analisadas. Observou-se que para o extrato aquoso de folhas secas apresentou o surgimento de duas bandas observado através dos resultados, grupos carbonila, aldeído e grupos alcanos, que são insolúveis em solventes fortemente polarizados e solúveis em solventes apolares, como o álcool. Para os extratos alcóolico e aquoso das folhas frescas, os espectros não apresentaram o surgimento de novas bandas, apenas ocorreu a mudança de intensidade das frequências. Nesses sentindo, a análise do extrato alcóolico e aquoso das folhas in natura e secas de Crajiru foi realizada com o objetivo de inferir informações preliminares sobre os constituintes químicos da planta.
Agradecimentos
Ao CEULM-ULBRA pela realização das extrações da matéria-prima. Ao apoio da Orientadora Prof. Dra. Liliam Gleicy de Souza Oliveira. Ao CTHM- IFAM pela disponibilização para as análises de FTIR-ATR.
Referências
ARO, A. A.; SIMÕES, G. F.; ESQUISATTO, M. A. M.; FOGLIO, M. A.; CARVALHO, J.; OLIVEIRA, A. L. R.; GOMES, L.; PIMENTEL, E. R.. Arrabidaea chica extract improves gait recovery and changes collagen content during healing of the Achilles tendon. Injury, v. 44, n. 7, p. 884-892, jul. 2013.
BARA, M. T. F.; RIBEIRO, P. A.M.; ARANTES, M. C. B.; AMORIM, L. L. S.; PAULA, J. R. Determinação do teor de princípios ativos em matérias-primas vegetais. Revista Brasileira de Farmacognosia, v. 16, n. 2, p. 211-215, jun. 2006.
BARBOSA, W. L. R. Manual para análise fitoquímica e cromatográfica de extratos vegetais. Universidade Federal do Pará (UFPA). Belém, 2001.
BALUNAS, M. J.; KINGHORN, D. A.. Drug discovery from medicinal plants. Life Sciences, v. 28, p. 431-441, 2015.
BATALHA, A.D.S.J.. Ação da Arribidaea chica Verlot (Bignoniaceae) sobre o envelhecimento celular. Dissertação em Imunologia Básica e Aplicada, Manaus, AM, 2017.
BERLA, S.M.C. Atividade inibitória in vitro de extratos de Arribidaea chica (Verlot.) sobre Candida albicans. Dissertação (Mestrado em Odontologia), Taubaté, SP, 2008.
BUENO, C. Z.; MORAES, Â. M. Influence of the incorporation of the antimicrobial agent polyhexamethylene biguanide on the properties of dense and porous chitosan-alginate membranes. Materials Science And Engineering: C, v. 93, p. 671-678, dez. 2018.
BUGNO, N.A. NICOLLETI, M. A.; ALMODÓVAR, A. A. B.; Pereira, M.T. Auricchio. Enxaguatórios bucais: Avaliação da eficácia antimicrobiana de produtos comercialmente disponíveis. Rev Inst Adolfo Lutz. P. 5-45, 2006.
ELZEY, B.; POLLARD, D.; FAKAYODE, S. O.. Determination of adulterated neem and flaxseed oil compositions by FTIR spectroscopy and multivariate regression analysis. Food Control 2016, 68, 303–309.
EMEA (European Medicines Agency). “Public Statement on the Risks associated with the use of Herbal Products containing Aristolochia Species". 23 de nov. 2005.
HANDA, S. S.; KHANUJA, S. P.; LONGO, G.; RAKESH, D. D.. Extraction technologies for medicinal and Aromatic Plants. International Centre For Science and High Technology. Trieste, 2008.
ILZA, S.O.M. Avaliação das Estabilidade do Extrato Seco e Formulações de bases semi Sólidas, contendo Arribidaea chica Verlot, para uso em cicatrização. Dissertação em Biociências e Tecnologia de Produtos Bioativos, Campinas, SP, 2013.
MEDINA, L. S.. Arribidaea chica Verlot: Formulações de liberação sustentada para aplicação em úlceras de mucosa e pele. Tese (Doutorado em Odontologia) – Faculdade de Odontologia, Universidade Estadual de Campinas, p. 133, 2014.
NEWMAN, D. J.; CRAGG, G. M.. Natural Products as Sources of New Drugs over the Last 25 Years⊥. Journal Of Natural Products, v. 70, n. 3, p. 461-477, mar. 2007.
PAIVA, D.L. LAMPMAN, G. M.; KRIZ, G. S.; VYVYAN, J. R.. Introdução à Espectroscopia. CENGAGE Learning, ed. 4. 2010, p.716 – ISBN – 10: 8522107084.
PIRES, A. L. R.; BIERHALZ, A. C. K.; MORAES, Â. M.. BIOMATERIALS: types, applications, and market. Química Nova, p. 1-15, 2015.
PINTO, L. N.. Levantamento etnofarmacêutico dos fitoterápicos tradicionais utilizados no município de Cametá e análise de Arrabidaea chica (HBK) Verlot.
Belém, 77p. Monografia de Especialização, Faculdade de Farmácia, Universidade Federal do Pará, 2004.
SMITH, B. C.. Fundamentals of Fourier Transform Infrared Spectroscopy. Taylor & Francis Group, p. 1-207, 9 mar. 2011.
SIMÕES, C. M. O.; SCHENKEL, E. P.; GOSMANN, G.; MELLO, J. C. P.; METNTZ, L. A.; PETROVICK, P. R.. Farmacognosia: da planta so medicamento. Florianópolis: Editora da UFSC; Porto Alegre: Editora da UFSC, 2007.
SILVA F.; CASAI, V. W. D.. And aromatic plants medicinais: Postoperative essenciais colheita and oils. Viçosa: Art and Books, p. 135, 2000.
SKOOG, D. A.; HOLLER, F. J.; NIEMAN, T. A.. Princípios de Análise Instrumental. 5ª edição. Porto Alegre: Bookman, 2002.
ZHANG, Y.; CHAN, H. F.; LEONG, K. W.. Advanced materials and processing for drug delivery: the past and the future. Advanced Drug Delivery Reviews, v. 65, n. 1, p. 104-120, jan. 2013.


