MATRIZES POLIMÉRICAS DE QUITOSANA: SÍNTESE, CARACTERIZAÇÃO E LIBERAÇÃO CONTROLADA DE NAPROXENO®
- Home
- Trabalhos
ÁREA
Química de Materiais
Autores
Maceno, D.M.S.C.S. (UNIPAMPA) ; Machado, M.L. (UNIPAMPA) ; Camargo, M.F. (UNIPAMPA) ; Pozzer, C.R. (UNIPAMPA) ; Silva, Y.J.C. (UNIPAMPA) ; Souza, R.F. (UNIPAMPA) ; Vasconcelos, R.H.M. (UNIPAMPA) ; Silva, M.D.C.R. (UFSM) ; Liendo, M.A. (UNIPAMPA)
RESUMO
Matrizes poliméricas (MP) de quitosana vêm despertando atenção para uso como carreadoras de fármacos devido a sua biodegradabilidade e biocompatibilidade. No presente trabalho foram obtidas e caracterizadas MP de quitosana, em formato de filme, para a liberação controlada de Naproxeno®. A quantidade de princípio ativo (PA) presente no medicamento e o grau de desacetilação (GD) da quitosana, também foram avaliados. O valor médio achado do GD foi de 88,1% e do PA 497,08 mg/c. As MP apresentaram boas características de manipulação, translucidez e cor. As MP mostraram um valor de espessura de 0.04 mm e 2,8E-7 g/mhPa de permeabilidade ao vapor de água, comportamento flexível, perda de cristalinidade em relação à quitosana pura e um perfil de liberação gradativo do fármaco nas primeiras 5h.
Palavras Chaves
Liberação Controlada; Quitosana; Biofilme
Introdução
Em geral, um fármaco é constituído por um princípio ativo e deve ser ingerido pelo paciente através de uma via de administração apropriada. Podem ser encontrados nas formas farmacêuticas sólidas, semi sólidas e líquidas. As sólidas orais são as mais utilizadas e classificadas como convencionais ou modificadas (ALENCAR, 2018). Registra-se a existência de uma pluralidade de sistemas de liberação de fármacos, aparecendo expressões para defini-los como liberação retardada (RETARD), repetida, controlada (CR), sustentada (SR), entre outras. Estas designações não se limitam apenas à ação farmacológica como também ao processo tecnológico de obtenção dos medicamentos (BHOWMIK et al 2012). Em terapias convencionais de administração, a concentração da droga na corrente sanguínea aumenta até atingir o nível máximo de dissolução e então declina, sendo requerida a administração de nova dose para manter os níveis de concentração adequados. Elevadas concentrações acima do considerado como faixa terapêutica podem conduzir à toxicidade, enquanto concentrações subterapêuticas são ineficazes e podem, em alguns casos, levar à ineficácia do fármaco (LYRA et al, 2007). Com o propósito de minimizar esse efeito, pesquisas recentes tornaram possível o desenvolvimento de sistemas de liberação controlada com o objetivo de modular a liberação do fármaco na faixa terapêutica por tempo prolongado utilizando-se dosagem única (BIZERRA; SILVA, 2016). Diversos sistemas de liberação controlada têm sido alvo de pesquisas utilizando biopolímeros como carreadores para liberação de fármacos. (MONÇÃO, 2018). O constante avanço tecnológico industrial combinado com o crescimento na produção e comercialização de produtos tem sido repensada por consumidores, empresários e pesquisadores que descobriram nos polímeros naturais uma fonte de produtos com características biodegradáveis, não tóxicos, recicláveis e de fonte renovável (SANTOS, 2018). Um biopolímero é um material de origem renovável e biodegradável. Além disso os biopolímeros também podem ser biocompatÍveis, ou seja, não iniciam processos imunes ou inflamatórios, são estáveis durante o seu tempo de ação no corpo e completamente metabolizados pelo organismo (BHOWMIK et al 2012; THASSU; DELEERS; PATHAK, 2007). A quitina é um biopolímero que possui importante função no exoesqueleto e paredes celulares dos organismos nos quais são constituintes (RIBEIRO, 2017). Através de tratamento químico, a quitina, é desacetilada A desacetilação da quitina é realizada para produzir seu principal derivado, a quitosana (PUVVADA; VANKAYALAPATI; SUKHAVASI, 2012; CHIAPPISI; GRADZIELSKI, 2015). A reação de hidrólise alcalina dos grupos acetamida constituintes da cadeia molecular da quitina resulta na obtenção de quitosana (CAMPANA-FILHO et al, 2007). Durante o processo de desacetilação da quitina, ocorre a formação de unidades de aminas livres na cadeia da quitosana (RIBEIRO, 2017). Os grupos amínicos livres são o principal fator das múltiplas aplicações tecnológicas deste biopolímero (LERTSUTTHIWONG et al., 2002). O grau de desacetilação define o biopolímero como quitínico, devido a sua estrutura cristalina altamente organizada e pouco solúvel, ou quitosânico, maior reatividade química e solubilidade (LOPES et al, 2017). Assim, à medida que o grau de desacetilação aumenta, a solubilidade da quitosana em meio aquoso também aumenta (DIAS et al, 2013). Materiais poliméricos a base de quitosana tem recebido uma atenção especial, devido especialmente a suas propriedades que são essenciais na aplicação de filmes e revestimentos farmacêuticos (AZEVEDO, 2007). As suas propriedades, que apresentam proximidade às do tecido natural, tais como hidrofilidade, expansibilidade, permeabilidade seletiva, consistência macia e baixa tensão interfacial faz desses materiais promissores candidatos para aplicação na recuperação de tecidos lesionado, na engenharia de tecidos (GUIMARÃES, 2018). Sendo assim, a inclusão de fármacos como anti-inflamatórios a filmes de quitosana permitiria não só a recuperação dos tecidos lesados, mas também o controle de processos inflamatórios e da dor local (VEIGA, 2012). Estes dispositivos são normalmente classificados em dois tipos, reservatório ou matriz. No tipo matriz, o fármaco se encontra dissolvido ou disperso homogeneamente na matriz polimérica, à base de quitosana para a liberação do fármaco. O presente trabalho teve por objetivos a produção e caracterização de matrizes poliméricas (MP) de quitosana, com incorporação de Naproxeno®, visando o controle de sua liberação. Realizaram ensaios a fim de avaliar as MP obtidas em relação a suas propriedades mecânicas de tração, sua espessura, estrutura cristalina mediante difração de raio X e permeabilidade ao vapor de água. Além disso, a quantidade de princípio ativo presente no fármaco, o grau de desacetilação da quitosana e o intumescimento das matrizes poliméricas de quitosana com incorporação de Naproxeno® em água foram investigados.
Material e métodos
Os reagentes utilizados (P.A.) foram ácido acético, álcool etílico, Naproxeno® (comprimidos de 550 mg/cp de farmácia de manipulação), água destilada e Quitosana (Golden-Shell Pharmaceutical). Para obtenção e caracterização das MP utilizou-se: agitador mecânico (S P Labor, RH B), balança analítica (Shimadzu, AUY 22) e digital (Quimis, UX420H), chapa de aquecimento (Quimis); estufa (Terroni, LS3000), difratômetro (Rigaku, Miniflex 300), Espectrofotômetro (Equilam, UV755B), Estufa (Ética, ETC 45), pHmetro (Bante Instrument, PHS-3BW), texturometro (Stable Micro Systems), e dessecador. A quantificação do princípio ativo, nos comprimidos de Naproxeno® Sódico, foi realizada segundo o método descrito por Feltre (1994) de titulometria volumétrica. O preparo da solução filmogênica seguiu a metodologia descrita por Alencar et al. (2018). Foi dissolvida quitosana (0,5g) em 50 ml de ácido acético 1% (v/v), seguida da dispersão do fármaco, com aquecimento por 40 min a 20ºC e agitação constante. A solução, disposta em placas de Petri, foi colocada em estufa a 20 ºC por 24h. Após, as MP foram lavadas com NaOH (0,01M) e água e realocados em dessecador por 24h. O grau de desacetilação da quitosana foi determinado dissolvendo 0,2g da mesma em solução de HCl (0,1M) e água destilada 2:1 (v/v) com adição gradual de NaOH (0,01M) até pH 2, logo iniciou-se a titulação com NaOH (0,01M), até pH maior que 9. (CARVALHO, 2017; ABREU, 2013). O índice de cristalinidade foi determinado conforme método de DRX, descrito por Dallan (2005), com radiação de cobre Ka, 40 kV, 20 mA, varredura angular de 0 a 80° e passo angular de 0,02°. As medidas de espessura foram feitas, em dez regiões, com micrômetro externo digital. Os ensaios de tração foram baseados na norma ASTM (2012), com corpos de prova de 10 mm por 80 mm (GUIMARÃES, 2018). Os testes foram realizados a 19ºC e umidade relativa de 89%, em texturômetro a 10mm/min (SANTOS, 2018). A determinação da PVA foi baseada na norma E96-95 da American Society for Testing and Materials (1995) conforme descrito por Morelli (2010). O perfil de liberação do fármaco em água foi avaliado mediante o monitoramento de sua concentração. Para isto, as MP foram imersas em béqueres contendo 100ml de água, (pH 7) e alocados em estufa a 37ºC, por 24 h. Em intervalos de tempo foram retiradas alíquotas da solução e analisadas em espectrofotômetro em 331 nm. Para a determinação do espectro de absorção no UV-Vis do Naproxeno® foi preparado uma solução com 50 mg deste e 100 ml de solução filmogênica, 10 ml da solução resultante foi diluída em 100 ml de água para varredura no intervalo 318-335 nm. O comprimento de onda de maior pico foi utilizado para a obtenção da curva de calibração (AMARAL, 1997). A concentração do Naproxeno® foi determinada a partir da curva de calibração. O grau de intumescimento das MP de quitosana com adição de Naproxeno®, foi realizado seguindo o método de Lamim (2006).
Resultado e discussão
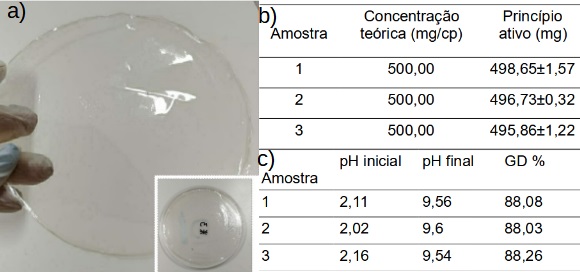
A Figura 1 (a) mostra a aparência de uma matriz polimérica de quitosana,
contendo Naproxeno®, obtida em formato de filme. De um modo geral, todas as
matrizes poliméricas obtidas apresentaram boa transparência à luz visível,
aderência, coloração levemente amarelada, flexibilidade e resistência mecânica
ao toque. Características como aderência, elasticidade e flexibilidade são de
extrema importância para biomateriais (SANTOS, 2018). Guimarães (2018) obteve
filmes de quitosana pura com grau de desacetilação (GD) de 85% apresentando
coloração levemente amarelada. Na tabela da Figura 1 (b) pode se notar que o
valor médio do grau de desacetilação encontrado no presente estudo foi de
88,1%, próxima ao valor encontrado por Guimarães (2018). Por outro lado, Cruz
(2017), ao realizar o mesmo teste de titulação potenciométrica efetuado no
presente estudo para determinação do grau de desacetilação em quitosana
adquirida do mesmo fornecedor, encontrou um valor de 89%. Além disso, conforme a
literatura, outros trabalhos encontraram em quitosana comercial purificada um
valor de grau de desacetilação entre 70% e 90% (MEDEIROS 2019; DALLAN 2005;
FIORI et al, 2014 ). Medeiros (2019) afirma que esses valores correspondem a
um 89,9% de grupos amino livres e a um 10,1% de grupos acetamida. Conforme Abreu
(2013), o valor do grau de desacetilação obtido pelo método de titulação
potenciométrica é bastante confiável quando as soluções de HCl e NaOH 0,1 mol /L
são padronizadas e quando as amostras de quitosana são totalmente solúveis na
solução de HCl. Por tanto o valor obtido no presente trabalho pode ser
considerado confiável devido ter sido obtido o mesmo nas condições mencionadas.
Abreu (2013) ainda afirma que a diferença de volume entre os pontos de inflexão
apresentados pela titulação corresponde ao ácido consumido para a protonação dos
grupos presentes na cadeia polimérica da quitosana.
A tabela da Figura 1 (c) apresenta os valores obtidos na determinação do teor do
princípio ativo de Naproxeno® por unidade de comprimido íntegro. A concentração
fornecida pelo fabricante, denominada concertação teórica, foi de 500 mg/cp.
Pode se observar que foi obtido, no presente estudo, um valor médio de princípio
ativo de 497,08 mg/cp, o que corresponde a uma porcentagem de princípio ativo
médio de 99,41%, estando em conformidade com as especificações estabelecidas
pela Agência Nacional de Vigilância Sanitária (BRASIL, 2010) que estabelece um
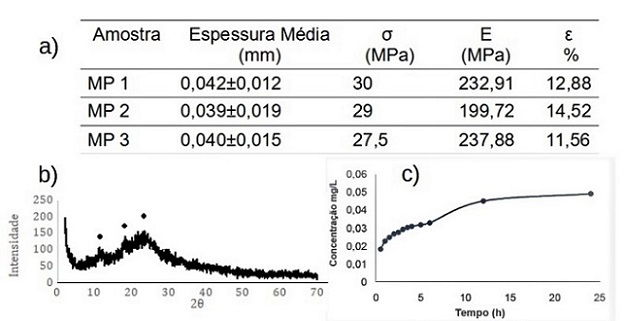
teor de Naproxeno® entre 99% e 101%. Na tabela da Figura 2 (a) apresentam-se os
valores de espessura média e desvio padrão para as matrizes poliméricas de
quitosana contendo Naproxeno®. Esses valores foram utilizados nas análises de
permeabilidade ao vapor de água e no cálculo da tensão máxima de tração
correspondente aos ensaios mecânicos. Nota-se que as matrizes poliméricas
apresentaram-se com espessura média de 0,04mm ordem de grandeza de espessura que
configura a matriz polimérica um filme. Dallan (2005), obteve filmes mediante
soluções de quitosana de 1,0 a 2,5% (m/m) a partir da dissolução do material em
solução aquosa de ácido acético a 1,0% (v/v). O menionado autor, ao avaliar a
espessura dos filmes resultantes nessas condições obteve um valor médio de
0,2mm, valor acima do encontrado no presente trabalho. Entretanto, Rachtanapun
et al (2021) nas matrizes poliméricas de quitosana com incorporação de Curcuma
longa L. encontraram espessuras na ordem de 0,04mm.
Na tabela da Figura 2 (a) são exibidos os parâmetros obtidos a partir do ensaio
mecânico de tração ao qual as matrizes poliméricas foram submetidas. Este ensaio
mostrou valores médios de 28,3 MPa, 223,5 MPa e 13% de tensão máxima de ruptura,
módulo de elasticidade e elongação, respectivamente. No trabalho de Fiori et al
(2014), os mesmos parâmetros encontrados em filmes de quitosana pura (GD 70%)
apresentaram valores de tensão máxima de ruptura de 12,0 MPa, módulo de
elasticidade de 576,9 MPa; e elongação de 2,1%, além disso os autores afirmaram
que os filmes de quitosana apresentaram um comportamento rígido, com altos
módulos de elasticidade e baixos valores de elongação. Realizando uma
comparação, no presente estudo o valor de elongação foi 520% maior e o módulo de
elasticidade 61,3% menor do que os valores encontrados para esses parâmetros no
trabalho de Fiori et al (2014). Os valores obtidos mostram que as matrizes
poliméricas contendo Naproxeno® apresentaram maior flexibilidade, do que filmes
para quitosana pura, o qual é compatível visando o uso do material para a
liberação controlada de medicamentos. Além disso Rachtanapun et al (2021)
acharam valores de tensão de ruptura no intervalo de 12 MPa, a 30 MPa, para
filmes de quitosana com diferentes quantidades de Curcuma longa L. Entretanto, a
partir dos valores da Tabela da Figura 2 (a) pode se observar também que a
tensão máxima de ruptura de 50 MPa achada no trabalho de Guimarães (2018) para
filmes de quitosana pura encontram-se na mesma ordem de grandeza, o que pode
significar que a incorporação do Naproxeno® não prejudica a sua resistência
mecânica à tração. Cabe lembrar que a cristalinidade de um material e o tipo de
ligações entre as suas moléculas têm influência sobre o seu comportamento
mecânico (CALLISTER, 2012). Azevedo (2007) ressalta que a cristalinidade de um
biofilme de quitosana contendo Naproxeno® está relacionada tanto com o seu grau
de desacetilação quanto com as características do fármaco. Na Figura 2 (b)
observa-se que o difratograma obtido de uma matriz polimérica contendo
Naproxeno® apresenta dois halos próximos aos picos característico da quitosana
pura a 10° e 20 º (Oliveira, 2016). O deslocamento observado dos halos para 12º
e 23º e o aparecimento de um leve pico em 19º sugere, conforme Medeiros (2019),
que a introdução de Naproxeno® em filmes de quitosana pura age modificando a sua
estrutura. A partir destes halos foi determinado o índice de cristalinidade
(FERNANDEZ et al 2014; HAO et al 2021). O resultado encontrado do índice de
cristalinidade no presente trabalho foi de 49,67% para as matrizes poliméricas
contendo o fármaco. O reportado por Medeiros (2019) para índice de
cristalinidade no seu trabalho foi um valor de 60,9% para quitosana pura e 48,6%
para filmes de quitosana contendo Naproxeno®, este autor sugere que a introdução
do fármaco no filme aumenta a sua desordem, diminuindo a sua cristalinidade, a
qual está relacionada com o caráter das ligações inter e intramoleculares no
mesmo. Os resultados de PVA das MP obtidas exibiram uma média de 2,8E-7 g/mhPa.
Perdana, et al (2021) encontraram para filmes de quitosana com incorporação de
óleo essencial de limão valores entre 6,5 E-6 g/mhPa a 1,5 E-6 g/mhPa dependendo
da quantidade de óleo incorporada. Entretanto Moura et al (2012) em filmes de
quitosana pura (GD 84%) acharam valores na mesma ordem de grandeza que a
encontrada no presente trabalho. A curva do perfil de liberação do fármaco pode
ser avaliada a partir da Figura 2 (c). Pode-se observar que nas primeiras 5
horas de ensaio existiu uma liberação gradativa atingindo um máximo às 24h.
Medeiros (2019) obteve um tempo de liberação máxima de 3h e atribuiu esse
comportamento à dissociação do Naproxeno® em pH 7. Já Veiga (2021), avaliando
diferentes matrizes biopoliméricas para liberação controlada de fármacos obteve
tempo de liberação máxima inferior a 1h. O resultado referente a intumescimento
apresentou um padrão de absorção de água rápido pois em aproximadamente 30
minutos este comportamento impossibilitou a retirada e pesagem proposta
inicialmente. Conforme Assis (2003), a quitosana apresenta predominância de
grupos amino caracterizados por ligações covalentes (N-H), os quais geram sítios
de alta polaridade, este fato e a presença de grupos acetamido favorecem o
arranjo molecular de água ao redor do biopolímero e incrementam a retenção e
afinidade pela mesma.
a)MP sintetizada com adição do fármaco b) GD da quitosana comercial. c) Quantidade de princípio ativo teórico e real presente no fármaco.
MP contendo o fármaco a) Espessura e propriedades mecânicas. b) Difratograma. c) Perfil de liberação do fármaco (331 nm).
Conclusões
No presente trabalho foram sintetizadas e caracterizadas matrizes poliméricas de quitosana com incorporação de Naproxeno® para avaliação de seu perfil de liberação. Cada comprimido de Naproxeno® utilizado para síntese das MP apresentou uma concentração de princípio ativo de 497,08 mg/cp. A quitosana utilizada evidenciou um GD de 88,1%. As MP de quitosana com adição de Naproxeno® apresentaram resultados satisfatórios, com boa homogeneidade, continuidade, manuseabilidade, e espessura média de 0,04mm. Os ensaios mecânicos de tração realizados sobre as MP de quitosana com adição de Naproxeno® apontaram um significativo aumento na elongação e diminuição do módulo de elasticidade em relação a filmes de quitosana pura, reportados na literatura, caracterizando um comportamento flexível. Foi possível avaliar a estrutura cristalina das MP de quitosana com adição de Naproxeno® mediante a observação de seu difratograma o qual apresentou características amorfas com halos próximos aos picos correspondentes à quitosana pura, entretanto o deslocamento desse picos pode sugerir que o fármaco modifica a estrutura, diminuindo a sua cristalinidade. Resultados dos ensaios de PVA (2,8E-7 g/mhPa) mostraram valores na mesma ordem de grandeza que os encontrados na literatura O ensaio de intumescimento das MP de quitosana com adição de Naproxeno® mostrou que as mesmas são hidratadas rapidamente perdendo a sua forma original o qual pode estar associado às características da quitosana usada e ao filme, como GD e cristalinidade. A presença de grupos amino e acetamido incrementam a retenção e afinidade pela água e materiais poliméricos amorfos facilitam a absorção de água devido à suas ligações intramoleculares e mobilidade de suas cadeias. O perfil de liberação mostrou uma concentração de Naproxeno® em solução máxima após 5h de ensaio. Estes resultados indicam que os filmes obtidos, podem ser considerados como matrizes carreadoras de Naproxeno® para aplicações biomédicas e farmacêuticas.
Agradecimentos
Agradecemos à Unipampa e a todos os que direta ou indiretamente contribuíram na elaboração deste trabalho
Referências
ABREU, F. O. M. S. et al. Propriedades e características da quitosana obtida a partir
do exoesqueleto de caranguejo-uçá utilizando radiação de microondas. Polímeros,
v. 23, n. 5, p. 630-635, 2013. Disponível em:
http://www.scielo.br/scielo.php?pid=S0104-
14282013000500011&script=sci_abstract&tlng=pt. Acesso: 14 set. 2021.
ALENCAR, G. de O. et al. Liberação prolongada de fármacos e suas aplicações
farmacológicas: revisão sistemática. Revista E-Ciência, v. 6, n.1, p. 5-10, 2018.
Disponível em:
http://www.revistafjn.com.br/revista/index.php/eciencia/article/view/09/PDF%20-
%20317. Acesso em: 2 set. 2021.
AMARAL, M. H. dos A. R. Estudo do Naproxeno em formas de aplicação
cutânea. 1997. 159 f. Dissertação (Mestrado em Controle de Qualidade) –
Faculdade de Farmácia da Universidade do Porto. Programa de Pós-Graduação em
Controle de Qualidade, Porto, 1997. Disponível em: https://repositorio
aberto.
up.pt/bitstream/10216/10167/3/281_TM_01_P.pdf. Acesso em: 3 set. 2021.
ASSIS, O. B. G.; SILVA, V. L. Caracterização estrutural e da capacidade de
absorção de água em filmes finos de quitosana processados em diversas
concentrações. Polímeros: Ciência e Tecnologia, v. 13, n. 4, p. 223-228, 2003.
AZEVEDO, V. V. C. et al. Quitina e quitosana: aplicações como biomateriais.
Revista eletrônica de materiais e processos. v. 2, n. 3, p. 27-34, 2007. Disponível
em: http://www2.ufcg.edu.br/revista-remap/index.php/REMAP/article/view/46/81.
Acesso em: 18 Ago. 2021.
BIZERRA, A.; SILVA, V. Sistemas de liberação controlada: mecanismos e
aplicações. Revista Saúde e Meio Ambiente, v. 3, n. 2, p. 1-12, 2016. Disponível
em: http://www.seer.ufms.br/ojs/index.php/sameamb/article/view/1943/0. Acesso em:
18 set. 2021.
BHOWMIK D, GOPINATH H, LUMAR B.P, DURAIVAL S, KUMAR K.P.S. Controlled Release drug delivery system. The Pharma innovation 2012; 1:24-322. Disponível
em: http://www.thepharmajournal.com/. Acesso em: 23 ago. 2021.
BRASIL. Agência Nacional de Vigilância Sanitária. Modelo de bula com
informações técnicas aos profissionais de saúde. Brasília: ANVISA, s.d.
Disponível em:
http://www.anvisa.gov.br/datavisa/fila_bula/frmVisualizarBula.asp?pNuTransacao=44
10952017&pIdAnexo=5405133. Acesso em: 2 set 2021.
CAMPANA-FILHO, S. P. et al. Extração, estruturas e propriedades de a-quitina e ß-
quitina. Química Nova, v. 30, n.3, p. 644-650, 2007. Disponível em:
http://www.scielo.br/pdf/%0D/qn/v30n3/25.pdf. Acesso em: 13 set 2021.
CALLISTER JR., W. D.; RETHWISCH, D. G. Ciência e Engenharia dos Materiais: Uma Introdução. Rio de Janeiro. LTC. 8° Edição, 2012.
CARVALHO, I. C. Hidrogéis híbridos poliméricos de quitosana funcionalizada e
gelatina fotoreticulados como matrizes porosas tridimensionais para potencial
reparo de tecido epitelial. 2017. 168 f. Dissertação (Mestrado em Ciência e
Engenharia de Materiais) – Escola de Engenharia. Universidade Federal de Minas
Gerais. Programa de Pós Graduação em Engenharia Metalúrgica, Materiais e de
Minas, Belo Horizonte, 2007. Disponível em:
http://www.bibliotecadigital.ufmg.br/dspace/bitstream/handle/1843/BUOS
AVBKAN/
isadoracota_disserta__o.pdf?sequence=1. Acesso em: 17 Ago. 2021.
CHIAPPISI, L.; GRADZIELSKI, M. Co-assembly in chitosan-surfactant mixtures:
thermodynamics, structures, interfacial properties and applications. Advances in
Colloid and Interface Science, v. 220, p. 92-107, 2015. Disponível em:
https://www.sciencedirect.com/science/article/pii/S0001868615000573. Acesso em:
23 ago. 2021.
CRUZ, S. K. Estudo de hidrogéis de quitosana/PVA: síntese, caracterização e
aplicação. Orientadora: Maria Alejandra Liendo. 2017. 57 f. Trabalho de Conclusão
de Curso (Bacharelado em Engenharia Química) – Universidade Federal do Pampa,
Bagé, 2017.
DALLAN, P. R. M. Síntese e caracterização de membranas de quitosana para
aplicação na regeneração de pele. 2005. 212 f. Tese (Doutorado em Engenharia
Química) – Faculdade de Engenharia Química, Universidade Estadual de Campinas.
Programa de Pós-Graduação em Engenharia Química, Campinas, 2005. Disponível
em: http://repositorio.unicamp.br/jspui/handle/REPOSIP/267454. Acesso em: 15
Ago 2021.
DIAS, K.B., SILVA, D.P., FERREIRA, L., COSTA, J.L., LUÍS, A., SILVA, L.D., SCHEIDT, G.N. Quitina e quitosana: características, utilizações e perspectivas
atuais de produção. Journal of Biotechnology and Biodiversity. v.4, n.3, p.184-
191, 2013. Disponível em:
https://sistemas.uft.edu.br/periodicos/index.php/JBB/article/view/599/347. Acesso
em: 14 Ago. 2021.
FERNÁNDEZ M. F. , ARANCIBIA M. , LÓPEZ C. E. , C. GÓMEZ G. P. MONTERO, M. FERNÁNDEZ G, Preparation and Molecular Characterization of Chitosans Obtained from Shrimp (Litopenaeus vannamei) Shells 2014 / 09 Vol. 79; Iss. 9 Disponível em:https://pubmed.ncbi.nlm.nih.gov/25155351/
Acesso em:1 set. 2021.
FIORI, A. P. S. M., GABIRABA, V. P., PRAXEDES, A. P. P., NUNES, M. R. S., BALLIANO, T. L., SILVA, R. C., TONHOLO, J., & RIBEIRO, A. S. Preparação e caracterização de nanocompósitos poliméricos baseados em quitosana e argilo minerais. Polímeros 24 (5) Out 2014 Disponível em http://dx.doi.org/10.1590/0104-1428.1572. Acesso em: 9 set. 2021.
GUIMARÃES, A. A. S. Hidrogéis à base de quitosana/poli (álcool vinílico) para
liberação de fármaco visando uso potencial como curativo. 2018. 180 f. Tese
(Doutorado em Ciência e Engenharia de Materiais) – Universidade Federal da
Paraíba. Programa de Pós-Graduação em Ciência e Engenharia de Materiais, João
Pessoa, 2018. Disponível em:
https://repositorio.ufpb.br/jspui/handle/123456789/13408. Acesso em: 11 set 2021.
GUIMARÃES, P. Q. Metodologia baseada em NIRS e Quimiometria para a
determinação de parâmetros de qualidade da quitosana para fins biomédicos.
2017. 77 f. Dissertação (Mestrado em Química) – Universidade Estadual da Paraíba.
Programa de Pós-Graduação em Química, Campina Grande, 2017. Disponível em:
http://tede.bc.uepb.edu.br/jspui/handle/tede/2918. Acesso em: 24 Ago. 2021.
Hao, G., Hu, Y., Shi, L. et al. Physicochemical characteristics of chitosan from swimming crab (Portunus trituberculatus) shells prepared by subcritical water pretreatment. Sci Rep 11, 1646 (2021). Disponível em: https://doi.org/10.1038/s41598-021-81318-0 Acesso em: 10 Ago. 2021.
HOWLING, G. I. et al. The effect of chitin and chitosan on the proliferation of human
skin fibroblasts and keratinocytes in vitro.Biomateriais, v. 22, n. 22, p. 2959-2966,
2001. Disponível em: https://doi.org/10.1016/S0142-9612(01)00042-4. Acesso em:
28 Ago. 2021.
LERTSUTTHIWONG, P. et al. Effect of chemical treatment on the characteristics of
shrimp chitosan. Journal of Metals, Materials and Minerals. v. 12, n. 1, p. 11-18,
2002. Disponível em:
https://www.researchgate.net/profile/Pranee_Rojsitthisak/publication/228871672_Eff
ect_of_Chemical_Treatment_on_the_Characteristics_of_Shrimp_Chitosan/links/0dee
c51ea367cc149e000000/Effect-of-Chemical-Treatment-on-the-Characteristics-of-
Shrimp-Chitosan.pdf. Acesso em: 26 set. 2021.
LOPES, C. M.; LOBO, J. M. S.; COSTA, P.. Formas farmacêuticas de liberação
modificada: polímeros hidrofílicos. Revista Brasileira de Ciências Farmacêuticas,
v. 41, n. 2, p. 143-154, 2005.
LYRA, M. A. M. de et al. Sistemas matriciais hidrofílicos e mucoadesivos para
liberação controlada de fármacos. Latin American Journal of Pharmacy, v. 26, n.
5, p. 784-793, 2007. Disponível em:
http://www.latamjpharm.org/trabajos/26/5/LAJOP_26_5_5_1_5NH237W57Y.pdf .
Acesso em: 22 Ago. 2021.
MEDEIROS, R. D. S. Preparação, caracterização e estudo de dissociação do naproxeno em uma matriz de quitosana. 2019 Dissertação de mestrado
Química Analítica e Inorgânica Instituto de Química de São Carlos
Disponível em:
https://doi.org/10.11606/D.75.2019.tde-25092019-091335; Acesso em:13 ago. 2021
MONÇÃO, C. P. Liberação de princípios ativos revestidos com biosistemas
poliméricos. Dissertação (Mestrado em Engenharia de Materiais e
Nanotecnologia) – Universidade Presbiteriana Mackenzie. Programa de Pós-
Graduação em Engenharia de Materiais e Nanotecnologia, São Paulo, 2018.
Disponível em:
http://tede.mackenzie.br/jspui/bitstream/tede/3737/5/Camila%20Para%c3%adso%20
Mon%c3%a7%c3%a3o.pdf . Acesso em: 8 Ago. 2021.
MORELLI, F. C.; RUVOLO FILHO, A. Nanocompósitos de polipropileno e argila
organofílica: difração de raio X, espectroscopia de absorção na região do
infravermelho e permeação ao vapor d'água. Polímeros [online], v. 20, n. 2, pp.121-
125. May 07, 2010. Disponível em: http://dx.doi.org/10.1590/S0104-
14282010005000014. Acesso em: 16 Ago. 2021.
MOURA, J.M. FARIAS, B.S.; RODRIGUES, D. A. S.; MOURA, C.M. Filmes de quitosana com diferentes graus de desacetilação. 2012 Anais Virtuais do 52º CBQ. disponível em: http://www.abq.org.br/cbq/2012/trabalhos/9/1658-13435.html acesso em: 5 set. 2021.
OLIVEIRA, D. G. Desenvolvimento e caracterização físico-química e
morfológica de biofilmes de quitosana nacionais. Orientadora: Rosemary Souza
Cunha Lima. 2016. 43 f. Trabalho de Conclusão de Curso (Bacharel em Farmácia) –
Universidade Estadual da Paraíba, Campina Grande, 2016. Disponível em:
http://dspace.bc.uepb.edu.br/jspui/handle/123456789/13591. Acesso em: 28 Ago.
2021.
PERDANA, M. I. RUAMCHAROEN J., PANPHON S. , LEELAKRIANGSAK M. Antimicrobial activity and physical properties of starch/chitosan filin corporated with lemongrass essential oil and its application. LWT, v141, 2021, Disponível em:
https://doi.org/10.1016/j.lwt.2021.110934. Acesso em: 7 set. 2021
PUVVADA, Y. S.; VANKAYALAPATI, S.; SUKHAVASI, S. Extraction of chitin from
chitosan from exoskeleton of shrimp for application in the pharmaceutical industry.
International Current Pharmaceutical Journal, v. 1, p. 258-263, 2012. Disponível
em: http://www.icpjonline.com/documents/Vol1Issue9/06.pdf?. Acesso em: 9 set.
2021.
RACHTANAPUN, P.; KLUNKLIN, W.; JANTRAWUT, P.; JANTANASAKULWONG K.; PHIMOLSIRIPOL, Y.; SEESURIYACHAN, P.; LEKSAWASDI, N.; CHAIYASO, T.; RUKSIRIWANICH, W.; PHONGTHAI, S.; SOMMANO, S, R.; PUNYODOM W, REUNGSANG A, NGO TMP Characterization of Chitosan Film Incorporated with Curcumin Extract. 2021 Polymers 2021, 13, 963 Disponível Em:
https://www.mdpi.com/journal/polymers Acesso em: 14 set. 2021
RIBEIRO, A. G. O. Produção de quitosana a partir dos caranguejos dilocarcinus
pagei stimpson, 1861, capturados no município de Itacoatiara (AM). 2017. 90 f.
Dissertação (Mestrado em Ciência e Tecnologia para Recursos Amazônicos) -
Universidade Federal do Amazonas. Programa de Pós-Graduação em Ciência e
Tecnologia para Recursos Amazônicos, Itacoatiara, 2017. Disponível em:
http://tede.ufam.edu.br/handle/tede/6237. Acesso em: 20 ago. 2021.
SANTOS, E. P. dos. Membranas de quitosana/bioativos naturais com atividade
antimicrobiana para tratamento de lesões cutâneas. 2018. 140 f. Dissertação
(Mestrado em Ciência e Engenharia de Materiais) – Universidade Federal da
Paraíba. Programa de Pós-Graduação em Ciência e Engenharia de Materiais, João
Pessoa, 2018a. Disponível em:
https://repositorio.ufpb.br/jspui/handle/123456789/13407. Acesso em: 24 Ago. 2021.
SANTOS, V. de S. Avaliações e caracterizações de biofilme comestível de
carboximetilcelulose contendo cúrcuma longa e nanopartículas de quitosana.
2018b. 79 f. Exame de Conclusão (Mestrado em Ciência dos Materiais) – Faculdade
de Engenharia de Ilha Solteira. Programa de Pós-Graduação em Ciência dos
Materiais, Ilha Solteira, 2018b. Disponível em:
https://repositorio.unesp.br/bitstream/handle/11449/181550/santos_vs_me_ilha.pdf?s
equence=3&isAllowed=y. Acesso em: 26 Ago. 2021.
SILVA, M. C. et al. Avaliação do método de obtenção de scaffolds
quitosana/curcumina sobre a estrutura, morfologia e propriedades térmicas. Revista
Matéria, v. 21, n.3, p.560-568, 2016. Disponível em:
http://www.scielo.br/pdf/rmat/v21n3/1517-7076-rmat-21-03-00560.pdf. Acesso em:
25 Ago. 2021.
THASSU, D.; DELEERS, M.; PATHAK, Y. V. (Eds.). Nanoparticulate drug delivery
systems. Series: Drugs and the Pharmaceutical Sciences, v. 166. Flórida: CRC
Press, 2007.
VEIGA, I. G. Produção e caracterização de membranas de quitosana associada
com outros biopolímeros para liberação controlada de anti-inflamatórios. 2012.
159 f. Tese (Doutorado em Engenharia Química) – Universidade Estadual de
Campinas. Programa de Pós-Graduação em Engenharia Química, Campinas, 2012.
Disponível: http://repositorio.unicamp.br/jspui/handle/REPOSIP/266664. Acesso em:
15 set. 2021.


