Estudos in silico do Complexo Inorgânico [Fe(AT)2](Cl)2, ONDE AT = Ácido Tânico.
- Home
- Trabalhos
ÁREA
Química Inorgânica
Autores
Braga, J.L. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE)) ; Oliveira, L.M. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE)) ; Silva, W.M.B. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE)) ; Alves, D.R. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE)) ; Nascimento, G.H.M. (UNIVERSIDADE ESTADUAL DE CAMPINAS- UNICAMP) ; Marinho, M.M. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE)) ; Morais, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE)) ; Marinho, E.S. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE)) ; Pinheiro, S.O. (UNIVERSIDADE ESTADUAL DO CEARÁ (UECE))
RESUMO
O Ácido Tânico é um tanino hidrolisável encontrado em diversos alimentos.O íon ferro possui um papel importante no transporte de elétrons, no transporte de oxigênio e está presente nas hemoglobinas. O objetivo deste trabalho foi sintetizar e caracterizar por espectroscopia eletrônica na região do ultravioleta e visível (UV-Vis) e na região do infravermelho um novo composto e realizar estudos in silico do complexo formado, [Fe(AT)2]Cl2. A síntese do complexo foi realizada seguindo procedimentos da literatura com modificações e a caracterização foi realizada por métodos espectroscópicos. Os estudos in silico demonstraram que as propriedades físico-químicas preditas inicialmente foram fundamentais na previsão do comportamento farmacocinético do [Fe(AT)2]Cl2 .
Palavras Chaves
Ácido Tânico; Ferro; Complexo Inorgânico
Introdução
A Química Inorgânica possui um vasto campo de conhecimento. Entre as diversas áreas, os compostos de coordenação possuem destaque como estudo, devido suas propriedades espectroscópicas e a reatividade dos seus complexos. A Química dos Compostos de Coordenação explora a interação entre um átomo ou um íon central que normalmente é um metal, cercado por um grupo de íons e moléculas, os ligantes. Os compostos de coordenação exercem um papel importante na indústria química e na vida (FARIAS, 2009). A capacidade com que os metais têm de perder elétrons os tornam componentes funcionais indispensáveis no processo de coordenação biomoléculas e íons metálicos, os quais geram efeitos terapêuticos importantes no auxílio da saúde humana (BENITE; MACHADO; BARREIRO, 2007). O íon ferro é responsável pelo transporte sanguíneo e no combate à anemia, uma doença ocasionada pela deficiência de ferro no corpo (SARAIVA et al., 2014). Os taninos são responsáveis pela adstringência de diversos frutos e vegetais, isso se deve a precipitação de glicoproteínas salivares, diminuindo o poder lubrificante (BRUNETON, 1991). São compostos fenólicos, portanto são altamente reativos quimicamente e formam pontes de hidrogênio (MONTEIRO et al., 2005). Os taninos possuem diversas atividades farmacológicas que são proporcionadas por sua capacidade de complexar com íons metálicos (KRAAL et al, 2006), seu efeito antioxidante e a facilidade de complexar com macromoléculas (HASLAM, 1996 e 1998). COMPOSTOS DE COORDENAÇÃO: Compostos de coordenação ou complexos, são átomos metálicos centrais envolvidos por uma série de ligantes. Esses átomos metálicos exercem como ácidos de Lewis (recebem pares eletrônicos) que combinam-se com os ligantes, que atuam como base de Lewis (doam pares eletrônicos), deste modo, formando os complexos (ATKINS, BONES, 2006). O ÍON FERRO EM COMPLEXOS: O íon ferro é bastante utilizado na indústria e conhecido desde a antiguidade, é um nutriente essencial para todos os organismos vivos (ESPÓSITO, 2011). Em relação à Química do Ferro, pode-se observar sua grande importância biológica que está associada ao transporte de elétrons em plantas e animais, no transporte de oxigênio para as células, como também na retenção de oxigênio (PAIVA; RONDÓ; SHINOHARA, 2000). As alterações na presença de ferro ou a deficiência, causa a anemia, segundo pesquisas, afeta uma estimativa de 2 bilhões de pessoas no mundo, tanto em países desenvolvidos como em países ainda em desenvolvimento (TEE et al., 1999). O objetivo deste trabalho tem como fundamento os estudos in silico do complexo [Fe(AT)2]Cl2 conforme a prospecção da síntese e caracterização do complexo.
Material e métodos
O CAMINHO METODOLÓGICO: Para a preparação do complexo [Fe(AT)2]Cl2 foram utilizados o sal Cloreto de Ferro (II), FeCl2.4H2O (MERCK), e o ligante Ácido Tânico C76H52O46 (VETEC), os solventes dimetilsulfóxido (MERCK), trietilamina (MERCK) e água destilada. O composto foram armazenados sob vácuo em dessecadores. A obtenção do espectro eletrônico na região do UV-Vis foi obtido utilizando um espectrofotômetro SHIMADZU UV-1800, com soluções em concentrações de 1 x 10-3 mol/L em uma faixa de 200 a 800 nm de comprimento de onda. Os espectros na região do Infravermelho foram obtidos na região de 4000 a 400 cm-1, utilizando 1 mg do ligante e do complexo [Fe(AT)2]Cl2 em pastilhas de KBr (SIGMA). ESTUDOS IN SILICO: Inicialmente, a estrutura molecular do complexo [Fe(AT)2]Cl2 foi desenhada no software Java Script MarvinSketch (CSIZMADIA, 1999) versão 21.3 para cálculo das propriedades físico-químicas de peso molecular (MW), lipofilicidade (Clog P), coeficiente de distribuição (Clog D), polaridade (PSA) (Ertl, Rohde, and Selzer 2000), aceitadores e doadores de H-bond e ligações giratórias, utilizadas como descritores moleculares farmacocinéticos. O arquivo .mol gerado foi carregado no web servidor SwissADME (http://www.swissadme.ch/index.php) (DAINA; MICHIELIN; ZOETE, 2017) para filtragem in silico de druglikeness de acordo com as propriedades físico-químicas calculadas para as regras de Lipinski et al. (1997) e Veber et al. (2002). As propriedades de absorção e distribuição foram previstas pelos descritores de Wlog P (Wildman and Crippen 1999) e PSA (ERTL et al., 2000) do método de Brain Or IntestinaL EstimateD permeation (BOILED- Egg) (DAINA; ZOETE, 2016). O metabolismo de fase I foi previsto pelo teste de similaridade a compostos do banco de dados do servidor com potencial inibidor das isoenzimas do cytochrome P450 1A2, 2C19, 2C9, 2D6 e 3A4. Os fragmentos com potencial tóxico foram identificados pelo filtro combinado de Pan-Assay Interference Structures (PAINS) e biblioteca de alertas estruturais de Brenk et al., (BRENK et al., 2008), enquanto filtro de Leadlikeness (TEAGUE et al., 1999) foi aplicado para avaliar as limitações de acessibilidade sintética da substância. O SMILES do complexo [Fe(AT)2]Cl2 foi carregado no web servidor pkCSM (http://biosig.unimelb.edu.au/pkcsm/) (PIRES; BLUNDELL; ASCHER, 2015) onde o filtro de estruturas de interferência de PAINS foi aplicado para prever os modelos tóxicos (PIRES; KAMINSKAS; ASCHER, 2018) de mutagenicidade de AMES (AMES et al., 1972), cardiotoxicidade pela inibição de canais hERG I e II (human Ether-a-go-go Related Gene I and II) e hepatotoxicidade. Por fim, a bioatividade foi prevista pela interação com classes de alvos biológicos de interesse terapêutico da espécie Homo sapiens pelo teste in silico de similaridade do servidor SwissTargetPrediction (http://www.swisstargetprediction.ch/) (DAINA; MICHIELIN; ZOETE, 2019).
Resultado e discussão
Síntese do Complexo: Inicialmente, houve a formação de precipitado ao final
de
3 horas de reação, que se encontrava sob intensa agitação e temperatura
ambiente, o complexo precursor [Fe(AT)2]Cl2 apresentou coloração preta
devido
a capacidade do Ácido Tânico ser facilmente oxidado tanto por enzimas
vegetais
especificas quanto por influência de metais, como cloreto férrico (MELLO;
SANTOS, 2001). Obteve-se uma mudança de coloração após a mistura das duas
soluções, essa alteração pode indicar que ocorreu a coordenação, no entanto,
após a adição de trietilamina o composto passou para uma coloração roxa,
comprovando, desta forma, a alta reatividade do ligante frente ao metal
Fe2+.
Caracterização do Complexo- Espectroscopia Região do Ultravioleta e Visível
(Uv-vis): Submeteu-se o complexo [Fe(AT)2]Cl2 formado, o ligante ácido
tânico
e sal cloreto de ferro (II) à análise da espectroscopia eletrônica na região
do UV-Vis, sendo o ligante e o sal dissolvido em água e o complexo formado
foi
dissolvido em dimetilsulfóxido (DMSO), a fim de analisar as bandas de
formação
e com isso estabelecer experimentalmente a interação Fe-AT. As bandas
formadas em 213 e 273 nm foram atribuídas ao ligante ácido tânico, livre de
coordenação, determinados valores coincidem com os relatados na literatura
(VERZA, 2006). O espectro eletrônico do complexo em estudo apresentou as
bandas 283, 380 e 550 nm, sendo a banda 283 nm atribuída à transição
intraligante do ligante Ácido Tânico. As 380 e 550 nm, são referentes a
interação do metal com o ligante, atribuídas à transições de transferência
de
carga do tipo metal-ligante (MLCT) e transição d-d, pois trata-se de
complexos
de metais contendo elétrons no orbital d (NUNES, 2017) e revelam a interação
do ácido tânico com íon metálico Fe (II) (QUIRRENBACH, 2009). Espectroscopia
Vibracional na Região do Infravermelho (IV): Uma análise comparativa da
molécula de Ácido Tânico com o complexo em estudo [Fe(AT)2]Cl2 em KBr,
indicam
a presença das principais bandas referente a suas estruturas e a alterações
analisadas, resultantes do processo de complexação. As substâncias
apresentaram as seguintes bandas características (NAKANISHI; SOLOMON, 1977;
SILVERSTEIN et al., 1998; PAVIA et al., 2001). O ácido tânico apresentou as
bandas 3419 cm-1 derivada de uma deformação axial O-H, a banda 1718 cm-1
deformação axial C=O. As bandas 1616 e 1539 cm-1 indicam uma deformação
axial
C=C de anel aromático, a banda 1195 cm-1 indica deformação angular de O-H e
deformação axial de C-O. Em 756 cm-1 indica a deformação angular fora do
plano
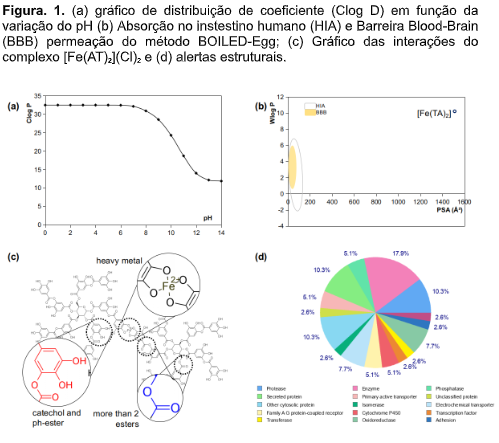
de O-H. Estudos in silico: O gráfico da Figura 1(a) mostra que a
distribuição
do [Fe(AT)2]Cl2 decresce em função da formação da microespécie carregada em
pH
fisiológico, o que decresce a sua biodisponibilidade como medicamento de via
oral. O valor de Clog D7.4 avaliado em 31,80 sugere que o composto é muito
lipofílico e insolúvel em água (Tabela 1). Os critérios da “regra de cinco”
de
Lipinski et al. (1997) utilizam limites físico-químicos definidos em MW <
500,
log P < 5, H-bond acceptors < 10 e H-bond donors < 5, onde há uma alta
probabilidade de um composto ser um fármaco de via oral. Já os parâmetros
experimentais da GlaxoSmithKline (GSK) de Veber et al., (VEBER et al. 2002)
determinam limites baseados na flexibilidade (ligações giratórias < 10) e
polaridade (PSA < 140 Ų) molecular onde o composto possui alta
probabilidade
de ter uma boa biodisponibilidade oral em ratos. Portanto, um filtro que
combina as violações do tipo MW > 500, Clog P > 5, HBA > 10 e HBD > 5 dos
critérios de Lipinski, e as de ligações giratórias > 10 e PSA > 140 dos
critérios de Veber (2002), sugerem que o [Fe(AT)2]Cl2 excedem os limites de
tamanho, lipofilicidade, polaridade e flexibilidade molecular para ser um
fármaco de via oral (Tabela 1). As propriedades de lipofilicidade e
polaridade
são inversamente proporcionais e a modificação de uma destas implica na
mudança simultânea de outras propriedades, como: peso molecular e ligações
de
hidrogênio. Baseado no modelo multiestatístico de Egan et al. (2000), o
método
de Brain Or IntestinaL EstimateD permeation (BOILED-Egg) é uma estimativa
matemática de absorção inestinal humana (HIA) e acesso ao sistema nervoso
central (CNS) com permeabilidade na barreira hematoencefálica (BBB) através
dos descritores de Wlog P (antes Alog P98) e polaridade (PSA). Desta forma,
a
elipse formada pelos limites de -2.3 < Wlog P < 6.8 e de PSA < 142 Ų
representa uma área de alta HIA do composto de ensaio, onde os limtes de 0.4
<
Wlog P < 6.0 e PSA < 79 Ų são compostos com alta HIA e permeantes da BBB
(DAINA; ZOETE, 2016). Desta forma, o gráfico da Figura 1(b) mostra que os
valores calculados de Wlog P na ordem de 10,22 e de PSA na ordem de 1511.96
Ų
para o [Fe(AT)2]Cl2, indica que o composto possui suas propriedades de
lipofilicidade e polaridade distantes das ideais para o composto ser
absorvido
no intestino humano como fármaco de via oral, ao mesmo tempo em que o valor
calculado de log Kp na ordem de -17,69, em cm/s, reflete a inviabilidade do
absorção cutânea do composto (Tabela 1). O mecanismo de metabolismo de fase
I
do [Fe(AT)2]Cl2 é baseado na não inibição das CYP450 1A2, 2C19 e 2C9 o que
sugere que o composto pode ser oxidado sem risco hepatotóxico (Tabela 1). No
entanto, o composto realiza apenas 5,1% de suas interações com as isoenzimas
do Cytochrome P450, o que reduz sua sucetibilidade a ser substrato das
isoenzimas CYP450 2D6 e 3A4, resultando em um maior tempo de meia-vida no
organismo humano e com lenta rota de eliminação (Figura 1(d)). Os alertas
estruturais listados por Brenk et al. (2008) constituem uma ferramenta de
predição in silico, baseada em uma biblioteca de fragmentos moleculares que
podem ser quimicamente reativas ou metabolicamente instáveis que apresentem
alguma atividade tóxica. A Figura 1(c) mostra os alertas estruturais
identificados por filtro de PAINS e Brenk (2008), onde foi possível detectar
4
alertas estruturais associados ao metal pesado no centro do [Fe(AT)2]Cl2, ao
excesso de grupos esters e ph-esters o fragmento de catechol. Contudo, o
metabolismo desta substância não resulta em risco mutagênico ou
hepatotóxico,
mas os fragmentos moleculares contribuíram na inibição prevista dos canais
de
hERG II (human Ether-a-go-go Related Gene II), resultando em risco
cardiotóxico (Tabela 1). O grau de complexidade de estruturas moleculares
tem
levado ênfase nos estudos de descoberta de novos medicamentos. Estas
complexidades podem estar associadas a parâmetros físico-químicos que
limitem
sua acessibilidade de síntese, bem como podem apresentar efeitos colaterais
indesejáveis pelo não-encaixe em alvos biológicos de interesse terapêutico
(CHEN; LIU; YAN, 2012; EMIG et al., 2013; HOPKINS, 2008; VAN LAARHOVEN;
NABUURS; MARCHIORI, 2011; TEAGUE et al., 1999; YAMANISHI; PAUWELS; KOTERA,
2012). O filtro de leadlikeness identificou limitações do tipo MW > 350,
ligações giratórias > 7 e Xlog P > 3.5 na estrutura molecular do
[Fe(AT)2]Cl2,
resultando em um score de acessibilidade sintética na ordem de 10,0, em uma
escala que varia de 1,0 (muito fácil) até 10,0 (muito difícil) (Tabela 1). O
baixo potencial de transporte e efluxo do composto é justificável pelo baixo
percentual de interação com proteínas de transporte ativo primário (5,1%),
distribuídos em interações com a P-glycoprotein 1 e proteínas do retículo
endoplasmático transicional ATPase. Apesar do baixo percentual de interações
com isoenzimas do cytochrome P450 (5,1%), a substância interage em 7,7% com
oxirredutases diversas, além de interagir em 5,1% com receptores acoplados à
proteína G da família A, mediadores das interações medicamentosas
intracelulares (Figura 1(d)).
Fonte: Próprios autores.

Fonte: Próprios autores.
Conclusões
De acordo com os resultados descritos nesse trabalho, houve coordenação da molécula ácido tânico ao centro metálico do íon Fe2+ de forma bidentada pelos grupamentos fenólicos. Nos estudos in silico, as propriedades físico-químicas preditas inicialmente foram fundamentais na previsão do comportamento farmacocinético do complexo [Fe(AT)2]Cl2. O composto é muito lipofílico e insolúvel em água, resultando em incapacidade de absorção intestinal e cutânea. A substância é oxidada e metabolizada sem risco de hepatotoxicidade, mas com fragmentos moleculares de potencial cardiotóxico. Portanto, é necessária a avaliação do composto em testes in vitro e in vivo na descoberta de novas formas de administração.
Agradecimentos
Laboratório de Química de Produtos Naturais (LQPN), Laboratório de Química Inorgânica (LQUIN), Universidade Estadual do Ceará (UECE).
Referências
ATKINS, P.; J. BONES, L.; Questionando a Vida Moderna e o meio ambiente. 3.ed. . [S.l.]: Bookman, 2006.
BENITE, A.M.C.; MACHADO, S.P.; BARREIRO, E. J. Uma Visão da Química Bioinorgânica Medicinal. Revista Química Nova, São Paulo, v. 30, n. 8, p. 2062-2067, 2007.
BRENK R., A.; SCHIPANI, D.; JAMES, A.; KRASOWSKI, I. H.; GILBERt, J. FREARSON; WYATT, P.G. Lessons Learnt from Assembling Screening Libraries for Drug Discovery for Neglected Diseases. ChemMedChem: Chemistry Enabling Drug Discovery, v. 3. n. 3, p. 435–44, 2008.
BRUNETON, J.; Elementos de Fitoquímica y de Farmacognosia. AS/Espanha: Ed. Acribia,1991. 594p.
CHEN, X., M. X. LIU, and G. Y. YAN. Drug–Target Interaction Prediction by Random Walk on the Heterogeneous Network. Molecular BioSystems v. 8, n. 7, p. 1970–78, 2012.
CSIZMADIA, P. Marvin Sketch and MarvinView: Molecule Applets for the World Wide Web. 1999.
DAINA, A.; OLIVIER M.; VINCENT Z. SwissTargetPrediction: Updated Data and New Features for Efficient Prediction of Protein Targets of Small Molecules. Nucleic Acids Research, v. 47, n. W1, p. W357–3664, 2019.
DAINA, A.; OLIVIER M.;, Vincent Z. SwissADME: A Free. Web Tool to Evaluate Pharmacokinetics , Drug- Likeness and Medicinal Chemistry Friendliness of Small Molecules. Nature Publishing Group, v. 7, p. 1–13. 2017.
DAINA, A.; ZOETE, V. A BOILED-Egg to Predict Gastrointestinal Absorption and Brain Penetration of Small Molecules. ChemMedChem, v. 11, n. 11, p. 1117–21, 2016.
EGAN, W. J., K. M. MERZ, and J. J. BALDWIN. Prediction of Drug Absorption Using Multivariate Statistics. Journal of Medicinal Chemistry, v. 43, n. 21, p. 3867–77, 2000.
EMIG, D., ALEXANDER I., OLGA P., LEE L., SVETLANA B., YURI N., MARINA B. Drug Target Prediction and Repositioning Using an Integrated Network-Based Approach. PLoS ONE v. 8, n. 4, 2013.
ERTL, P., B. R.; SELZER, P. Fast Calculation of Molecular Polar Surface Area as a Sum of Fragment-Based Contributions and Its Application to the Prediction of Drug Transport Properties. Journal of Medicinal Chemistry v. 3, n. 20, p. 3714–17, 2000.
ESPOSITO, B. P. Ferro: um metal que vale ouro. 2011. Universidade de São Paulo. 2011.
FARIAS, R. F. Química de Coordenação: fundamentos e atualidades. 2 ed. Campinas: Átomo, 2009. 420 p.
HOPKINS, A. L.. Network Pharmacology: The next Paradigm in Drug Discovery. Nature Chemical Biology v. 4, n. 11, p. 682–90, 2008.
KRAAL, P.; JANSEN, B.; NIEROP, K.G.J.; VERSTRATEN, J.M. Copper complexation of tannic acid in aqueous solution. Chemosphere. v. 65, p. 2193-2198, 2006.
LIPINSKI, C. A.; FRANCO L.; BERYL W. D.; PAUL J. F. Experimental and Computational Approaches to Estimate Solubility and Permeability in Drug Discovery and Development Settings. Advanced Drug Delivery Reviews, v. 23, n. 1–3, p. 3–25, 1997.
MELLO, J. C.P.; SANTOS, S. C. Taninos. In: SIMÕES, C.M.; SCHENKEL, E. P.; GOSMANN, G.; MELLO, J. C.P.; MENTZ, L.A.; PETROVICK, P.R. Farmacognosia: da planta ao medicamento. 3 ed. Porto Alegre: Ed.UFGRS/Ed.UFSC, 2001. cap. 24, p. 517-543.
MONTEIRO, J.M.; ALBUQUERQUE, U. O.; ARAÚJO, E.L. Taninos: uma abordagem da química a ecologia. Química Nova, v. 28, n. 5, p. 892-896, 2005.
NAKANISHI, K. SOLOMON, P. M. Infrared Absortion Spectroscopy. 2. ed. San Francisco: Holden Day, 1977.
NUNES, Q.M. ESTUDO DO COMPLEXO Na3[Fe(CN)5(PPN)] COMO PROMISSOR FÁRMACO CONTRA A LEISHMANIOSE. Trabalho de Conclusão de Curso (Graduação). Universidade Estadual do Ceará, Ceará, 2017.
PAIVA, A. de. A.; RONDO, P. H.C.; SHINOHARA, E. M. G. Parâmetros para avaliação do estado nutricional de ferro. Revista de Saúde Pública, São Paulo, v. 34, n. 4, p. 421-426, 2000.
PAVIA, D. L.; LAMPMAN, G. M.; KRIZ, G. S. Introduction to Spectroscopy. 3. ed. Melbourne: Brooks/Cole, 2001.
PIRES, D. E. V.; TOM L. B.; DAVID B. A. PkCSM: Predicting Small-Molecule Pharmacokinetic and Toxicity Properties Using Graph-Based Signatures. Journal of Medicinal Chemistry, v. 58, n. 9, p. 4066–72, 2015.
QUIRRENBACH, H. R. et al. Comportamento do ácido fítico na presença de Fe (II) e Fe (III). Ciência e Tecnologia de Alimentos, v. 29, n. 1, p. 24-32, 2009.
SARAIVA, B.C.A.; SOARES, M.C.C.; SANTOS, L.C.; PEREIRA, S.C.L.; HORTA, P.M. Deficiência de ferro e anemia estão associadas com baixos níveis de retinol em crianças de 1 a 5 anos. Jornal de Pedriatria, Rio de Janeiro, v. 90, n. 6, p. 593-599, 2014.
SILVERSTEIN, R. M.; BASSLER, G. C.; MORRIL, T. C. Identificação Espectroscópica dos Compostos Orgânicos. 6. ed. Rio de Janeiro: Guanabara- Koogan, 1998.
TEAGUE, S. J., A. M. DAVIS, P. D. LEESON, and T. OPREA. The Design of Leadlike Combinatorial Libraries. Angewandte Chemie International Edition v. 38, n. 24, p. 3743–48, 1999.
TEE, E.; KANDIAH, M.; AWIN, N.; CHONG, S.M.; SATGUNASINGAM, N.; KAMARUDIN, L.; MILANI, S.; DUGDALE, A. E.; VITERI, F. E. School-administered weekly iron-folate supplements improve hemoglobin and ferritin concentrations in Malaysian adolescent girls1’2’3’. The American Journal of Clinical Nutrition, Rockville, v. 69, n. 6, p. 1249-1256, 1999.
VAN LAARHOVEN, T., SANDER B. NABUURS; ELENA M. Gaussian Interaction Profile Kernels for Predicting Drug-Target Interaction. Bioinformatics v. 27 n. 21, p. 3036–43, 2011.
VEBER, D. F., STEPHEN R. J.; HUNG-YUAN C.; BRIAN R. S.; KEITH W. W.; KENNETH D. K. Molecular Properties That Influence the Oral Bioavailability of Drug Candidates. J. Med. Chem, p. 2615–23, 2002.
VERZA, S. G. Avaliação das variáveis analíticas dos métodos de determinação do teor de taninos totais baseados na formação de complexos com substâncias protéicas e derivados da polivinilpirrolidona. 2006.
YAMANISHI, Y., E. PAUWELS; M. KOTERA. Drug Side-Effect Prediction Based on the Integration of Chemical and Biological Spaces. Journal of Chemical Information and Modeling v. 52 n. 12, p. 3284–92, 2012.


