Mecanismo da síntese da cianidina a partir do carbonil pseudo-base em cálculo teórico
- Home
- Trabalhos
ÁREA
Físico-Química
Autores
Castillo Hinojosa, A.R. (UFBA) ; Aquino Santos, S. (UFBA) ; A. Nery, F. (UESB) ; de Jesus Serafim, E. (UESB) ; G. Souza, L.A. (UESB) ; Perca Gonzales, R.M. (UNSA) ; Juárez Montiel, R.G. (UNSA) ; Pari Huiza, J.F. (UESB)
RESUMO
No trabalho se apresenta o estudo e análise da síntese da cianidina a partir do carbinol pseudo-base desde um ponto de vista energético e estrutural, sendo a cianidina um composto químico presente nas plantas com propriedades antioxidantes e anti-inflamatórias aplicadas à indústria alimentícia e farmacêutica; na sensibilização de células fotovoltaicas, requerendo também sua produção por vias químicas. No entanto, sua baixa disponibilidade como corante natural exige uma demanda de produção, por causa disso é necessário estudar esta molécula. Para isso, se faz uso dos métodos de aproximação com base na teoria quântica, denominado método DFT, que permite determinar características estruturais tais como energias de ligação dos sítios ativos e comprimentos de quebra da ligação.
Palavras Chaves
Carbinol pseudo-base; Ligação química; Corante natural
Introdução
As antocianidinas podem apresentar atividades farmacológicas para doenças degenerativas como diabetes e câncer (ABE et al, 2007). Dentro das propriedades da cianidina, tais como pKa e potencial redox visam compreender os mecanismos de ação biológica (COUTINHO et al, 2015). Existe também um grande interesse industrial no corante roxo que representa absorção da luz visível pela molécula de cianidina (ZHANG et al, 2010). Recentemente existe avanços na elaboração de células solares orgânicas sensibilizadas por corante natural, neste caso por cianidina. Os cálculos DFT (Teoria do funcional da densidade) se mostram acessíveis pelo menor tempo na utilização de recursos computacionais. Neste estudo se reporta os cálculos teóricos da síntese de cianidina via eliminação de OH- a partir da molécula de carbinol pseudo-base. Utilizando a otimização geométrica no nível B3LYP/6- 31G(d,p), seguida da busca de estado de transição pelo cálculo QST2, e o cálculo de caminho de reação 'irc'. A presença de estiramento e quebra da ligação é observável pelo cálculo de frequência de vibração "Freq".
Material e métodos
Na sequência de cálculo foi primeiramente feita o desenho das estruturas moleculares no software Avogadro, seguidamente foram otimizadas cada uma das estruturas no GAUSSIAN considerando o modelo de solvatação simples de Onsager conhecido como campo de reação autoconssistente SCRF para o solvente metanol. Seguidamente no cálculo QST2 as estruturas do reagente e produto são aproximadas para que entre elas ocorra a quebra da ligação C-OH do carbono 3 do flavonoide. Uma vez obtida a estrutura do estado intermediário, é feita uma otimização da mesma. Com isso verifica-se a presença de frequência de vibração negativa indicativo da quebra de ligação. Finalmente é construída o caminho de reação versus energia do sistema utilizando a estrutura otimizada do cálculo QST2, onde no começo do caminho será representada os reagentes carbinol pseudo-base, no ponto máximo o estado intermediário (ou de transição) e no final os produtos cianidina e hidroxila.
Resultado e discussão
Na Figura 1 mostra-se a reação de
decomposição de carbinol pseudo-base,
com
cores cinza para carbono, vermelha
para oxigênio e branca para
hidrogênio.
Na Figura 2 é apreciada o caminho de
reação, onde é possível observar que a
energia de ativação calculada é de
51,5 KJ mol-1. Além disso,
a
reação é endergônica com diferença de
energia entre reagente e
produtos de 14,6 KJ·mol-1.
O tipo de mecanismo corresponde ao de
eliminação com formação de ligação
dupla e de um grupo oxônio (oxigênio
com
carga positiva). Nakajima e
colaboradores (NAKAJIMA et al,
2001)
determinaram valores ao redor de 133,9
KJ·mol-1 para a extração de
hidrogênio no carbono 3 do cátion
flavilium com grupo carboxila no
carbono 4 em
presença de ferro por cálculos de
dinâmica molecular, esse valor
reportado é
superior para a extração do grupo
hidroxila. Essa diferença de energia é
por causa
da presença do grupo cetona (mais
reativo que a hidroxila) que apresenta
menor
energia de ativação.
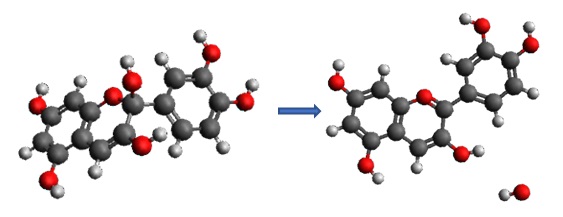
Descomposição do carbinol pseudo-base em cianidina e hidroxila.
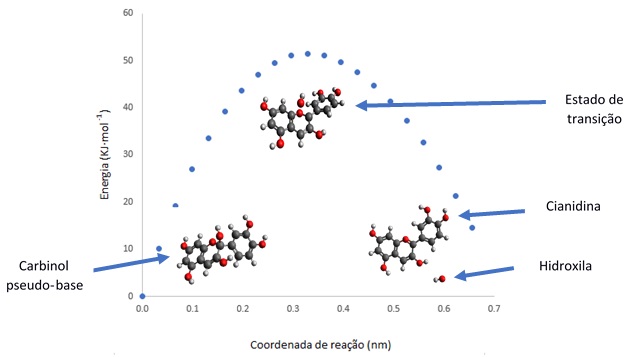
Caminho de reação da decomposição de carbinol pseudo-base, reagente que passa pelo estado de transição e resulta nos produtos cianidina e hidroxila.
Conclusões
As ferramentas de cálculo que foram utilizadas reportaram uma energia de ativação de 14 KJ·mol-1 para a reação de decomposição, sendo um valor coerente. A metodologia emprega vários passos como desenho, otimização, busca do estado de transição, verificação da quebra de ligação e a construção do caminho de reação. As quais podem ser completamente programáveis, facilitando nos futuros cálculos a possibilidade de somente ingressar e coletar os dados requeridos. Com tudo, a reação de decomposição assim como o modelamento de reações que podem requer a síntese de intermediários ou derivatizações representam sua aplicabilidade tanto no campo académico como no industrial.
Agradecimentos
A equipe de pesquisa encontra-se agradecido às institucções de financiamento CAPES, CNPq e FAPESB.
Referências
ABE, L. T.; DA MOTA, R. V.; LAJOLO, F. M.; GENOVESE, M. I. Compostos fenólicos e capacidade antioxidante de cultivares de uvas Vitis labrusca L. e Vitis vinífera L. Ciência e Tecnologia de Alimentos, v.27, n°2, 394, 2007
COUTINHO, I.; FREITAS, A.; MAÇANITA, A.; LIMA, J. C. Effect of water content on the acid-base equilibrium of cyanidin-3-glucoside. Food Chemistry, v.172, 476, 2015
NAKAJIMA, J.; SATO, Y.; HOSHINO, T.; YAMAZAKI, M.; SAITO, K.; Mechanistic study on the oxidation of anthocyanidin synthase by quantum mechanical calculation. Journal of Biological Chemistry, v.281, n°30, 21387, 2006
ZHANG, Y.; SUN, J.; HU, X.; LIAO, X. Spectral alteration and degradation of cyanidin-3-glucoside exposed to pulsed electric field. Journal of Agricultural and Food Chemistry, v.58, n°6, 3524, 2010


