Elucidação computacional do mecanismo molecular da abstração de hidrogênio do H2S pelos radicais CH2F, CHF2 e CF3
- Home
- Trabalhos
ÁREA
Físico-Química
Autores
Zicolau Modolo, M. (UNIVERSIDADE FEDERAL DE ALFENAS) ; Bezerra Viana, R. (UNIVERSIDADE FEDERAL DE ALFENAS)
RESUMO
O propósito deste estudo trata-se da avaliação do mecanismo da reação entre sulfeto de hidrogênio (H2S) com radicais metil halogenados que possuem impactos em processos atmosféricos. Por meio de cálculos químico quânticos foi avaliado as seguintes reações de abstração de hidrogênio: H2S(g) + CH3-nFn(g)·(n=1- 3)→SH· + CH4-nFn(g)·(n=1-3). Otimizou-se as estruturas com o método wB97XD/aug-cc-pVTZ e o refinamento de energia através do método CCSD(T)/CBS. A plausibilidade da reação e suas propriedades termodinâmicas foram determinadas por cálculos químico-quânticos. As reações foram caracterizadas como exotérmicas e espontâneas com barreiras de energia de 4kcal/mol acima dos reagentes.
Palavras Chaves
Química computacional; Sulfeto de hidrogênio; Radical metil halogenado
Introdução
Entre os principais compostos que contém átomos de enxofre encontrados na atmosfera é o sulfeto de hidrogênio (H2S), que é emitido através de fontes naturais, como a decomposição de matéria orgânica e atividades vulcânicas(LEE; BRIMBLECOMBE, 2016), e fontes antropogênicas, como produção pecuária e processos industriais(WATTS, 2000), demonstrando ser um gás fundamental para o clima e flora do planeta(AUSMA; DE KOK, 2019). Já os radicais metilhalogenados podem ser formados pela fotólise, ou a partir das reações com radicais OH·, Cl· e NO3· (BRASSEUR; ORLANDO; TYNDALL, 1999). Particularmente, entre os anos 1966 e 1984 houve uma série de estudo voltados para entender o mecanismo de reação entre as moléculas H2S e o radical trifluorometil (CF3 ·) (ARICAN; ARTHUR, 1984; ARTHUR; BELL, 1966; ARTHUR; GRAY, 1969; ARTHUR; MCDONELL, 1972; KALE; TIMMONS, 1968) no entanto até o momento não houve qualquer estudo voltado para elucidar o mecanismo desta reação, ou mesmo o efeito da fluorinação do radical metil. Portanto, o objetivo deste estudo é a caracterização o mecanismo molecular envolvendo a abstração de hidrogênio do H2S a partir dos radicais CH3-nFn· (n=1-3) para avaliar o caráter, plausibilidade e espontaneidade das reações através de cálculos de estrutura eletrônica.
Material e métodos
Neste estudo, as estruturas foram otimizadas com o método wB97XD (CHAI; HEAD- GORDON, 2008) usando a função de base aug-cc-pVTZ (KENDALL; DUNNING; HARRISON, 1992). Os estados de transição foram avaliados a partir da análise das frequências vibracionais, e confirmados com cálculo da coordenada de reação usando a implementação IRC (Intrisic reaction coordinate) (ZHIXING, 1989). O método CCSD(T) foi empregado para a análise das energias relativas, entalpias e energia livre de Gibbs a 298.15 K (POPLE; HEAD-GORDON; RAGHAVACHARI, 1987; PURVIS; BARTLETT, 1982). Para avaliar o efeito de base completa, foram utilizadas as funções de base aug-cc-pvDZ, aug-cc-pVTZ, empregando do método de extrapolação proposto por Martin et al. (1996). Para avaliar a contaminação de spin, examinou-se o operador de spin (S2) da estrutura do estado de transição e complexos de entrada e saída, onde foi observado a ausência de contaminação apontando a eficácia do método wB97XD/aug-cc-pVTZ (CLAXTON, 1981; FARNELL; POPLE; RADOM, 1983). O caráter multirreferencial foi analisado através do diagnostico T1 proposto por Lee e Taylor(LEE; TAYLOR, 2009), que demonstrou valores que evidenciam que o método CCSD(T) é adequado.
Resultado e discussão
Um aspecto importante em cada uma das reações envolvendo os radicais CH3-
nFn·(n=1-3), é que todas as reações foram
caracterizadas como exotérmicas e espontâneas na temperatura de 298,15K. A
variação de entalpia foi de -10,6 a -16,4 kcal/mol. A Figura 1 descreve uma
análise energética comparando os mecanismos de abstração de hidrogênio das
reações H2S + CH3-nFn·(n=1-3)
utilizando o método CCSD(T)/CBS. É interessante notar que cada uma das reações
foi caracterizada pela formação de um complexo entre as moléculas dos
reagentes, onde os valores das energias de interação foram muito próximos de
zero, indicando uma baixa estabilidade na formação dos complexos. Esta baixa
estabilidade é ressaltada com o aumento da temperatura, onde cada uma das
estruturas é caracterizada por uma interação não espontânea a 298.15K. No caso
dos complexos formados entre as moléculas dos produtos, estes também
apresentaram uma baixa estabilidade, embora que com uma energia levemente
maior em torno de 1,7 kcal/mol. A estrutura do estado de transição (TS) na
reação com o radical CH2F· mostrou uma barreira de
energia de 4.7 kcal/mol acima dos reagentes, já com o aumento da fluorinação
do radical metila houve apenas uma pequena diminuição da barreira de 0.6
kcal/mol no caso do radical CHF2· e de 1 kcal/mol para o
CF3·.
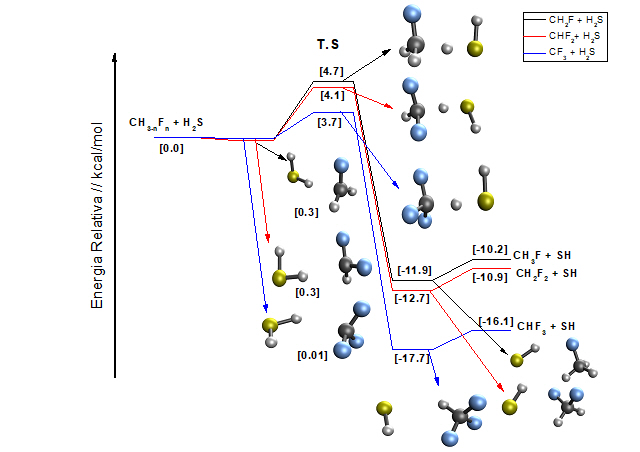
Análise energética dos mecanismos de abstração de hidrogênio do sulfeto de hidrogênio por radicais metil halogenados utilizando o método CCSD(T)/CBS
Conclusões
Considerando as comparações e análises dos métodos wB97XD/aug-cc-pVTZ e CCSD(T)/CBS para a otimização das estruturas e refinamento das energias eletrônicas, observou-se que os métodos aplicados são relevantes e eficientes para a descrição das reações H2S + CH3-nFn ·(n=1-3). Ao analisar a reação, considerando a pequena barreira, o caráter exotérmico e espontâneo da reação, os resultados indicam a possibilidade desta reação ocorrer na troposfera.
Agradecimentos
CAPES, CENAPAD-SP, GRIDUNESP.
Referências
ARICAN, H.; ARTHUR, N. L. Reaction of CF3 radicals with H2S. Internationa Journal of Chemical Kinetics, v. 16, n. 4, p. 335–344, 1 abr. 1984.
ARTHUR, N. L.; BELL, T. N. Kinetics of the abstraction of hydrogen atoms from hydrogen sulfide by trifluoromethyl radicals. Canadian Journal of Chemistry, v. 44, n. 12, p. 1445–1449, 15 jun. 1966.
ARTHUR, N. L.; GRAY, P. Isotope effects in reactions of trifluoromethyl radicals with hydrogen chloride and hydrogen sulphide. Transactions of the Faraday Society, v. 65, n. 0, p. 434–440, 1 jan. 1969.
ARTHUR, N. L.; MCDONELL, J. A. BEBO Calculations. I. Activation Energies and Kinetic Isotope Effects for the Reactions of CH3 and CF3 Radicals with HCl and H2S. The Journal of Chemical Physics, v. 56, n. 6, p. 3100–3110, 15 mar. 1972.
AUSMA, T.; DE KOK, L. J. Atmospheric H2S: Impact on plant functioning. Frontiers in Plant Science, v. 10, n. June, 2019.
BRASSEUR, G. P.; ORLANDO, J. J.; TYNDALL, G. S. Atmospheric Chemistry and Global Charge.
CHAI, J.-D.; HEAD-GORDON, M. Long-range corrected hybrid density functionals with damped atom–atom dispersion corrections. Physical Chemistry Chemical Physics, v. 10, n. 44, p. 6615–6620, 28 nov. 2008.
CLAXTON, T. A. Ab initio extended Hartree-Fock calculations. The Journal of Chemical Physics, v. 75, n. 4, p. 1888–1892, 15 ago. 1981.
FARNELL, L.; POPLE, J. A.; RADOM, L. Structural predictions for open-shell
systems: a comparative assessment of ab initio procedures. The Journal of Physical Chemistry, v. 87, n. 1, p. 79–82, jan. 1983.
KALE, J. D.; TIMMONS, R. B. Kinetics of the reaction of trifluoromethyl radicals with hydrogen sulfide. The Journal of Physical Chemistry, v. 72, n. 12, p. 4239–4242, 1 nov. 1968.
KENDALL, R. A.; DUNNING, T. H.; HARRISON, R. J. Electron affinities of the first-row atoms revisited. Systematic basis sets and wave functions. The Journal of Chemical Physics, v. 96, n. 9, p. 6796–6806, maio 1992.
LEE, C.-L.; BRIMBLECOMBE, P. Anthropogenic contributions to global carbonyl sulfide, carbon disulfide and organosulfides fluxes. Earth-Science Reviews, v. 160, p. 1–18, set. 2016.
LEE, T. J.; TAYLOR, P. R. A diagnostic for determining the quality of single reference electron correlation methods. International Journal of Quantum Chemistry, v. 36, n. S23, p. 199–207, 19 jun. 2009.
MARTIN, J. M. L. Ab initio total atomization energies of small molecules towards the basis set limit. Chemical Physics Letters, v. 259, n. 5–6, p. 669-678, set. 1996.
POPLE, J. A.; HEAD-GORDON, M.; RAGHAVACHARI, K. Quadratic configuration interaction. A general technique for determining electron correlation energies. The Journal of Chemical Physics, v. 87, n. 10, p. 5968–5975, 15 nov. 1987.
PURVIS, G. D.; BARTLETT, R. J. A full coupled‐cluster singles and doubles model: The inclusion of disconnected triples. The Journal of Chemical Physics, v. 76, n. 4, p. 1910–1918, fev. 1982.
WATTS, S. F. The mass budgets of carbonyl sulfide, dimethyl sulfide, carbon disulfide and hydrogen sulfide. Atmospheric Environment, v. 34, n. 5, p. 761-779, 2000.
ZHIXING, C. Rotation procedure in intrinsic reaction coordinate calculations. Theoretica Chimica Acta, v. 75, n. 6, p. 481–484, 1989.


