Estudo de caracterização da farinha da casca de banana in natura e modificada com tiosemicarbazida na adsorção de As(III) em diferentes matrizes aquosas
- Home
- Trabalhos
ÁREA
Química Analítica
Autores
Paniagua, C.E.S. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Costa, B.E.S. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Alves, V.N. (UNIVERSIDADE FEDERAL DE CATALÃO) ; Coelho, N.M.M. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA)
RESUMO
O arsênio é um elemento tóxico que traz preocupações recorrentes à saúde humana e ao meio ambiente. No presente trabalho, avaliou-se a capacidade da casca de banana in natura - FBN e modificada com tiosemicarbazida (FBM) na remoção de As(III) em matrizes aquáticas . A otimização das variáveis que influenciam a adsorção do As(III) indicou: 250 mg do adsorvente; pH 4,0 e 60 min de contato. Nessas condições, obteve- se eficiência de adsorção de 85% (água desionizada) e 70% (água do mar sintética) para FBM e 35% para FBN em água desionizada. Estudos cinéticos indicaram ajuste ao modelo de difusão intra-partícula e o modelo de isoterma de adsorção foi o de Freundlich. O FBM mostrou-se eficiente e de baixo custo, sendo considerado uma alternativa ao tratamento convencional.
Palavras Chaves
biomassa; adsorção; matrizes aquosas
Introdução
O arsênio (As) é um dos elementos mais tóxicos e susceptíveis a absorção por seres vivos. O ser humano pode se contaminar com espécies inorgânicas de arsênio, como As(III) considerada a mais tóxica, por meio da ingestão de águas com níveis traços, bem como por alimentos de origem animal e vegetal expostos às interferências antrópicas, como aditivos em rações (Roxarsone®) e pesticidas (Daconate®). Uma vez absorvido, há tendências de bioacumulação deste elemento no organismo (PHOLOSI; NAIDOO; OFOMAJA. 2019; SINGH; GAUTAM, 2017). O arsênio pode ser encontrado na forma dos minerais arsenopirita (FeAsS) e orpimento (As2S3). Na forma solúvel torna- se disponível no meio ambiente, podendo contaminar solos e águas e, subsequentemente fazer parte da cadeia alimentar causando sérios malefícios aos seres humanos (PHOLOSI; NAIDOO; OFOMAJA. 2019; SINGH; GAUTAM, 2017). Diante disso, tanto o Conselho Nacional de Meio Ambiente (CONAMA) por meio da Resolução no 357/2005, quanto o Ministério da Saúde por meio da Portaria 2914/2011 estabeleceram como valor máximo permitido (VMP) em10 μg L-1 de arsênio em águas para fins potáveis (ALI et al., 2020; ALVES et al., 2017; CONAMA, 2005; MINISTÉRIO DA SAÚDE, 2011). Devido a sua alta toxicidade e a ineficiência dos processos convencionais de tratamento de água e esgoto, faz se necessário o desenvolvimento de novas tecnologias de remediação para a remoção de arsênio em ambientes aquáticos. Neste contexto, a adsorção torna-se uma alternativa para a remoção de contaminantes inorgânicos e orgânicos em solução, especialmente quando se faz uso de materiais adsorventes oriundos de resíduos da agroindústria, devido ao baixo custo e a abundância na natureza (ASERE; STEVENS, LAING, 2019; BHATNAGAR; SILLANPÃÃ; WITEK-KROWIAK, 2015; HASSAN et al., 2020; LIBATIQUE et al., 2020; NERIS et al., 2019). Entre os resíduos da agroindústria, a casca da banana e derivados de outras partes da planta da bananeira, como o caule vem se destacando, podendo ser aplicada na remoção de contaminantes inorgânicos (ANNADURAI; JUANG; LEE, 2003; OGUNLEYE; AJALA; AGARRY, 2014). Ainda que essa classe de adsorventes possa ser utilizada na forma in natura, a modificação química aprimora seu uso em função do aumento da seletividade, refletindo na melhoria da capacidade máxima do adsorvente para remoção do composto-alvo. Neste contexto, a introdução de grupos funcionais contendo elementos como enxofre e nitrogênio, como ocorre em compostos como a tiosemicarbazida, possibilita aprimorar a capacidade de sequestrar determinados íons metálicos por afinidade química. Essa interação também é favorável para semimetais como o arsênio, formando quelatos (AHMAD; DANISH, 2018). Diante disso, vários trabalhos foram reportados na literatura, utilizando a farinha da casca de banana modificada quimicamente para esta finalidade (STVRINOU; AGGELOPOULOS; TSAKIROGLOU, 2018). Massocatto e colaboradores (2013) avaliaram a capacidade de adsorção do íon Pb(II), em água desionizada, utilizando a farinha de casca de banana modificada com NaOH, da qual obteve-se Qm = 90 mg g-1 após 300 min de contato em pH 5,0 com uma eficiência de remoção abaixo do Limite de Detecção (LD) do íon metálico avaliado (MASSOCATTO et al., 2013). Ashraf e colaboradores (2014) investigaram a adsorção do íon Cr(VI), em água deionizada, empregando-se a farinha de casca de banana ativada em meio de HCl e funcionalizada com organo-montmorilonita. Os resultados apresentaram Qm= 15,1 mg g-1 em pH 3,0 após 2 h de contato com o bioadsorvente, com uma eficiência de remoção na faixa de 69-100% (AHMAD; DANISH, 2018). Já Salamun e colaboradores (2015) estudaram a adsorção do íon Hg(II), em água desionizada, utilizando a farinha da casca de banana ativada com HCl, obtendo-se Qm= 372 mg g-1 em pH 7,0 após 180 min de contato (ASHRAF et al., 2017). Resultados satisfatórios também foram obtidos para funcionalização da caca de banana e em outros adsorventes semelhante, aplicados na adsorção de Mn(II) e corantes (ALI, 2017; SALAMUN et al., 2015) A retenção de arsênio baseada no uso de adsorventes de origem natural ainda não é largamente explorada da mesma forma que ocorre para outros metais tóxicos, necessitando de maiores estudos que viabilizem o procedimento. Diante disto, o presente trabalho avaliou o uso da farinha da casca de banana em sua composição natural (in natura: FBN) e modificada quimicamente com tiosemicarbazida (FBM) para a remoção de As(III) em diferentes matrizes aquosas.
Material e métodos
1 – Reagentes Água desionizada obtida por um sistema de purificação Milli-Q. Solução padrão (1000 mg L-1) de HAsO2em meio de HCl. Solução de NaBH4 estabilizada em NaOH 0,5% (m/v). Tiosemicarbazida – CH5N3S. Soluções de NaOH e HCl a 0,01 mol/L foram utilizadas para ajustar o pH do meio. 2 - Preparação do bioadsorvente As cascas de banana foram colocadas ao sol pelo periodo de 48 h, posteriormente trituradas em um liquidificador e peneiradas a fim de se obter uma granulometria mais homogênea com partículas com diâmetro ≤ 80 μm. Em seguida foram lavadas com solução de HCl (0,05 mol L-1) e colocadas em repouso por 10 min. Posteriormente, lavadas com água desionizada até a obtenção de pH entre 6-8 e em seguida levada a estufa a 40ºC por 48 h. Este material foi denominado de FBN. Para obtenção da FBM, foi adicionado 50,0 mL de solução de tiosemicarbazida 0,01 mol L- 1 a 20,0 g da FBN. A mistura foi submetida à agitação magnética pelo período de 1 h, seguida de filtração. O material retido no papel de filtro foi levado à secagem na estufa a 40ºC durante 24 h. 3 – Caracterização do material adsorvente A morfologia dos bioadsorventes (FBN e FBM) foi avaliada por Microscopia Eletrônica de Varredura (MEV, ZEISS Modelo EVO MA10) com detector de elétrons secundários. As amostras foram recobertas com uma fina camada de ouro, sendo aplicado uma voltagem de aceleração de 20 kV. Para elucidação dos grupos funcionais presentes, utilizou- se um Espectrofotômetro de absorção no Infravermelho Médio com Transformada de Fourier (FT-MIR, IR PRESTIGE-2). As amostras foram preparadas em pastilhas prensadas de KBr na proporção 100:1 (KBr:amostra) e foram analisadas em uma faixa de 4000 a 500 cm-1, com resolução de 4 cm-1 e 32 varreduras por amostra. Para a análise elementar (CHNS) foi utilizado um analisador CHNS/O - Série II CHNS/O Analyser 2400. 4 - Determinação de As(III) por HG-AAS A determinação de As(III) foi realizada por Espectrometria de Absorção Atômica com Geração de Hidretos (HG-AAS). As medidas de absorbância foram obtidas por um Espectrômetro de Absorção Atômica Varian Spectra AA-220 equipado com módulo de geração de vapor VGA-77 em uma chama ar-acetileno nas condições recomendadas pelo fabricante (vazões de 13,5 e 4,5 L min-1 respectivamente). Como fonte de radiação foi utilizada uma lâmpada de catodo oco operando em 193,7 nm e 10,0 mA em uma abertura da fenda espectral de 0,5 nm no sistema óptico do equipamento e lâmpada de deutério para correção de fundo (background). Os parâmetros experimentais para geração do hidreto de arsênio (AsH3) foram previamente otimizados (COELHO; SILVA; SILVA, 2003) e empregados na determinação, com os seguintes valores: vazão do gás de arraste (N2, 99,9996%) em 100 mL min-1; solução de HCl 7,0 mol L-1 sob vazão de 2,5 mL min-1; solução do redutor NaBH4 0,6% (m/v) estabilizada com NaOH 0,5% (m/v) sob vazão de 2,0 mL min-1 e vazão da solução de amostra de 10,0 mL min-1.
Resultado e discussão
1. Caracterização do bioadsorvente
As imagens de micrografia (MEV) dos
materiais FBN e FBM são apresentadas na
Figura 1 (A e B), onde observa-se que o
material apresenta uma estrutura
porosa heterogênea. Tal característica é
consequência de uma grande
diversidade de componentes que constituem
a biomassa em estudo, tais como:
celulose, hemicelulose, lignina, proteínas
e ácidos graxos. É visível a
presença de algumas deformações na
superfície do tecido vegetal, que
refletem condições favoráveis para a
adsorção de espécies metálicas nos
interstícios, principalmente da FBM que
apresenta uma estrutura mais porosa,
o que sugere que a modificação química
proporcionou um perfil morfológico
mais adequado para a retenção de As(III)
(MONTEIRO et al., 2018).
A FT-IR possibilita elucidar os grupos
funcionais que estão presentes nos
adsorventes, em particular no que diz
respeito à disponibilidade dos
principais grupos envolvidos nos fenômenos
de adsorção (LOPES, 2004). Os
espectros FT-IR (Figura 2) apontam a
presença de um número razoável de
bandas que refletem a natureza complexa do
adsorvente. Tanto FBM quanto FBN
apresentam diversos grupos funcionais que
sugerem a presença de celulose,
lignina, ácido péctico, ácidos orgânicos,
ésteres e proteínas (BUDZIAK;
MAIA; MANGRICH, 2004). A banda com máximo
em 3413 cm-1 pode ser atribuída ao
estiramento axial dos grupos O-H
característicos da celulose e provenientes
da água retida na superfície do adsorvente
(SUN et al., 2004). O
alargamento dessa banda compreendendo a
região de 3750-3250 cm-1 pode também
estar associado a um estiramento N-H de
aminas secundárias e amidas (CORTI
et al., 2010). Este último grupo pode ser
confirmado pela presença de uma
banda bem definida a 1641 cm-1 atribuída à
deformação angular da ligação N-H
(RIBEIRO; SOUZA, 2007) que evidência a
inserção de grupos aminas
provenientes do tratamento com
tiosemicarbazida. Além disso, existe uma
sobreposição dos espectros e um ligeiro
alargamento de banda próximo a 2200
cm-1 que ocorre para a FBM e que pode ser
atribuída a uma deslocalização
eletrônica envolvendo as ligações N=C=S
(RIBEIRO; SOUZA, 2007). Vibrações de
grupos –NH2 e –NH provenientes da
tiosemicarbazida e compostos relacionados
como tiosemicarbazonas, apresentam bandas
de absorção em 3410, 3250 e 1645
cm-1 (WILES; SUPRUNCHUK, 1969). Uma banda
de baixa intensidade, mas bem
definida é observada em 1555 cm-1, que é
decorrente de tiosemicabazonas
aldeídicas e N-metil substituídas (WILES;
SUPRUNCHUK, 1969; SOUSA-PEREIRA et
al., 2013).
Bandas na região de 2914 a 2852 cm-1 podem
ser atribuídas as ligações -CH e
–CH2 de grupos alifáticos componentes da
estrutura da celulose, enquanto as
bandas compreendidas entre 1173 e 1036 cm-
1 são características das ligações
CH-OH (CHATJIGAKIS et al., 1998; PAIVA et
al., 2004). O conjunto de bandas
entre 1442 em 1252 cm-1 pode ser atribuída
à vibração da ligação C-O de
ésteres e éteres associados a estrutura
fenólica da lignina (PAIVA et al.,
2004; PAVAN et al., 2006). O conjunto de
bandas entre 1442 em 1252 cm-1 pode
ser atribuída à vibração da ligação C-O de
ésteres e éteres associados à
estrutura fenólica da lignina (PAIVA et
al., 2004; PAVAN et al., 2006).Esta
região também sofre interferência da
mudança da energia de ligação C-N, da
qual pode ser observada uma banda com
maior intensidade em 1372 cm-1 para
FBM. A banda em 1113 cm-1 pode ser
atribuída a estiramento associado aos
grupos S-OH ou P=O. A banda em 880 cm-1
pode ser atribuída à deformação
angular fora do plano da ligação C-H em
aromáticos (GONG et al., 2007), bem
como também a uma pequena porção de
haletos alquílicos, como o cloreto
(RIBEIRO; SOUZA, 2007).
A análise elementar CNHS possibilita a
determinação da composição elementar
de quatro componentes (Carbono,
Nitrogênio, Hidrogênio e Enxofre) em uma
mistura da amostra (CHATJIGAKIS et al.,
1998). Os resultados obtidos são
mostrados na Tabela 1, onde se observa um
aumento, de FBN para FBM, na
porcentagem dos quatro elementos
analisados, em decorrência da adição de
tiosemicarbazida em FBM. O aumento de
fração CNHS possibilita inferir que o
bioadsorvente modificado possa conter
grupos funcionais do tipo tioamida em
relação à FBN.
2 - Estudo das condições de adsorção do As
(III)
A casca da banana pode adsorver cátions e
ânions dependendo da carga
elétrica de sua superfície, logo o pH é um
parâmetro determinante no
processo de adsorção das espécies de As
(HO et al., 1999; WALKER;
WEATHERLEY, 1999). Nesse sentido, o
controle do pH pode ocasionar diferentes
porcentagens de adsorção, uma vez que
diferentes espécies de As(III) se
manifestam em composições diferentes em
função do pH. Pela Figura 3A,
verifica-se que a remoção de As (III)
utilizando FBN atinge um máximo de 25%
enquanto para FBM a eficiência chega a 60%
de remoção. Neste pH, o As(III)
se manifesta majoritariamente como a
espécie neutra H3AsO3, torna-se
razoável propor que o mecanismo de
adsorção não seja controlado por forças
de interação eletrostáticas, mas
provavelmente se deve a ocorrência da
formação de uma dupla camada elétrica
entre a superfície carregada
positivamente e o meio que contém contra-
íons e co-íons provindos da solução
de HCl para ajuste do pH do meio (HO et
al., 1999).
No melhor valor de pH e na mesma
concentração de As(III) realizou-se o
estudo da influência da massa de FBN e FBM
na faixa de 25 a 1000 mg. A
Figura 3B mostra um aumento na remoção do
analito até 250 mg tanto pata FBN
quanto FBM com adsorção, respectivamente,
de 40 a 90%. Acima de 250 mg do
adsorvente, observou-se uma redução na
eficiência de remoção do analito de
interesse com menor intensidade para FBM
podendo ser atribuído as moléculas
de tiosemicarbazida adsorvidas e que
provavelmente estejam em maior contato
durante a agitação. Desta forma as
moléculas estarão interagindo mais entre
si, com formação preferencial de dímeros
por ligações de hidrogênio
estabelecidas entre os grupos amino, em
detrimento a interação com As(III).
Na melhor condição de pH e massa do
adsorvente avaliou-se a influência do
tempo de contato de 10 a 150 min (Figura
3C). A quantidade de As (III)
removida apresentou melhor eficiência no
tempo de 60 min, sendo obtido 35%
(FBN) e 85% (FBM). Em intervalos de tempo
superiores a 60 min, não houve
variação significativa na remoção do
arsênio, indicando o alcance do
equilíbrio. Em intervalos de tempo
superiores a 60 min ocorre uma ligeira
diminuição no percentual de remoção
podendo ser atribuído ao deslocamento
desse equilíbrio, provavelmente devido à
ocorrência de processos
competitivos de dessorção.
3 - Aplicação do método em amostra de água
do mar sintética
Nas melhores condições otimizadas em água
desionizada: (i) 250 mg do
adsorvente; (ii) pH 4,0; (iii) 60 min de
contato do analito com
bioadsorvente e (iv) 25 mL de amostra,
aplicou-se o método para a remoção de
As(III) em amostra de água do mar
sintética. O intuito de aplicar o método
para amostras de alto teor salino como a
água de mar é para avaliar o
possível efeito de íons concomitantes no
processo de adsorção de As(III) na
FBM. O resultado obtido para a
determinação de As(III) em água do mar
antes
e após o procedimento de adsorção (Tabela
2).
Os resultados indicam eficiência da
adsorção de As(III) pela FBM, com taxa
de adsorção que correspondem a
aproximadamente 70% de remoção, mesmo em
um
meio aquoso com alto teor salino. A taxa
de remoção é suficiente, para que
após aplicação do procedimento, as
amostras de água possam ser consideradas
remediadas pela contaminação de As(III),
uma vez que as concentrações finais
podem recair dentro do limite tolerado
pela legislação vigente. Portanto a
FBM, possui condições satisfatórias de ser
aplicada em amostras reais.
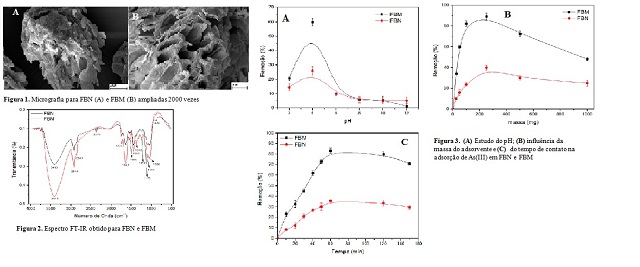
1 - Micrografia para FBN (A) e FBM (B) ampliadas 2000 vezes 2 - Espectro FT-IR obtido para FBN e FBM 3 - Ensaios de adsorção para FBN e FBM

Tabela 1: Porcentagem de CNHS obtida para FBN e FBM Tabela 2 Aplicação do método para adsorção de As(III) pela FBM em amostra de água de mar
Conclusões
O uso da farinha da casca da banana modificada quimicamente com tiosemicarbazida mostrou-se eficiente para remoção de As (III) em diferentes meios aquosos, com remoção satisfatória quando aplicadas em matrizes com alto teor salino, como em água do mar. Estudos cinéticos juntamente com a adequação do equilíbrio de adsorção pela isoterma de Langmuir apontam para mecanismos de fisiosorção não controlados por difusão intra-partícula. Os resultados indicam a formação de uma dupla camada elétrica que se estende em uma camada limite permeada sobre a FBM. Considerando que a casca da banana é uma biomassa de baixo custo, o presente estudo sugere a possibilidade do uso deste material no desenvolvimento de tecnologias alternativas eficientes, sustentáveis e acessíveis para remediação de ambientes aquosos contaminados com arsênio. Tais tecnologias podem vir a ser aplicadas complementando os processos convencionais de tratamento já existentes.
Agradecimentos
Ao Instituto de Química da Universidade Federal de Uberlândia pela infraestrutura concedida e aos órgãos de fomento (CAPES, CNPq e FAPEMIG) pelo financiamento de projetos.
Referências
AHMAD, T.; DANISH, M. Prospects of banana waste utilization in wastewater treatment: A review. Journal of Environmental Management, v. 206, p. 330, 2018.
ALI, A. Removal of Mn(II) from water using chemically modified banana peels as efficient adsorbent. Environmental Nanotechnology, Monitoring & Management, v.7, p. 57, 2017.
ALI, S. et al. High sorption efficiency for As(III) and As(V) from aqueous solutions using movel almond shell biochar. Chemosphere, v. 243, p.125330, 2020.
ALVES, V. N. et al. Determination of inorganic arsenic in natural waters after selective extraction using Moringa oleifera seeds. Ecological Engineering, v. 106, p. 431, 2017.
ANNADURAI, G.; JUANG, R. S.; LEE, D. J. Adsorption of heavy metals from water using banana and orange peels. Water Science and Technology, v. 47, p. 185, 2003.
ASERE, T. G.; STEVENS, C. V.; LAING, G. D. Use of (modified) natural adsorbents for arsenic remediation: A review. Science of the Total Environment, v. 676, P. 706, 2019.
ASHRAF, A. et al. Chromium(VI) sorption efficiency of acid-activated banana peel over organo-montmorillonite in aqueous solutions. International Journal of Phytoremediation, v. 19, p. 605, 2017.
BHATNAGAR, A.; SILLANPÃÃ, M.; WITEK-KROWIAK, A. Agricultural waste peels as versatile biomass for water purification – A review. Chemical Engineering Journal, v. 270, p. 344, 2015.
BUDZIAK, C. R.; MAIA, C. M. B.F.; MANGRICH, A. S. Transformações químicas da matéria orgânica durante a compostagem de resíduos da indústria madeireira. Química Nova, v.27, p.399, 2004.
CHATJIGAKIS, K. et al. FT-IR spectroscopic determination of the degree of esterification of cell wall pectins from stored peaches and correlation to textural changes. Carbohydrate Polymers, v. 37, p.395, 1998.
COELHO, N. M. M.; SILVA, A. C.; SILVA, C. M. Determination of As(III) and total inorganic arsenic by flow injection hydride generation atomic absorption spectrometry. Analytica Chimica Acta, v. 460, p. 227, 2002.
Conselho Nacional de Meio Ambiente (CONAMA). Resolução no 357/2005. [Link] http://www2.mma.gov.br/port/conama/legiabre.cfm?codlegi=459 Acesso em: 18 de junho 2021.
CORTI, G. C. et al. Estudo da capacidade de complexação de íons Cu2+ em solução aquosa usando celulose modificada com anidrido succínico e com poliamidas. Polímeros: Ciência e Tecnologia, v.14, p. 313, 2010.
GONG, R. et al. Removal of basic dyes from aqueous solution by sorption on phosphoric acid modified rice straw. Dyes and Pigments, v. 73, p. 332, 2007.
HASSAN et al. Critical review of magnetic biosornets: Their preparation, application, and regeneration for wastewater treatment. Science of the Total Environment, v. 702, p. 134883, 2020.
HO, Y. S.; MCKAY, G. Pseudo-second order model for sorption processes. Process Biochemistry, v. 34, p. 451, 1999.
LIBATIQUE, M. J. H. et al. Total and inorganic arsenic biosorption by Sarcodia suiae (Rhodophyta), as affected by controlled environment conditions. Chemosphere, v. 248, p. 126084, 2020.
LOPES, W. A. Esquemas para Interpretação de Espectros na Região do infravermelho. Química Nova, v. 27, p. 670-673, 2004.
MASSOCATTO, C. L. et al. Preparation and evaluation of kinetics and thermodynamics studies of lead adsorption onto chemically modified. Desalinization and Water Treatment, v. 52, p. 5682, 2013.
Ministério da Saúde. Portaria 2914/2011. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2011/prt2914_12_12_2011.html
Acesso em: 20 de junho 2021.
MONTERO, J. I. Z. et al. High efficiency removal of As(III) from waters using a new and friendly adsorbents based on sugarcane bagasse and corcob husk Fe-coated biochars. Ecotoxicology and Environmental Safety, v. 162, p. 616, 2018.
NERIS, J. B. et al. Evaluation of adsorption processes of metal íons in multi-element aqueous systems by lignocellulosic adsorbents applying different isotherms: A critical review. Chemical Engineering Journal, v. 357, p. 404, 2019.
OGUNLEYE, O. O.; AJALA, M. A.; AGARRY, S. E. Evaluation of Biosorptive Capacity of Banana (Musa paradisiaca) Stalk for Lead(II) Removal from Aqueous Solution.Journal of Environmental Protection, v. 5, p. 1451, 2014.
PAIVA, J. M. F. et al. Carbon fiber reinforced carbon composites from renewable sources. Polymer – Plastics Technology and Engineering, v. 43, p. 1187, 2004.
PAVAN, F. A. et al. Use of ponkan mandarin peels as biosorbent for toxic metals uptake from aqueous solutions. Journal of Hazardous Materials, v. 137, p. 527, 2006.
PHOLOSI, A.; NAIDOO, E. B.; OFOMAJA, A. E. Enhanced Arsenic (III) adsorption from aqueous solution by magnetic pine cone biomass. Materials Chemistry and Physics, v. 220, p. 20, 2019.
REGALBUTO, J. R.; ROBLES, J. The Engineering of Pt/Carbon Catalyst Preparation For application on Proton Exchange Fuel Cell Membrane (PEFCM). University of Illinois: Chicago, 2004.
RIBEIRO, C. M. R.; SOUZA, N. A. Esquema geral para elucidação de substâncias orgânicas usando métodos espectroscópico e espectrométrico. Química Nova, v. 30, p.126, 2007.
SALAMUN, N. et al. Acid-vacuo heat treated low cost banana stems fiber for efficient biosorption of Hg(II). Royal Society of Chemistry, v. 5, p. 14129, 2015.
SINGH, K.; GAUTAM, M. J. Development of inexpensive biosorbents from de-oiled mustard cake for effective removal of As(V) and Pb(II) íons from their aqueous solutions. Journal of Environmental Chemical Engineering, v. 5, p. 4728, 2017.
SOUSA-PEREIRA, D. et al. Síntese e avaliação da atividade anticorrosiva de tiossemicarbazida e tiossemicarbazona 4-N-(p-metoxifenil) substituídas. Revista Virtual de Quimica, v.5, p. 770, 2013.
STAVRINOU, A.; AGGELOPOULOS, C. A.; TSAKIROGLOU, C. D. Exploring the adsorption mechanisms of cationic and anionic dyes onto agricultural waste peels of banana, cucumber and potato: Adsorption, kinetics and equilibrium isotherms as a tool. Journal of Environmental Chemical Engineering, v. 6, p. 6958, 2018.
SUN, H-W. et al. Simultaneous determination of trace arsenic (III), antimony (III), total arsenic and antimony in Chinese medicinal herbs by hydride generation-double channel atomic fluorescence spectrometry. Analytica Chimica Acta, v.505, p.255, 2004.
WALKER, G., WEATHERLEY, L. Kinetics of acid dye adsorption on GAC. Water Resources, v. 33, p. 1895, 1999.
WILES, D. M.; SUPRUNCHUK, T. The infrared absorption spectra of thiosemicarbazide and related compounds: NH2 and NH vibrations. Canadian Journal Chemistry, v.47, p.1087, 1969.


