Síntese, caracterização, estudo termoanalítico e avaliação da solubilidade de um novo cocristal de norfloxacino com ácido picolínico
- Home
- Trabalhos
ÁREA
Química Analítica
Autores
Ferreira, P.O. (POSMAT - FACULDADE DE CIÊNCIAS, UNESP - BAURU) ; Almeida, A.C. (POSMAT - FACULDADE DE CIÊNCIAS, UNESP - BAURU) ; Costa, G.P. (FACULDADE DE CIÊNCIAS, UNESP - BAURU) ; Ferreira, L.T. (INSTITUTO DE QUÍMICA, UNESP - ARARAQUARA) ; Caires, F.J. (FACULDADE DE CIÊNCIAS, UNESP - BAURU)
RESUMO
Um dos maiores problemas no desenvolvimento de novos fármacos é a baixa solubilidade, problema encontrado até mesmo em fármacos já comercializados. Cocristais farmacêuticos são uma abordagem que melhora essa, entre outras propriedades. Este trabalho teve como objetivo a cocristalização do norfloxacino, um antibiótico de amplo espectro, que possui baixa solubilidade e permeabilidade, com ácido picolínico, focando na melhoria da solubilidade aquosa do fármaco. O cocristal foi sintetizado pelo método mecanoquímico, caracterizando por técnicas termoanalíticas (TG-DTA e DSC), espectroscópica (IV) e difratométrica (DRXP), sua solubilidade aquosa foi determinada, e o cocristal e mostrou 7,2 vezes mais solúvel que o NOR isolado.
Palavras Chaves
Cocristais; Norfloxacino; Química do estado sólido
Introdução
A baixa solubilidade em água faz com que grande parte das novas moléculas descobertas com grande potencial farmacológico pouquíssimas cheguem a fase de comercialização (CHAUDHARI et al., 2019; PINDELSKA; SOKAL; KOLODZIEJSKI, 2017). Atualmente, existem diversas estratégias para melhorar propriedades de IFAs (Ingrediente Farmacêutico Ativos), entre elas se destacam os cocristais, que são definidos como cristais que se constroem a partir de dois ou mais componentes no estado sólido em condições ambientes, orientados por interações intermoleculares (principalmente interações de hidrogênio) em proporções estequiométricas entre um fármaco e um formador de cocristal (coformador) (DOUROUMIS; ROSS; NOKHODCHI, 2017; KAVANAGH et al., 2018). O fármaco escolhido para este trabalho é o norfloxacino (NOR), antibiótico de amplo espectro, utilizado principalmente para infecções do trato urinário, mas também para infecções sexualmente transmissíveis (BEARDEN; DANZIGER, 2001; DE SOUZA, 2005), que possui baixa solubilidade aquosa e permeabilidade, o que significa que possui dificuldade para atravessar biomembranas e é pouco solúvel em água, sendo classificado com classe IV do BCS (sistema de classificação biofarmacêutica) (BREDA et al., 2009; FERREIRA et al., 2020), o que o torna de interesse para esse estudo. O objetivo desse trabalho, foi sintetizar cocristais de NOR com ácido picolínico (PCA), pelo método mecanoquímico, caracterizando por analise térmica (TG-DTA e DSC), analise espectroscópica (IV) e difratométrica (DRXP). A solubilidade aquosa do cocristal foi avaliada, bem como um estudo da sua variação com o pH.
Material e métodos
O cocristal foi sintetizado pelo método mecanoquímico, onde as misturas foram moídas em um moinho de bolas da RETSCH, modelo MM 400, na frequência de 15 Hz por 30 min, com emprego de solvente (LAG – Liquid Assisted Grinding; 0,25 μL mg-1 de etanol). As curvas TG-DTA foram obtidas no equipamento da NETZSCH em cadinho de α-Al2O3 (70 μL), intervalo de temperatura de 30-800 ºC e massa de amostra de 5 mg. E as curvas DSC foram obtidas no equipamento da METTLER TOLEDO, modelo DSC 1, na faixa de temperatura de 25 até 300 °C, cadinhos de alumínio de 40 μL, massa de amostra de 2,5 mg, ambos com razão de aquecimento de 10 ºC min-1 e atmosferas de ar sintético com vazão de 50 mL min-1. Os espectros no IV foram obtidos no espectrômetro da Thermo Scientific, modelo Nicolet iS10, usando a técnica de refletância total atenuada (ATR) com cristal de germânio, no intervalo de 675 cm-1 a 4000 cm-1, resolução de 4 cm-1 e 32 varreduras por espectro. E os difratogramas de raios X do pó foram obtidos no Difratômetro da RIGAKU, Modelo MiniFlex, utilizando-se tubo de cobre, submetido a 40 kV, corrente de 15 mA, Cu κα, λ = 1,54056 Å, 5 ≤ 2θ ≤ 50, no modo de varredura contínuo, com velocidade de 4° min-1. Para determinação da solubilidade, o método shake-flask foi utilizado, em uma incubadora shaker da Marconi, modelo MA420, onde 30 mg de NOR e cocristal foram colocados em tubos de ensaio, com 5,0 mL de água e soluções tampões (pH 3,0; 6,1 e 8,5), a 60 rpm, por 24h, a 37 °C. Para a quantificação um método validado de quantificação do NOR foi utilizado (CHIERENTIN; SALGADO, 2014), em um espectrofotômetro da Shimadzu, modelo UV 1800, e cubetas de quartzo com caminho óptico 10 mm, com leituras em triplicata no comprimento de onda de 277 nm.
Resultado e discussão
A curva TG, Fig. 1a, do sistema NOR-PCA/LAG mostra que ele sofre
decomposição térmica em pelo menos quatro etapas de perda de massa,
correspondendo a eventos endo e exotérmicos na curva DTA e apresenta
estabilidade térmica até 190 °C, sendo intermediária ao API (259 °C) e ao
coformador (116 °C). O evento endotérmico em 239 °C na curva DSC, Fig. 1b, é
atribuído à fusão seguida de decomposição do sistema, sendo uma temperatura
superior à observada para o NOR (222 °C) e PCA (138 °C). O difratograma do
sistema, apresenta novos picos, como indicado com o sinal de mais, e
desaparecimento de picos indicados com asterisco, na Fig. 1c, o que confirma
a formação de uma nova fase cristalina. O espectro do NOR-PCA/LAG, apresenta
deslocamento da banda da carbonila, (v C=O 1711 cm-1), para um comprimento
de onda inferior aos dos componentes isolados (v C=O NOR 1728 cm-1 e PCA
1722 cm-1). Bem como o desaparecimento das bandas referentes a interação
intramolecular do PCA (v COOH--Naromático - 2604 e 1874 cm-1), o que indica
o rompimento dessas interações. E a presença de uma banda alargada entre
3669 a 2467 cm-1 sugere o estabelecimento de novas interações entre o grupo
ácido do NOR com o grupo ácido do PCA formando o homosinton ácido-ácido.
Observa-se que a solubilidade aquosa do cocristal NOR-PCA/LAG, Fig. 2a, é de
7,2 vezes maior que a solubilidade do NOR, o que confirma que a
cocristalização proporcionou um aumento significativo nesse parâmetro. Um
estudo da variação da solubilidade pelo pH foi realizado, Fig. 2a, se
mostrando pH-dependente, com uma solubilidade maior em meio ácido (pH 3,0),
intermediaria em pH 6,1 e com decréscimo da solubilidade em meio básico (pH
8,5), valores observados na Figura 2b.
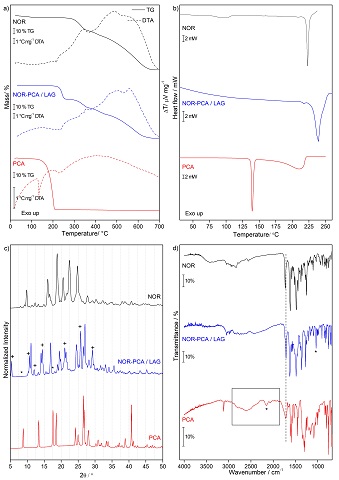
a) Curvas TG-DTA, b) DSC, c) DRXP e d) IV do NOR, NOR-PCA / LAG e PCA

a) Comparação da solubilidade do cocristal NOR-PCA/ LAG em água e meio tamponado, b) Tabela 1
Conclusões
Com os dados apresentados, conclui-se que houve a formação de um novo cocristal de NOR com PCA, o qual possui solubilidade aquosa 7,2 vezes maior que a do NOR, possuindo também, uma dependência de pH, esse cocristal poderia ser utilizado pela indústria para obtenção de uma forma mais solúvel de norfloxacino.
Agradecimentos
Os autores agradecem a CEPID/CDMF, FAPESP (Proc. 2017/14936-9, 2018/12463-9, 2018/24378-6, 2020/07724-8), CNPq (Proc. 143246/2017-8) e CAPES (Proc. 88887.495141/2020-00), pelo suporte financeiro.
Referências
BEARDEN, D. T.; DANZIGER, L. H. Mechanism of Action of and Resistance to Quinolones. Pharmacotherapy, [s. l.], v. 21, n. 10 Part 2, p. 224S-232S, 2001. Disponível em: <http://doi.wiley.com/10.1111/j.1751-7915.2008.00063.x>
BREDA, S. A.; JIMENEZ-KAIRUZ, A. F.; MANZO, R. H.; OLIVERA, M. E. Solubility behavior and biopharmaceutical classification of novel high-solubility ciprofloxacin and norfloxacin pharmaceutical derivatives. International Journal of Pharmaceutics, [s. l.], v. 371, n. 1–2, p. 106–113, 2009.
CHAUDHARI, S.; NIKAM, S. A.; KHATRI, N.; WAKDE, S. CO-CRYSTALS: A REVIEW. Journal of Drug Delivery and Therapeutics, [s. l.], v. 8, n. 6- s, p. 350–358, 2019. Disponível em: <http://jddtonline.info/index.php/jddt/article/view/2194>
CHIERENTIN, L.; SALGADO, H. R. N. Performance Characteristics of UV and Visible Spectrophotometry Methods for Quantitative Determination of Norfloxacin in Tablets. Journal of Scientific Research, [s. l.], v. 6, n. 3, p. 531–541, 2014. Disponível em: <https://www.banglajol.info/index.php/JSR/article/view/18381>
DE SOUZA, M. New Fluoroquinolones: A Class of Potent Antibiotics. Mini-Reviews in Medicinal Chemistry, [s. l.], v. 5, n. 11, p. 1009–1017, 2005. Disponível em: <http://www.eurekaselect.com/openurl/content.php?genre=article&issn=1389-5575&volume=5&issue=11&spage=1009>
DOUROUMIS, D.; ROSS, S. A.; NOKHODCHI, A. Advanced methodologies for cocrystal synthesis. Advanced Drug Delivery Reviews, [s. l.], v. 117, p. 178–195, 2017. Disponível em: <http://linkinghub.elsevier.com/retrieve/pii/S0169409X17301059>
FERREIRA, P. O.; DE ALMEIDA, A. C.; DOS SANTOS, É. C.; DROPPA, R.; FERREIRA, F. F.; KOGAWA, A. C.; CAIRES, F. J. A norfloxacin-nicotinic acid cocrystal: Mechanochemical synthesis, thermal and structural characterization and solubility assays. Thermochimica Acta, [s. l.], v. 694, 2020.
KAVANAGH, O. N.; CROKER, D. M.; WALKER, G. M.; ZAWOROTKO, M. J. Pharmaceutical cocrystals: from serendipity to design to application. Drug Discovery Today, [s. l.], p. 21, 2018. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S1359644618303751>
PINDELSKA, E.; SOKAL, A.; KOLODZIEJSKI, W. Pharmaceutical cocrystals, salts and polymorphs: Advanced characterization techniques. Advanced Drug Delivery Reviews, [s. l.], v. 117, p. 111–146, 2017. Disponível em: <https://linkinghub.elsevier.com/retrieve/pii/S0169409X17301953>


