Utilização da farinha da casca de banana, in natura e quimicamente modificada com tiosemicarbazida, como bioadsorvente na remoção de Sb(III) e Se(IV) em matrizes aquáticas
- Home
- Trabalhos
ÁREA
Química Ambiental
Autores
Paniagua, C.E.S. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Costa, B.E.S. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA) ; Coelho, N.M.M. (UNIVERSIDADE FEDERAL DE UBERLÂNDIA)
RESUMO
Neste trabalho, a farinha da casca de banana sem qualquer modificação (in natura, FBN) e modificada com tiosemicarbazida (FBM) foram investigadas como adsorventes para a remoção a níveis traço de Sb(III) e Se(IV) em matrizes aquosas. Nas condições otimizadas foi possível alcançar remoção de até 78% para Sb(III) e 83% para Se(IV) empregando FBM. O mecanismo de adsorção foi baseado em cinéticas de difusão intra- partícula para Sb(III) e Avrami para Se(IV), sendo ambos ajustados para a isoterma de Langmuir. O procedimento foi aplicado em matriz sintética de água do mar, obtendo remoção de 66% de Sb(III) e 60% de Se(IV), demonstrando ser uma alternativa acessível, promissora e ecologicamente correta para remediação de águas naturais contaminadas com Sb e Se presentes a níveis traço.
Palavras Chaves
bioadsorvente; metais; matrizes aquosas
Introdução
O depósito de efluentes sanitários e industriais em recursos hídricos tem ocasionado desequilíbrios ambientais e distúrbios em organismos aquáticos, devido à toxicidade de compostos que atualmente são reconhecidos como contaminantes emergentes. Esses contaminantes não são limitados apenas a moléculas orgânicas, mas também a elementos (semi) metálicos que constituem uma ameaça a manutenção da qualidade ambiental, uma vez que não são degradáveis (FREITAS et al., 2020; K’OREJE et al., 2020). Os Contaminantes de Interesse Emergente (CIE) são substâncias químicas de origem antrópica ou natural, cuja ocorrência ou relevância no ambiente foi constatada a partir do início da década de 1990, com o advento de técnicas analíticas hifenadas e devido ao melhoramento da sensibilidade das técnicas já existentes, que possibilitaram a identificação de substâncias em concentrações de ng L-1 a μg L-1(K’OREJE et al., 2020). Dentre as diversas classes dos CIE se encontram composições contendo (semi) metais, que na forma solúvel representam grande risco tanto a biota aquática quanto ao ser humano (DALZOCHIO et al., 2017). Os CIE ainda não possuem uma legislação que estabeleça padrões de potabilidade e/ou os níveis de toxicidade delimitados para condições seguras de exposição (K’OREJE et al., 2020). Neste contexto, elementos como antimônio (Sb) e selênio (Se) tem-se tornado uma preocupação ambiental em função da constante detecção nos corpos aquáticos é devido ao seu uso abundante em formulações farmacêuticas. O Sb(III) é reconhecido em aplicações terapêuticas no tratamento da leishmaniose, podendo ser excretado pela urina, retornando ao meio aquático devido à ineficiência dos processos tradicionais de tratamento de esgoto, compreendendo um ciclo danoso de acumulação e biodisponibilidade (FABRINO et al., 2021). O Sb pode ser incorporado ao organismo humano pelo consumo de água e alimentos contaminados, podendo afetar: (i) atividades enzimáticas; (ii) comprometendo vias metabólicas e (iii) afetar o sistema nervoso (LONG et al., 2020). O Se(IV) por sua vez, é bastante utilizado em componentes eletrônicos, indústria de tintas, fabricação de vidros, cerâmica, metalurgia, indústria química, farmacêutica, na agricultura e na saúde humana como um micronutriente. Também são reportados estudos que reconhecem a administração de Se como potente agente quimio-preventivo do câncer (SINHA; EL-BAYOUMY, 2004). Entretanto o acúmulo de Seno ambiente por vias de excreção pode desencadear diversos efeitos deletérios em peixes, invertebrados e plantas (ETTEIEB et al., 2020). Em função da crescente presença destes elementos em corpos hídricos, a União Européia (UE) e a Agência de Proteção Ambiental dos Estados Unidos (USEPA) os consideraram como poluentes de preocupação prioritária. A resolução 357 do Conselho Nacional do Meio Ambiente (CONAMA) estabelece apenas valores em relação à concentração de Sb e Se total, não prevendo concentrações especificamente para Sb(III), se tratando da espécie mais tóxica de antimônio. Quanto ao Se, existe necessidade de se reformular a legislação estabelecendo uma concentração que define sua toxicidade a fim de diferenciar de sua essencialidade no organismo (CONAMA, 2005). Dentre as diversas técnicas utilizadas para remoção de compostos inorgânicos, a adsorção tem despertado o maior interesse em função da possibilidade de se trabalhar com adsorventes naturais em substituição aos materiais sintéticos, que na maioria das vezes apresentam um sistema de produção oneroso. Na literatura, são reportados diversos trabalhos envolvendo adsorventes sintéticos que apresentaram elevada eficiência de remoção para Sb(III) e Se(IV) (SALEH; SARI; TUZEN, 2017; XU et al., 2020). Inúmeros trabalhos vêm empregando o uso de adsorventes naturais para remediação ambiental. Estes materiais são oriundos majoritariamente, de resíduos da agroindústria possuindo as seguintes vantagens: (i) abundância na natureza; (ii) baixo valor comercial; (iii) origem regionalizada, que facilita a redução dos custos com transporte; (iv) ampla diversidade; (v) são renováveis; (vi) elevada eficiência para remoção de íons metálicos e (vi) possibilidade de recuperação de compostos de interesse (ANASTOPOULOS et al., 2019; FREITAS et al., 2020; HASSAN et al., 2020). Entretanto, trabalhos envolvendo o emprego de materiais alternativos, como adsorventes naturais ainda são pouco explorados em finalidades de remediação de águas contaminadas com Sb(III) e Se(IV) (THUAN et al., 2017; CHEN et al., 2018). Neste contexto, este trabalho teve como objetivo investigar a capacidade adsortiva da farinha da casca de banana na forma in natura (FBN) e quimicamente modificada com tiosemicarbazida (FBM) na adsorção de Sb (III) e Se(IV) em água desionizada e em água de mar sintética em concentrações na ordem de µg L-1.
Material e métodos
Reagentes e Equipamentos Água desionizada obtida por um sistema de purificação Milli-Q. Solução padrão (1000 mg L-1) de HSbO2 e H2SeO3em meio de HCl. Solução de NaBH4 estabilizada em NaOH 0,5% (m/v). Tiosemicarbazida – CH5N3S. Soluções de NaOH e HCl a 0,01 mol/L foram utilizadas para ajustar o pH do meio. A instrumentação utilizada foi um espectrômetro de absorção atômica com modelo SpectrAA-220 equipado com um acessório de gerador de hidretos modelo VGA 77, utilizando o gás N2 com uma vazão de 100,00 mL min-1. Lâmpada de catodo oco de Sb e Se. Preparação do bioadsorvente As cascas de banana foram colocadas ao sol pelo periodo de 48 h, posteriormente trituradas em um liquidificador e peneiradas a fim de se obter uma granulometria mais homogênea com partículas com diâmetro ≤ 80 μm. Em seguida foram lavadas com solução de HCl (0,05 mol L-1) e colocadas em repouso por 10 min. Posteriormente, lavadas com água desionizada até a obtenção de pH entre 6-8 e em seguida levada a estufa a 40ºC por 48 h. Este material foi denominado de FBN. Para obtenção da FBM, foi adicionado 50,0 mL de solução de tiosemicarbazida 0,01 mol L- 1 a 20,0 g da FBN. A mistura foi submetida à agitação magnética pelo período de 1 h, seguida de filtração. O material retido no papel de filtro foi levado à secagem na estufa a 40ºC durante 24 h. Estudo das variáveis, equilíbrio de adsorção e aplicação nas amostras O pH, a massa do adsorvente e o tempo de contato, são variáveis que influenciam diretamente no processo de adsorção. Os experimentos foram realizados em triplicata e otimizados de forma univariada. Para tanto, preparou-se soluções de 20 μg L-1 de Sb(III) e Se(IV) em diferentes valores de pH ( de 2,0 até 12,0). Tais valores foram ajustados utilizando HNO3 e NaOH ambos a 0,01 mol L-1. Em 25 mL da solução de trabalho foram adicionados 50 mg de FBN ou FBM e agitadas durante 60 min, a 250 rpm e em pH 4. Para verificar a influência da massa do adsorvente, avaliou-se seis diferentes massas (25, 50, 100, 250, 500 e 1000 mg) de cada bioadsorvente (FBN e FBM). A partir da melhor massa do adsorvente (250 mg), avaliou-se o tempo de contato do analito com o bioadsorvente, em um intervalo de tempo que variou de 10 a 180 min, conforme condições ótimas obtidas e apresentadas na Tabela 1. Para melhor compreensão dos mecanismos envolvidos no processo de adsorção foram realizados estudos cinéticos, empregando-se os modelos teóricos de difusão intra-partícula, Elovich e Avrami por regressão linear. A capacidade máxima adsortiva dos elementos pelo melhor adsorvente foi estimada pelas isotermas de adsorção e tratados pelos modelos de Langmuir, Freundlich e Sips por meio de ajuste de regressão linear. Após a etapa de otimização, a fim de avaliar a viabilidade do procedimento, os testes de adsorção foram aplicados em amostras de água de mar sintética (composta por uma mistura de 28,0 g de NaCl; 5,5 g de MgCl2.6H2O; 3,4 g de MgSO4 e 2,0 g de CaCl2.2H2O).
Resultado e discussão
Estudo das condições de adsorção do Sb
(III) e Se (IV)
O pH é um fator determinante no processo
de adsorção das espécies de Sb(III)
e Se(IV), uma vez que a adsorção de
cátions e ânions é dependente da carga
elétrica da superfície do material (FAN et
al., 2020; HUDCOVÁ et al., 2019).
Neste contexto, o estudo da influência do
pH da solução pode refletir em
diferentes porcentagens de remoção dos
analitos em relação aos
bioadsorventes (FBN e FBM).
Pela Figura 1A Observa-se que a FBM
apresentou porcentagens de remoção
superiores a FBN no intervalo de pH 2-6. A
máxima adsorção envolvendo FBN
para Sb(III) e Se(IV) é atingida em pH 4
com 21 e 25%, respectivamente. Ao
se empregar a FBM, a taxa de remoção para
Sb(III) e Se(IV) aumenta em
aproximadamente 60% para ambos os analitos
em pH 4. Nesse pH, as espécies
químicas predominantes para Sb(III) e
Se(IV) são respectivamente Sb(OH)3 e
HSeO3-(SANTOS et al., 2015; SASWATI et
al., 2013).
A partir do melhor pH obtido, realizou-se
o estudo da influência da variação
da massa de FBN e FBM na faixa de 25 a
1000 mg. Pela Figura 1B, observa-se
um aumento de eficiência de remoção dos
elementos até uma massa de 250 mg do
adsorvente, com eficiência de remoção de
78 e 83%, respectivamente, para
Sb(III) e Se(IV). Em valores acima de 250
mg, ocorre a diminuição da
adsorção com tendência a estabilidade a
partir de 500 mg, podendo ser
atribuído a saturação dos sítios ativos
disponíveis para o estabelecimento
de equilíbrio.
Na sequência, fez se necessário avaliar o
efeito do tempo de contato no
processo de adsorção. Para tanto, avaliou-
se um intervalo de tempo de
contato compreendido entre 10 a 180 min
(Figura 1C). Observa-se um aumento
na eficiência de remoção até 60 min, com
26% (FBN) e 73% (FBM) para ambos os
analitos.
Cinética de Adsorção
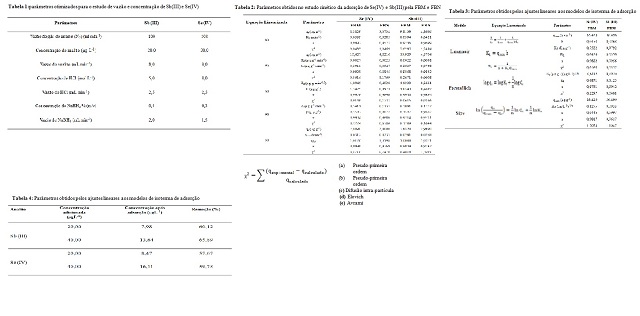
Pela Tabela 2, observa-se que todos os
modelos cinéticos testados apresentam
bons ajustes (r > 0,99) para a adsorção de
Se(IV) pela FBM. Essa adequação
global reflete em coeficientes de
correlação mais próximos da unidade para
os modelos de pseudo-primeira ordem e
Avrami, sendo que estes assumem que a
velocidade de adsorção é fortemente
dependente da quantidade de sítios
ativos disponíveis, e que a mesma
apresenta ordem fracionária, dado pelo
coeficiente nAV,(SIMONIN et al., 2016).
O efeito da modificação da farinha da
casca de banana na adsorção de Se(IV)
indica que a taxa de adsorção não é
constante, e que, portanto não há
predominância de uma única etapa
controladora da velocidade. Vários
mecanismos físico-químicos podem estar
atuando conjuntamente sugerindo, por
exemplo, a formação de ligações
coordenadas Se(IV)–S.
Já com relação ao Sb(III), melhores
ajustem foram obtidos para a difusão
intra-partícula, tanto para FBN quanto
para FBM. De acordo com Webber e
Moris (2003), esse modelo considera a
permeabilidade do filme do adsorvato
sobre a superfície do material, e o quão
rápido ele pode se difundir para
dentro dos poros do adsorvente (WEBER;
MORRIS, 2003).
O ajuste no modelo de difusão intra-
partícula geralmente é caracterizado por
múltiplos estágios de adsorção, sendo
representado por mais de uma região
linear, conforme pode ser observado na
Figura 1C (WEBER; MORRIS, 2003).
Outro aspecto que deve ser destacado é que
nenhuma das equações que
descrevem a primeira região do ajuste
apresentou coeficiente linear nulo, do
qual é dado pelo parâmetro C. De acordo
com Boyd, Schubert e Adamson (1947)
esse fato implica em que a de difusão de
Se(IV) e Sb(III) para dentro dos
poros não é o fator limitante da
velocidade de adsorção, mas que esta é
controlada pela formação e extensão da
camada limite, cuja espessura é
representada por C (BOYD; SCHUBERT;
ADAMSON, 1947).
Observa-se também pela Figura 1D, que a
adsorção tanto de Se(IV) quanto de
Sb(III) pela FBN podem ser descritas pela
formação de uma única camada que
permeia a superfície do adsorvente, e logo
após é estabelecido o equilíbrio
na interface. Conclusões similares foram
obtidas por Cheng e colaboradores
(2020) na investigação cinética da
adsorção de Sb(III) em um novo adsorvente
híbrido, denominado Fe-MIL-88B e por
Kalaitzidou e colaboradores (2019) que
abordaram a adsorção de Se(IV) e Se(VI)
por FeOOHs
Os resultados obtidos para FBM indicam um
decréscimo da taxa de adsorção
para ambos os elementos após a formação da
camada limite, visto que as
moléculas de tiosemicarbazida foram
adsorvidas previamente, o que requer um
maior tempo de contato podendo favorecer
as interações entre as moléculas de
tiosemicarbazida, com formação de dímeros
por ligações de hidrogênio entre
os grupos amino, em detrimento a interação
com Se(IV) e Sb(III).
Isotermas de Adsorção
A aplicação dos modelos permitiu verificar
a quantidade máxima de Se(IV) e
Sb(III) que podem ser adsorvidas numa dada
massa (em gramas) de FBM. Como os
resultados anteriores demonstraram uma
maior eficiência na remoção dos
elementos pela FBM em relação à FBN, então
somente o adsorvente modificado
foi levado em consideração para os ensaios
de isotermas de adsorção e
posterior aplicação nas amostras. Os dados
obtidos referentes aos ajustes
lineares para cada modelo testado estão
apresentados na Tabela 3.
Observa-se que para Sb(III) ambos os
modelos de Langmuir e Freundlich
proporcionaram bons ajustes, enquanto que
para o Se(IV), o modelo de Lagmuir
se mostrou mais adequado devido ao baixo
valor de erro dado por χ2. Os
resultados corroboram com os indicativos
do perfil cinético, no estudo de
difusão intra-partícula, uma vez que a
formação da camada limite é a etapa
determinante do processo adsortivo, o que
evidencia a adequação da isoterma
de Lagmuir para ambos os elementos.
O modelo de Langmuir é característico de
um adsorvente constituído por um
número finito de sítios de adsorção em que
cada sítio tem a capacidade de
adsorver apenas uma molécula em uma
monocamada. Todos os sítios possuem a
mesma energia e não existem interações
entre moléculas adsorvidas em sítios
vizinhos (LANGMUIR, 1918). Em comparação
com outros trabalhos da literatura,
o modelo de Langmuir também foi
considerado mais adequado em estudos
envolvendo a adsorção de Sb(III) e Sb(V)
em poliacrilonitrica ultra
funcionalizada com grupos amidoxima (TU et
al., 2020), bem como para a
adsorção de Se(IV) e Se(VI) usando
nanofolhas de MgO sintetizadas em
ultrassom (CUI et al., 2018).
Tanto para Se(IV) e Sb(III), foram obtidos
fatores de separação nas
condições limites (0<RL<1), indicando que
a adsorção dos elementos pela FBM
é favorável (LANGMUIR, 1918). Os
resultados demonstram eficiência relativa
na adsorção dos elementos. A capacidade
máxima adsortiva obtida para Se(IV)
pela FBM foi superior aos que foram
relatados por Gonzalez-Acevedo, Olguin e
Frias-Palos (2012) em um estudo de
adsorção e dessorção de selênio pelas
biomassas brutas de Eichhornia crassipes e
Lemna minor, das quais foram
registrados os valores de 0,3489 e 0,1855
µg g-1 respectivamente (GONZALEZ-
ACEVEDO; OLGUIN;FRIAS-PALOS, 2012).
Para o Sb(III), o resultado se mostrou
promissor quando comparado com
nanotubos de carbono (0,33 mg g-1). Apesar
de diferir em uma ordem de
grandeza em relação ao valor comparado,
esse resultado representa uma
porcentagem de remoção de Sb(III) em
magnitude equivalente ao que foi
reportado pelos autores (SALAM; MOHAMED,
2015).A partir do modelo de
Langmuir, os valores obtidos de qmax para
Se(IV) e Sb(III) indicam o
potencial da FBM para remediação, afim de
que as concentrações residuais
após o processo de adsorção em amostras
contendo teores iniciais a níveis
traço, recaiam em patamares tolerados
previstos pela legislação. Ao se
aplicar o método proposto em uma solução
salina a uma concentração de 40 µg
L-1 obtém-se uma eficiência de adsorção
para o Sb(III) e Se(IV),
respectivamente, de 66 e 60% pela FBM,
conforme apresentado na Tabela 4.
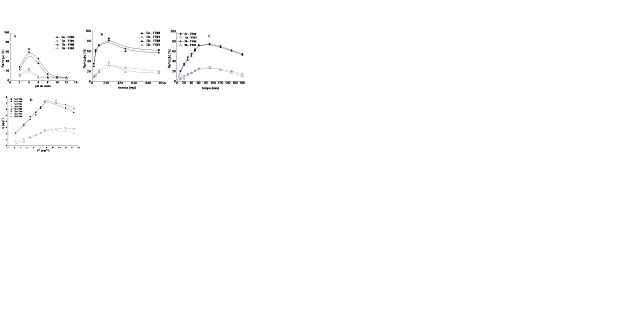
(A) Estudo da influência do pH; (B) da massa do adsorvente; (C) do tempo de contato na adsorção dos analitos; (D) Ajuste linear dos modelos cinéticos.
Conclusões
O procedimento baseado no uso da farinha da casca de banana modificada com tiosemicarbazida como adsorvente mostrou- se adequado para remoção de Sb(III) e Se(IV) em diferentes meios aquosos (água deionizada e água com alto teor salino). Os resultados são promissores para serem aplicados em finalidade de remediação ambiental, mesmo em concentrações a nível traço dos contaminantes. Os ensaios de otimização das variáveis que afetam o processo de adsorção promoveram eficiência máxima em até de 80% de remoção dos analitos em água deionizada e 60% em água de mar sintética. O procedimento representa uma alternativa segura e sustentável em relação ao uso de adsorventes comerciais e sintéticos, possibilitando sua utilização em outras matrizes aquosas de interesse ambiental.
Agradecimentos
Ao Instituto de Química da Universidade Federal de Uberlândia pela infraestrutura concedida e aos órgãos de fomento (CAPES, CNPq e FAPEMIG) pelo financiamento de projetos.
Referências
ANASTOPOULOS, I. et al. Agricultural biomass/waste as adsorbents for toxic metal decontamination of aqueous solutions. Journal of Molecular Liquids, v. 295, p. 111684, 2019.
BOYD, G. E.; SCHUBERT, J.; ADAMSON A. W. The exchange adsorption of ions from aqueous solutions by organic zeolites. I. Ion-exchange equilibria. Journal of the American Chemical Society, v. 69, 2836-2848, 1947.
CHEN, Y. et al. Four different kinds of peels as adsorbents for the removal of Cd (II) from aqueous solution: Kinetics, isotherm and mechanism. Journal of the Taiwan Institute of Chemical Engineers, v. 88, p.146-154, 2018.
CHENG, K. et al. New insights into the removal of antimony from water using and iron-based metal-organic framework: adsorption behaviors and mechanisms. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 602, p. 125054, 2020.
CUI, W. et al. Adsorption study of selenium ions from aqueous solutions using MgO nanosheets synthesized by ultrasonic method. Journal of Hazardous Materials, v. 341, p. 268–276, 2018.
DALZOCHIO, T. et al. Water quality parameters, biomarkers and metal bioaccumulation in native fish captured in the Ilha River, southern Brazil. Chemosphere, v. 189, p. 609-618, 2017.
ETTEIEB, S. et al. Monitoring and analysis of selenium as an emerging contaminant in mining industry: A critical review. Science of the Total Environmental, v.698, p.134339, 2020.
FABRINO, H. J. F. et al. Speciation of Antimony in injectable Leishmanicidial drugs by lowering citric acid concentration used in hybride generation atomic Absortion Spectrometry Analysis. Journal of the Brazilian Chemical Society, v. 32, p. 11-19, 2021.
FAN, Y. et al. Effect of pH on the adsorption of arsenic (V) and antimony (V) by the black soil in three systems: Performance and mechanism. Ecotoxicology and Environmental Safety, v. 191, p.110146, 2020.
FREITAS, F. F. et al. Avaliação da perda de massa de bagaço de abacaxi pré-tratado com peróxido de hidrogênio alcalino. Brazilian Journal of Development, v. 6. n.6, p.40813-40823, 2020.
GONZALEZ-ACEVEDO, Z. I.; OLGUIN, M. T.; FRIAS-PALOS, H. Sorption and desorption processes of selenium (VI) using non-living biomasses of aquatic weeds in horizontal flow. Water Air Soil Pollution, v. 223, p. 4119–4128, 2012.
HASSAN, M. et al. Critical review of magnetic biosorbents: Their preparation, application, and regeneration for wastewater treatment. Science of the Total Environment, v. 702, p. 134893, 2020.
HUDCOVÁ, B. et al. Antimonate adsorption onto Mg-Fe layered double hydroxides in aqueous solutions at different pH values: Coupling surface complexation modeling with solid-state analyses.Chemosphere, v. 229, p. 236, 2019.
KALAITZIDOU, K. et al. Adsorption of Se(IV) and Se(VI) species by iron oxy-hydroxides: effect of positive surface charge density. Science of the Total Environmental, v. 687, p. 1197-1206, 2019.
K’OREJE, K. O. et al. Occurrence and treatment of contaminants of emerging concern in the African aquatic environment: Literature review and a look ahead. Journal of Environmental Management, v.254, p. 109752, 2020.
LANGMUIR, I. The adsorption of gases on plane surfaces of glass, mic and platinum. Journal of the American Chemical Society, v. 40, n. 9, p. 1361-1403, 1918.
LONG, X. et al. A review of removal technology for antimony in aqueous solution. Journal of Environmental Sciences, v. 90, p. 189-204, 2020.
SALAM, M.A.; MOHAMED, R.M. Removal of antimony(III) by multi-walled carbon nanotubes from model solution and environmental samples. Chemical Engineering Research and Design, v. 91, p. 1352–1360, 2013.
SALEH, T. A.; SARI, A.; TUZEN, M. Effective adsorption of antimony (III) from aqueous soltions by polyamide-graphene compostie as a novel adsorbent. Chemical Engineering Journal, v. 307, p. 230-238, 2017.
SANTOS, S. et al. Selenium contaminated waters: An overview of analytical methods, treatment options and recent advances in sorption methods. Science of the Total Environment, v.521–522, p. 246–260, 2015.
SASWATI, R. et al. Mixed-ligand nickel (II) thiosemicarbazone complexes: Synthesis, characterization and biological evaluation. Polyhedron, v. 50, p. 354,2013.
SINHA, R.; E L-BAYOUMY, K. Apoptosis is a critical cellular event in cancer chemoprevention and chemotherapy by selenium compounds. Current Cancer Drug Targets, v. 4, n. 1, p. 13-28, 2004.
SIMONIN, J. P. On the comparison of pseudo-first order and pseudo-second order rate laws in the modeling of adsorption kinetics. Chemical Engineering Journal, v. 300, p. 254, 2016.
THUAN, T. V. et al. Response surface methodology approach for optimization of Cu2+, Ni2+ and Pb2+ adsorption using KOH- activated carbon from banana peel. Surfaces and Interfaces, v. 6, p. 209-217, 2017.
TU, Y. et al. Adsorption of antimonite and antimonate from aqueous solution using modified polyacrylonitrile with an ultrahigh percentage of amidoxime. Journal of Hazardous Materials, v. 388, p. 121, 2020.
XU, S. et al. Removal of Sb (III) from wastewater by magnesium oxide and the related mechanisms. Environmental Research, v. 186, p. 109489, 2020.
WEBER, W. J.; MORRIS, J.C. Kinetics of Adsorption on Carbon from Solution. Journal of the Sanitary Engineering Division, v. 89, p. 31-60, 1963.


