SOLUBILIDADE DES FILMES DE QUITOSANA COM DIFERENTES CONCENTRAÇÕES DE CERA DE ABELHA E TENSOATIVO
- Home
- Trabalhos
ÁREA
Química Ambiental
Autores
Assis, J.V. (UFERSA) ; Assis, M.C.P. (UFERSA) ; Morais, E.R.C. (UFERSA) ; Melo, R.R. (UFERSA) ; Santos, F.K.G. (UFERSA) ; Almeida, J.G.L. (UFERSA) ; Aroucha, E.M.M. (UFERSA) ; Leite, R.H.L. (UFERSA) ; Menezes, F.L.G. (UFERSA)
RESUMO
A quitosana é um dos biopolímeros mais utilizados na obtenção de filmes, devido suas propriedades físico-químicas, mecânicas e antimicrobianas. No entanto, os filmes de quitosana pura apresentam alta solubilidade, prejudicando aplicações em condições de alta umidade. Com isso, o objetivo deste trabalho é produzir filmes de quitosana com diferentes concentrações de cera de abelha e tensoativo e, posteriormente, avaliar a solubilidade dos mesmos. Os filmes quitosana foram produzidos a partir do método casting com diferentes concentrações de cera de abelha (1, 8 e 15%) e tensoativo (10, 30 e 50%). Depois, foi determinada a solubilidade dos filmes. Os resultados mostram que a solubilidade dos filmes diminui com o aumento da concentração de cera de abelha em comparação com o controle.
Palavras Chaves
biofilmes; óleo de canola saponifica; lipídios
Introdução
A quitosana é um dos biopolímeros mais utilizados, devido suas propriedades biológicas e novas aplicações, como no setor agrícola e indústria de alimentos, mas, especialmente, na indústria farmacêutica, isto se dar por ser um polímero não-tóxico, biodegradável, biocompatível, com propriedades funcionais, potencial antimicrobiano e antioxidante (ELGADIR et al., 2015). A quitosana é um polissacarídeo derivado por N-desacetilação com álcali forte da quitina, matéria prima abundante em resíduos de crustáceos, por exemplo. A quitina e a quitosana são constituídas por unidades de 2-acetamido-2-deoxi-D-glicopiranose e 2-amino- 2-deoxi-D-glicopiranose unidas por ligações glicosídicas β-(1-4), entretanto os polímeros diferem quanto à solubilidade e quanto à proporção relativa dessas unidades. Em função da sua estrutura química, a quitosana se torna uma excelente alternativa para ser utilizada como base na produção de nanopartículas, micropartículas, hidrogéis, embalagens e filmes biodegradáveis (FRÁGUAS et al., 2015). No entanto, os filmes de quitosana não apresentam boa resistência à água e nem propriedades de barreira satisfatória, principalmente para a utilização como embalagem, sendo comum a formação de blendas poliméricas contendo a quitosana associada a outro biopolímero (SANTACRUZ; RIVADENEIRA; CASTRO, 2015), ou lipídios (cera de abelha ou cera de carnaúba, por exemplo), ou, até mesmo, um processo de neutralização. A cera de abelha é um lipídio que possui alta hidrofobicidade e excelente resistência à umidade, apresentando-se como barreira eficaz à transmissão do vapor de água, mas valores baixos de resistência mecânica. A cera de abelha vem sendo amplamente pesquisada e aplicada em diversos ramos da indústria (cosméticos, farmacêutica e alimentos), e, na obtenção de coberturas associadas, ou não, a um biopolímero. (KLANGMUANG; SOTHORNVIT, 2016). No entanto, para se obter uma mistura entre o biopolímero e a cera é preciso usar tensoativos. Os tensoativos são moléculas anfifílicas cuja propriedade mais significativa é a de formar emulsões e estabilizar soluções bifásicas por meio de sua ação interfacial, isso ocorre pelo fato de que suas moléculas contém uma parte polar (hidrofílica) e outra apolar (lipofílica) (ZHU; FREE; YI, 2015; ZHU et al., 2017). Diante disto, o presente trabalho teve como objetivo verificar o efeito da influência da cera de abelha e do tensoativo (óleo de canola saponificado) na solubilidade em água dos filmes a base de quitosana.
Material e métodos
Os experimentos foram realizados no Laboratório de Tecnologia de Alimentos da Universidade Federal Rural do Semi-Árido-UFERSA. Foram produzidos filmes de quitosana com composições diferentes de cera de abelha e tensoativo (canola saponificada). As soluções filmogênicas de quitosana foram produzidas com base na metodologia de Bonilla e Sobral (2016), com algumas modificações. As soluções foram preparadas contendo 2% de massa seca, isso incluindo a quitosana, cera de abelha e tensoativo. A quitosana foi dissolvida em ácido acético 1% (v/v), sendo mantida sob agitação por 24 horas. Posteriormente, em outro recipiente, misturas de cera de abelha e tensoativo com diferentes composições (cera de abelha: 1, 8 e 15%; tensoativo: 10, 30 e 50%) foram solubilizados a 85°C. A cera de abelha foi adicionada levando em consideração a massa seca do biopolímero e o tensoativo levando em consideração à concentração de cera de abelha. Em seguida, a cera de abelha com o tensoativo foram misturados à solução de quitosana, ambas mantidas a 85ºC, sob agitação, por 10 minutos. Após obtenção das soluções, as mesmas foram distribuídas em bandejas de acrílico (15 cm x 15 cm x 1 cm) e submetidas à secagem na estufa a 50 °C, por 6 horas. Após a produção dos filmes, foi realizada a análise de solubilidade em água dos filmes. A solubilidade em água foi determinada em triplicata, onde foram destacados quadrados de 2 cm de lado dos filmes que foram secos a 105 ºC e pesados em uma balança de precisão para determinação de sua massa inicial. Em seguida, os filmes foram submetidos a agitação constante em água destilada por 24 horas a 26 ºC, etapa em que efetivamente os filmes foram expostos à solubilização. Após 24 h, os filmes foram secos a 105 ºC e pesados para a determinação da massa final (OLIVEIRA et al., 2018). A solubilidade em água pode ser calculada a partir da equação apresentada na Figura 1. Onde: S: Solubilidade dos filmes (%); mi: massa inicial da amostra do filme (g); mf: massa final da amostra do filme (g). A análise estatística consistiu de análise de variância (ANOVA) e teste de Tukey à 5% de nível de significância, através do software SISVAR.
Resultado e discussão
Os filmes biopoliméricos podem apresentar diferentes características e
propriedades, mas isso dependerá da formulação e do processo de produção. As
propriedades de barreira são parâmetros importantes a serem analisados, pois a
solubilidade em água, por exemplo, é essencial para avaliar a resistência dos
filmes em ambiente úmido e aquoso, além de indicar a biodegradabilidade,
servindo como indicativo da presença de grupos hidrofílicos (MIR et al., 2018),
e assim determinar a aplicabilidade dos filmes produzidos. Para se obter uma
baixa solubilidade, torna-se necessário a utilização de material insolúvel ou
pouco solúvel em água, ou seja, de caráter mais hidrofóbico, como por exemplo
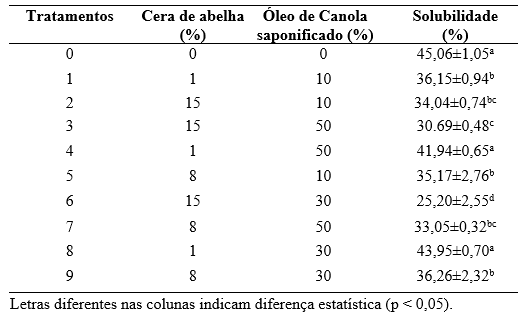
cera de abelha, que foi escolhida para ser utilizada neste trabalho. A Figura 2
mostra os resultados obtidos dos filmes de quitosana sem e com
diferentes concentrações de cera de abelha (1, 8 e 15%) e tensoativo (10, 30 e
50%). Na Figura 2, é possível observar que a quantidade de cera de
abelha influenciou na solubilidade em água dos filmes. A solubilidade diminui
com o aumento da concentração de cera de abelha, em comparação com o controle,
sendo que para os tratamentos 0 (controle), 2, 3 e 6, foram obtidos os valores
45,06 ± 1,05%, 43,95 ± 0,70%, 36,26 ± 2,32% e 25,20 ± 2,55%, respectivamente;
observando-se diferença significativa (p < 0,05) entre eles. Essa redução ocorre
devido à natureza hidrofóbica da cera de abelha que torna os filmes mais
resistente à água. Já os tensoativos são capazes de influenciar algumas
propriedades dos filmes, por isso sua adição deve ser controlada, isto é
observado nos tratamentos 4 (41,94 ± 0,65%) e 8 (43,95 ± 0,70%), onde a redução
da solubilidade foi mínima. Diferente deste trabalho, Santos et al. (2017)
avaliaram somente o efeito da adição de cera de carnaúba com diferentes
concentrações (0, 15, 30, 40 e 50%) nas propriedades dos filmes de quitosana. O
tensoativo utilizado foi Tween 20. Os resultados mostraram que a solubilidade em
água dos filmes de quitosana pura e com adição de 15% de cera foram de 12,31%,
ou seja, não havendo diferença entre 0 e 15% de cera. Um comportamento diferente
na solubilidade dos filmes foi detectado após a incorporação de 30% da cera, o
que ocasionou sua redução em 60%. Já os filmes com 40 e 50% de cera apresentaram
maior solubilidade do que os demais filmes contendo cera de carnaúba. Já na
pesquisa de Hromiš et al. (2015), como neste trabalho, utilizou-se a cera de
abelha em filmes de quitosana, no entanto, o tensoativo utilizado pelos autores
foi Tween 20, além de usar óleo essencial de cominho. As concentrações de cera
de abelha foram 0, 18, 36, 54, 72 e 90 kg/m3. Os resultados mostram que a
solubilidade em água dos filmes diminuiu com o aumento da quantidade de cera de
abelha (CW), passando de 13,92 ± 5,75 (quitosana pura) para 1,86 ± 0,4 (CW: 72
kg/m3) e 2,21 ± 1,47 (CW: 90 kg/m3). Na literatura também mostram estudos de
quitosana e cera associados a outros biopolímeros, como na pesquisa de Xavier et
al. (2020). Os autores estudaram propriedades dos filmes de fécula de
mandioca/quitosana e cera de carnaúba. No entanto, a variação das concentrações
não foram as de cera, mas dos biopolímeros, sendo 0 a 3 % tanto para fécula de
mandioca como para quitosana, já a cera de carnaúba foi utilizada no percentual
de 0,2%. Os resultados mostraram que as blendas de quitosana/fécula de
mandioca/cera de carnaúba apresentaram uma solubilidade menor dos que os filmes
só a base de fécula de mandioca, esse fenômeno é atribuído às interações de
hidrogênio que ocorrem entre as moléculas de quitosana e fécula, de modo a
aumentar a coesão da matriz, o que lhe confere maior estabilidade.
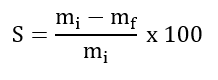
Conclusões
A partir da produção dos filmes e, posteriormente, a análise da solubilidade em água, foi possível constatar redução desta propriedade com a incorporação da cera de abelha/tensoativo em filmes de quitosana. Foi possível verificar que o aumento da cera de abelha diminuiu significativamente a solubilidade em água dos filmes produzidos em comparação com o controle. No entanto, as concentrações de tensoativo influenciaram na solubilidade quando a quantidade de cera de abelha foi menor, cerca de 1%, isto é observado nos tratamentos 4 e 8 onde a redução da solubilidade foi mínima.
Agradecimentos
Agradecemos a Universidade Rural do Semi-Árido pelo suporte técnico.
Referências
BONILLA, J.; SOBRAL, P. J. A. Investigation of the physicochemical, antimicrobial and antioxidant properties of gelatin-chitosan edible film mixed with plant ethanolic extracts. Food Bioscience, v. 16, p. 17-25, 2016.
ELGADIR, M. A.; UDDIN, M. S.; FERDOSH, S.; ADAM, A.; CHOWDHURY, A. J. K.; SARKER, Z. I. Impact of chitosan composites and chitosan nanoparticle composites on various drug delivery systems: A review. Journal of Food and Drug Analysis, v. 23, n. 4, p.619-629, 2015.
FRÁGUAS, R. M.; SIMÃO, A. A.; FARIA, P. V.; E QUEIROZ, E. R.; OLIVEIRA JUNIOR, Ê. N.; CELESTE ABREU, M. P. Preparo e caracterização de filmes comestíveis de quitosana. Polímeros, 25(número especial), p .48-53, 2015.
HROMIŠ, N. M.; LAZIĆ, V. L.; MARKOV, S. L.; VAŠTAG, Ž. G.; POPOVIĆ, S. Z.; ŠUPUT, D. Z.; POPOVIĆ, L. M. Optimization of chitosan biofilm properties by addition of caraway essential oil and beeswax. Journal of Food Engineering, 158, p. 86–93. 2015.
KLANGMUANG, P.; SOTHORNVIT, R. Combination of beeswax and nanoclay on barriers, sorption isotherm and mechanical properties of hydroxypropyl methylcellulose-based composite films. LWT - Food Science and Technology. v. 65, p. 222–227, 2016.
MIR, S. A.; DAR, B. N.; WANI, A. A.; SHAH, M. A. Effect of plant extracts on the techno-functional properties of biodegradable packaging films. Trends in Food Science & Technology, v. 80, p. 141–154, 2018.
OLIVEIRA, V. R. L.; XAVIER, T. D. N.; ARAÚJO, N. O.; ALMEIDA, J. G. L.; AROUCHA, E. M. M.; SANTOS, F. K. G.; SILVA, K. N. de O. Evaluation of Biopolymer Films of Cassava Starch with Incorporation of Clay Modified by Ionic Exchange and its Application as a Coating in a Fruit. Materials Research, v. 20, p. 758–766, 2018
SANTACRUZ, S.; RIVADENEIRA, C.; CASTRO, M. Edible films based on starch and
chitosan. Effect of starch source and concentration, plasticizer, surfactant's hydrophobic tail and mechanical treatment. Food Hydrocolloids, v. 49, p.89-94, 2015.
SANTOS, F. K. G.; SILVA, K. N. O.; XAVIER, T. D. N.; LEITE, R. H. L.; AROUCHA, E. M. M. Effect of the Addition of Carnauba Wax on Physicochemical Properties of Chitosan Films. Materials Research, 20(suppl 2), p. 479–484. 2017.
ZHU, Y.; FREE, M. L.; YI, G. Electrochemical measurement, modeling, and prediction of corrosion inhibition efficiency of ternary mixtures of homologous surfactants in salt solution. Corrosion Science, v. 98, p.417-429. 2015
ZHU, Y.; FREE, M. L.; WOOLLAM, R.; DURNIE, W. A review of surfactants as corrosion inhibitors and associated modeling. Progress In Materials Science, v. 90, p.159-223, 2017.


