Síntese de compósitos do tipo MCM-41-NH2/óxidos de ferro “verdes” como adsorventes para azocorantes: estudo cinético e isotérmico.
- Home
- Trabalhos
ÁREA
Química Ambiental
Autores
Nazar de Souza, A.P.N.S. (UERJ) ; Licea, Y. (CBPF) ; Colaço, M.V.C. (UERJ) ; Senra, J.D. (UERJ) ; Carvalho, N.M.F. (UERJ)
RESUMO
Neste trabalho, nanopartículas de óxido de ferro (FeONPs) foram preparadas a partir do precursor de Fe(III) junto ao extrato de Camellia sinensis (chá preto) e ancoradas em sílica mesoporosa (MCM-41) amino-funcionalizada. O compósito multicomponente denominado BTFe/MCM-41-NH2 foi caracterizado e aplicado na adsorção do azocorante aniônico alaranjado de metila (AM). Os resultados indicaram que esse material é 11 vezes mais adsorvente do que a MCM-41 e 2,5 vezes mais adsorvente do que MCM-41-NH2. Observou-se uma capacidade de adsorção experimental no equilíbrio de qe igual a 105,3 mg g− 1 a 298 K. Os estudos cinéticos revelaram um modelo de pseudo-primeira ordem e as isotermas de Freundlich e Temkin foram as mais adequadas para descrever a interação do adsorvente com o alaranjado de metila.
Palavras Chaves
MCM-41; CHÁ PRETO; ADSORÇÃO
Introdução
Numerosas técnicas foram adotadas para remover/tratar substâncias tóxicas contaminantes da água, tais como: processos avançados de oxidação (MATILAINEN et. al., 2010), adsorção (ANASTOPOULOS et. al., 2018), tratamentos químicos (HAYAT et. al., 2015), separação por troca iônica (RAGHU et. al., 2007), osmose reversa (UZAL et. al., 2010) e filtração em membrana (RASHIDI et. al., 2015). A maioria desses processos apresenta vantagens individuais, mas também desvantagens, como alto investimento e custo operacional (CRINI et. al., 2019). Entre os vários métodos mencionados, a adsorção é uma alternativa bem sucedida e eficiente em termos de simplicidade, baixo custo, facilidade de operação, flexibilidade e produção mínima de lodo (WU et. al., 2014). Nas últimas duas décadas, sílicas mesoporosas ordenadas foram propostas como adsorventes de contaminantes orgânicos como corantes (WU et. al., 2014). Materiais híbridos mesoporosos orgânicos-inorgânicos baseados em sílica têm sido o foco de muitos estudos, uma vez que combinam em um único sólido as características atraentes de uma estrutura porosa inorgânica (ou seja, alta área de superfície, alta porosidade, boa estabilidade mecânica) e a reatividade química dos grupamentos orgânicos (HOFFMANN et. al., 2006). A escolha do grupo organofuncional pode ajustar as propriedades do material final em relação a aplicação alvo (GOLBERT-RENAUDIN et. al., 2009). Por exemplo, uma derivatização dos mesoporos da superfície de sílica com grupos aminopropil pode aumentar a capacidade de interação com íons de metais pesados, pesticidas e corantes (WALCARIUS et. al., 2010). Outra classe de materiais que tem sido aplicada com sucesso na remediação ambiental e no tratamento de águas são as nanopartículas de óxido de ferro (FeONPs). Esses materiais são de baixo custo e ambientalmente amigáveis, além de apresentarem propriedades potenciais sobre adsorventes comuns. De acordo com o conceito de remediação verde, é obrigatório evitar danos ao meio ambiente e maximizar a eficácia da gestão dos recursos hídricos para uma economia verde. Assim, o uso de fontes naturais como extratos de plantas para preparar nanopartículas de óxidos metálicos pode fornecer novos adsorventes multifuncionais biocompatíveis através uma síntese limpa e sustentável que evita o uso e a geração de produtos químicos nocivos. Polifenóis do chá (TP), incluindo epigalocatequinas (EGC), epicatequinas galato (ECG), epicatequinas (EC), epigalocatequinas galato (EGCG), possuem grupos hidroxila fenólicos. Os TPs são agentes de quelação e redução naturais, uma fonte quase inesgotável para a preparação verde de nanomateriais versáteis (WU et. al., 2015). O principal objetivo deste trabalho é desenvolver um adsorvente verde para remover poluentes orgânicos da solução aquosa que podem ser ambientalmente seguros e com potencial para aplicação em larga escala. O alaranjado de metila foi selecionado como um corante aniônico modelo para investigar a capacidade de adsorção do material proposto. Os adsorventes foram caracterizados por difração de raios X (DRX), análise termogravimétrica (TG), fisissorção de nitrogênio (ASAP), espectroscopia no infravermelho com transformada de Fourier (FTIR) e determinação do potencial Zeta. A cinética e a isoterma de adsorção do processo foram estudadas de modo a se obter informações sobre o mecanismo de adsorção. Os ajustes dos dados experimentais de cinética e isoterma foram realizados pelas equações não-lineares através do método dos mínimos quadrados, usando diferentes funções de erro, a fim de encontrar os parâmetros otimizados pelo método da soma dos erros normalizados (SNE).
Material e métodos
Síntese de MCM-41: A MCM-41 foi sintetizada através de uma síntese clássica modificada (MONASH et. al., 2010). Foi feita a dissolução de 2,40 g de CTAB em 120 mL de água deionizada. A solução foi agitada magneticamente até que uma solução homogênea límpida fosse obtida e, em seguida, 10 mL (25% em peso) de solução aquosa de NH4OH foram gotejados. Após 10 min, 10,0 mL de TEOS foram adicionados, a solução ficou sob agitação durante 1 h à temperatura ambiente. O material foi então filtrado, abundantemente lavado com água e seco em estufa em 70 ºC, depois calcinado em uma mufla a 550 °C por 11 h em uma rampa de 3 °C min− 1 para remover o surfactante. Massa obtida: 2,47 g. Síntese de MCM-41-NH2: A sílica mesoporosa amino-funcionalizada MCM-41-NH2 foi sintetizada de acordo com o procedimento relatado na literatura (SILVEIRA et. al., 2011). A MCM-41 foi previamente ativada por aquecimento em uma mufla a 180 °C por 4 h. Então 2,2 mL de APTES foi adicionado gota a gota a uma suspensão de 2,0 g de MCM-41 sob refluxo em tolueno (34 mL), sob agitação e atmosfera de argônio. Depois de 1,5 h, uma pequena fração de tolueno contendo etanol foi destilada, seguida pela adição de 2,2 mL de APTES à suspensão. Este procedimento foi repetido três vezes. Depois que essa solução foi resfriada até temperatura ambiente, o produto resultante foi filtrado, lavado com acetona (5 x 60 mL) e diclorometano (5 x 60 mL). O sólido foi lavado em um aparelho Soxhlet com diclorometano e seco a 25 °C por 48 h. Massa obtida: 2,94 g Síntese do adsorvente BTFe /MCM-41-NH2: O extrato de Camellia sinensis foi preparado a partir de 7,20 g de folhas secas de chá em 120 mL de H2O a 80 °C sob agitação. Após 1 h, as folhas de chá foram removidas por filtração, o extrato foi separado para a próxima etapa, e, o teor total de polifenóis foi determinado através do método de Folin-Ciocalteu, sendo 43,07 mg de equivalente de ácido gálico/g da erva. Para a preparação do adsorvente BTFe/MCM-41-NH2 , 120 mL do extrato de chá preto foi adicionado gota a gota sobre uma suspensão de 2,50 g de FeCl3⋅6H2O e 1,50 g de MCM-41-NH2 em 120 mL de água deionizada. A reação foi agitada durante 1 h, filtrada e seca a 80 °C em estufa por 48 h. Massa obtida: 1,75 g. Experimentos de adsorção do corante: Os experimentos de adsorção foram investigados sob diferentes condições, incluindo: (i) a influência do tempo de contato (de 5 a 480 min), (ii) concentração inicial de corante (4,0 a 106,7 mg L− 1), (iii) dosagem de adsorvente (10,0 a 75,0 mg), (iv) temperatura (298, 313, 323 e 333 K) e (v) pH inicial (2, 4, 6, 8 e 10). O pH da solução foi ajustado pela adição de NH4OH ou HNO3 e monitorado por um medidor de pH (Metrohm - 827). As alíquotas foram coletadas por uma seringa de vidro, filtradas através de filtro PFTE de membrana 0,45 µm e analisadas por espectroscopia UV-VIS.
Resultado e discussão
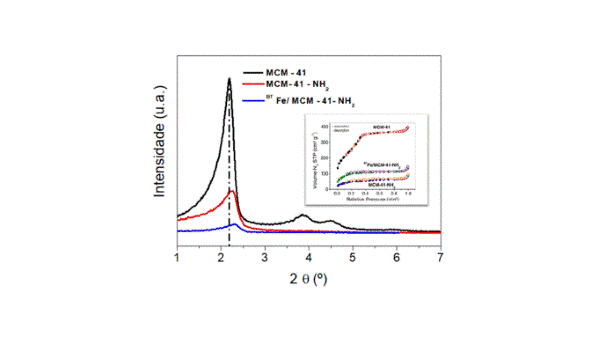
Os perfis de DRX de baixo ângulo dos materiais preparados mostraram a MCM-41
pura com três picos de difração correspondentes aos planos de reflexão (100),
(110) e (200), atribuídos ao alto empacotamento hexagonal 2D ordenado, típico da
sílica MCM-41 (grupo espacial P6mm). Os picos de difração são bem resolvidos,
indicando que a estrutura é altamente ordenada. Contudo, o padrão de DRX da MCM-
41-NH2 mostra que o plano de reflexão principal (100) da MCM-41 está presente,
no entanto, a intensidade diminuiu. Além disso, o desaparecimento de outros
picos pode ser causado pela impregnação dos grupos propilamina nos poros e
canais da MCM-41, diminuindo sua ordenação, conforme sugerido na literatura. A
alta densidade de grupos amino na superfície da sílica também pode interferir a
difração dos raios X, porém, ainda preserva a estrutura interna do material. O
DRX do material BTFe/MCM-41-NH2 mostra uma diminuição mais pronunciada na
intensidade do pico e uma mudança na posição do pico de (100), com ausência dos
picos secundários (110) e (200), indicando mudanças ainda mais drásticas na
estrutura dos poros, como mostrado na Fig. 1.
A isoterma de fisissorção de nitrogênio dos materiais: MCM-41, MCM-41-NH2 e
BTFe/MCM-41-NH2, corresponde a uma típica isoterma tipo IV, característica de um
material mesoporoso com formato cilíndrico ou mesoporos cônicos, misturados com
uma isoterma do tipo II típica de materiais não porosos ou macroporosos, com
poros maiores do que o mesoporo devido a não horizontalidade próxima a p/p0 = 1
(THOMMES et. al., 2015). Além disso, enquanto a MCM-41 apresentava área de
superfície BET de SBET = 940,4 m2 g− 1, a modificação com grupos amino afetou
drasticamente suas propriedades texturais, baixando o SBET para 192,8 m2 g− 1 e
para o material BTFe/MCM-41-NH2, o SBET aumentou para 381,6 m2 g− 1. Esses
resultados indicaram que a incorporação de FeONPs-TP criou novos poros no
material, aumentando sua área.
Curvas termogravimétricas para a MCM-41 pura mostram uma pequena perda de massa,
8,3% em peso, representativa da perda de água. Os materiais funcionalizados, por
outro lado, mostraram mudanças mais significativas, para MCM-41-NH2 15,6 em peso
%, 12,6% em peso e 1,6% em peso foram perdidos na região I, II e III,
respectivamente, totalizando 14,2% em peso de compostos orgânicos, enquanto
BTFe/MCM-41-NH2 apresentou perdas de 5,3, 16,4 e 9,5% em peso nas regiões I, II
e III, respectivamente, totalizando 25,9% em peso. Esses resultados indicam que
o APTES e TP foram incorporados ao adsorvente.
A fim de medir a carga superficial e a estabilidade coloidal, o potencial zeta
ξ, dos materiais foi avaliado. O valor de ξ foi negativo em quase toda a faixa
de pH, indicando boa estabilidade de dispersão. Esta tendência continuou até que
ξ se tornou positivo em pH 1.9, o IEP (ponto isoelétrico). Uma mudança suave
para um potencial menos negativo com diminuição do pH sugere um caráter aniônico
apreciável na superfície do nanomaterial. Em nosso caso, é concebível que as
propriedades eletrocinéticas superficiais envolvendo o amplo potencial zeta
negativo em ambiente ácido se devam aos grupos silanol desprotonados com
diferentes valores de pKa juntamente com grupos fenólicos do extrato de chá
preto carregado na superfície do nanocompósito. A cobertura da superfície
fenólica foi previamente confirmada pelas medições FTIR. No entanto, a mudança
para +15 mV a pH 1,0 indica a protonação dos grupos aminopropil funcionalizados
na MCM-41. Os potenciais zeta inerentes avaliados sem ajustes de pH da MCM-41 (-
0,78 mV), MCM-41-NH2 (+6,99 mV) e BTFe/MCM-41-NH2 (- 2,63 mV) em água deionizada
também confirmam a possível influência de grupos silanóis e polifenóis.
Como as condições experimentais dos testes de adsorção têm uma forte influência
no desempenho dos materiais, foi realizada triagem dos parâmetros: dosagem do
adsorvente, pH, tempo de equilíbrio, concentração inicial do corante e
temperatura, para o material mais promissor, BTFe/MCM 41-NH2 e com as melhores
condições foi feito ajuste cinético e isotérmico dos dados experimentais, como
segue:
A capacidade de adsorção dos diferentes materiais preparados foi avaliada em
relação ao corante aniônico Alaranjado de metila (AM), de acordo com a
porcentagem de descoloração e a capacidade de adsorção em equilíbrio, qe, nas
condições experimentais: 100,0 mL de solução de AM 19,3 mg L− 1, 25,0 mg do
adsorvente, a 25 °C e pH 4,5, essas foram as melhores condições estudadas.
Os resultados mostraram a maior capacidade de adsorção de BTFe/MCM-41-NH2 com qe
= 65,0 mg g− 1, 11 vezes maior do que MCM-41 (qe = 5,9 mg g− 1) e 2,4 maior do
que MCM-41-NH2 (qe= 27,5 mg g− 1). Além disso, o material BTFe / MCM-41
preparado para os testes de adsorção de controle mostrou um baixo qe = 1,9 mg g−
1, provando a importância das propriedades combinadas da sílica MCM-41
mesoporosa, os grupos amino e os FeONPs verdes para a adsorção bem-sucedida do
AM. Embora a MCM-41 apresente a maior área superfícial e maiores volumes dos
mesoporos, a interação favorecida do AM com os sites de adsorção introduzidos
são mais determinantes para a adsorção.
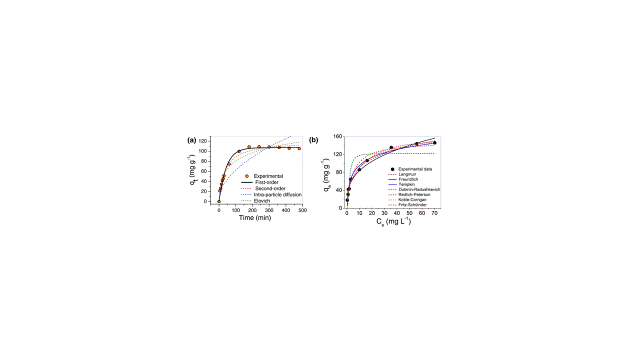
A curva de capacidade de adsorção em função do tempo de adsorção do AM em
BTFe/MCM-41-NH2 é mostrada na Fig. 2(a), onde o equilíbrio foi alcançado em 240
min, um tempo viável para aplicações práticas. Para estudar o mecanismo do
processo de adsorção, os dados experimentais foram ajustados pelas equações não-
lineares de pseudo-primeira ordem, pseudo-segunda ordem, difusão intrapartícula
e modelos de Elovich.
Diferentes trabalhos na literatura mostram que o ajuste não-linear é mais
confiável do que o ajuste linear para ajustar os dados cinéticos e isotérmicos,
porque acumula menos erros estatísticos (MOUSSANT et. al., 2018). O método de
mínimos quadrados foi usado para prever as equações cinéticas otimizadas, que
envolve a etapa de minimizar a distribuição de erro entre os dados experimentais
e o modelo previsto (RAJI et. al., 2015). As funções de erro empregadas neste
estudo são: R2, χ2, RMSE, ARE, SER, MPSD, ERRSQ e HÍBRIDO. Depois de computar as
funções de erro para cada modelo cinético, usando o add in Solver do software
Excel, a soma dos erros normalizados (SNE) foram calculados, a isoterma ótima
foi reconhecida como o modelo com o menor SNE.
O modelo de pseudo-primeira ordem forneceu o menor SNE sendo o modelo mais
confiável para descrever os dados, indicando uma adsorção controlada por reação,
ou seja, o processo de quimissorção é favorecido. Valores calculados da
capacidade de adsorção em equilíbrio para o modelo de pseudo-primeira ordem, qe,
calc= 106,5 mg g− 1, está muito perto do valor experimental qe, exp = 105,3 mg
g− 1, uma diferença de cerca de 1%, enquanto para o qe de segunda ordem, qe, exp
= 120,0 mg g− 1 difere em 12%, portanto, corrobora a boa adequação do modelo de
primeira ordem para descrever a adsorção de AM por BTFe/MCM-41-NH2. A difusão
intrapartícula e os modelos de Elovich não descreveram adequadamente os dados
cinéticos.
Vários modelos de isotermas de adsorção são usados para analisar parâmetros
experimentais e para descrever a capacidade máxima teórica de adsorção, o
mecanismo, o tipo de sorção e formação de monocamada ou de multicamadas, por
exemplo (RAJI et. al., 2015). Para este trabalho, Langmuir, Freundlich, Temkin,
Dubinin-Radushkevich (D-R), Redlich-Peterson (R-P), Koble-Corrigan (KC) e Fritz-
Schülnder (F-S) foram usados para ajustar os dados experimentais, como mostrado
na Fig. 2(b).
Para Langmuir, Freundlich, Temkin e R-P, o menor SNE foram fornecidos por χ2 e
HYBRID, para D-R o menor erro foi obtido para χ2 e para K-C e F-S MPSD
proporcionou o menor SNE.
Freundlich e Temkin foram as isotermas mais adequadas para descrever a interação
do composto final com o corante selecionado. Este resultado está de acordo com
os diferentes locais de adsorção presentes no material BTFe/MCM-41-NH2, tais
como, superfície porosa da sílica, grupos amino, FeONPs e TP.
Conclusões
Um composto multicomponente foi desenvolvido a partir de óxidos de ferro verdes preparados a partir de Fe(III) e extrato de Camellia sinensis. O óxido de ferro foi ancorado na sílica mesoporosa MCM-41 funcionalizada com grupos amino e usado como adsorvente para remoção de um corante modelo aniônico. A capacidade de adsorção superior do compósito em relação aos componentes individuais mostra que vários sítios de adsorção atuam na interação com o corante, tais como, grupos amino, superfície da sílica e seus poros, os óxidos de ferro com a presença de polifenóis, esses sítios em pH ácido efetivamente interagem com o corante aniônico. Além disso, os compostos de TP aumentaram a afinidade de ligação por meio de interações π-π com os anéis aromáticos do chá e do corante. A dinâmica do processo de equilíbrio foi investigada através da cinética e modelos de isoterma. Uma reação controlada pelo modelo de pseudo-primeira ordem foi encontrada e os melhores ajustes da isoterma foram feitos pelos modelos de Freundlich e Temkin, indicando uma adsorção favorecida por multicamadas através de uma superfície heterogênea. Uma capacidade máxima de adsorção de 154,2 mg g-1 foi observada em 298 K. Os dados relatados mostram as propriedades de adsorção promissoras desse compósito multicomponente preparado através de uma abordagem verde que reúne diferentes grupos que podem atuar como sítios de adsorção e interagir com o corante estudado.
Agradecimentos
Este trabalho foi apoiado pelo CNPq [PQ-2/2018], FAPERJ [JCNE 2018:E-26 / 203.023 / 2018; Emergentes: E-26 / 010.002171 / 2019] e CAPES - [PROAP].
Referências
ANASTOPOULOS, I., HOSSEINI-BANDEGHARAEI, A., FU, J., MITROPOULOS, A.C., KYZAS, G.Z. Use of nanoparticles for dye adsorption: review. J. Dispers. Sci. Technol., [s. l.], v. 39, p. 836–847, 2018. Disponível em: <https://doi.org/10.1080/01932691.2017.1398661>.
CRINI, G., LICHTFOUSE, E. Advantages and disadvantages of techniques used for wastewater treatment. Environ. Chem. Lett., [s. l.], v. 17, p. 145–155, 2019. Disponível em: < https://doi.org/ 10.1007/s10311-018-0785-9>.
GOUBERT-RENAUDIN, S., GASLAIN, F., MARICHAL, C., LEBEAU, B., SCHNEIDER, R., WALCARIUS, A. Synthesis of dithiocarbamate-functionalized mesoporous silica-based materials: interest of one-step grafting. New J. Chem., [s. l.], v. 33, p. 528–537, 2009. Disponível em: <https:// doi.org/10.1039/b811780b>.
HAYAT, H., MAHMOOD, Q., PERVEZ, A., BHATTI, Z.A., BAIG, S.A. Comparative decolorization of dyes in textile wastewater using biological and chemical treatment. Sep. Purif. Technol., [s. l.], v. 154, p. 149–153, 2015. Disponível em:< https://doi.org/10.1016/j. seppur.2015.09.025>.
HOFFMANN, F., CORNELIUS, M., MORELL, J., FROBA, M. Silica-based mesoporous organic-inorganic hybrid materials. Angew. Chem. Int., [s. l.], v.4, p.3216–3251, 2006. Disponível em: <https://doi.org/10.1002/anie.200503075>.
MATILAINEN, A., SILLANP, M. Removal of natural organic matter from drinking water by advanced oxidation processes. Chemosphere, [s. l.], v. 80, p. 351–365, 2010. Disponível em: <https:// doi.org/10.1016/j.chemosphere.2010.04.067>.
MONASH, P., PUGAZHENTHI, G. Investigation of equilibrium and kinetic parameters of methylene blue adsorption onto MCM-41. Korean J. Chem. Eng., [s. l.], v. 27, p. 1184–1191, 2010. Disponível em: < https://doi.org/10.1007/s11814-010-0177-8>.
MOUSSOUT, H., AHLAFI, H., AAZZA, M., KARBALA, H.M. Critical of linear and nonlinear equations of pseudo-first order and pseudo-second order kinetic models. Int. J. Mod. Sci., [s. l.], v. 4 , p. 244–254, 2018. Disponível em: <https://doi.org/10.1016/j.kijoms.2018.04.001>.
RAGHU, S., BASHA, C.A. Chemical or electrochemical techniques, followed by ion exchange, for recycle of textile dye wastewater. J. Hazard. Mater., [s. l.], v. 149, p. 324–330, 2007. Disponível em: <https://doi.org/10.1016/j.jhazmat.2007.03.087>.
RAJI, F., SARAEIAN, A., PAKIZEH, M., ATTARZADEH, F. Removal of Pb (II) from aqueous solution by mesoporous silica MCM-41 modified by ZnCl2: kinetics, thermodynamics, and isotherms. RSC Adv., [s. l.], v. 5, p. 37066–37077, 2015. Disponível em: < https://doi. org/10.1039/c5ra01192b.>
RASHIDI, H.R., SULAIMAN, N.M.N. , HASHIM, N.A. , HASSAN, C.R.C. , RAMLI, M.R. Synthetic reactive dye wastewater treatment by using nano-membrane filtration. Desalination Water Treat., [s. l.], v. 55, p. 86–95, 2015. Disponível em: < https://doi.org/10.1080/ 19443994.2014.912964>.
SILVEIRA, G.Q. , RONCONI, C.M. , VARGAS, M.D., GIL, R.A.S.S., MAGALHAES, A. Modified silica nanoparticles with an aminonaphthoquinone. J. Braz. Chem. Soc., [s. l.], v. 22,p. 961–967, 2011. Disponível em: < https://doi.org/10.1590/S0103-50532011000500021>.
THOMMES, M., KANEKO, K., NEIMARK, A.V., OLIVIER, J.P., RODRIGUEZ-REINOSO, F., ROUQUEROL, J., SING, K.S.W. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report). Pure Appl. Chem., [s. l.], v. 87, p.1051–1069, 2015. Disponível em: <https://doi.org/10.1515/pac-2014-1117>.
UZAL, N. YILMAZ, L., YETIS, U. Nanofiltration and reverse osmosis for reuse of indigo dye rinsing Waters. Sep. Sci. Technol., [s. l.], v. 45, p. 331–338, (2010). Disponível em: <https://doi.org/ 10.1080/01496390903484818>.
WALCARIUS, A., MERCIER, L. Mesoporous organosilica adsorbents: nanoengineered materials for removal of organic and inorganic pollutants. J. Mater. Chem., [s. l.], v. 20, p. 4478–4511, 2010. Disponível em: <https://doi.org/10.1039/B924316J>.
WU, W., WU, Z., YU, T., JIANG, C., KIM, W.S. Recent progress on magnetic iron oxide nanoparticles: synthesis, surface functional strategies and biomedical applications. Sci. Technol. Adv. Mater., [s. l.], v. 16, p. 023501, 2015. Disponível em: <https://doi.org/10.1088/1468- 6996/16/2/023501>.
WU, Y., ZHANG, M., ZHAO, H., YANG, S., ARKIN, A. Functionalized mesoporous silica material and anionic dye adsorption: MCM-41 incorporated with amine groups for competitive adsorption of Acid Fuchsine and Acid Orange II. RSC Adv., [s. l.], v. 4, p. 61256–61267, 2014. Disponível em: <https://doi.org/10.1039/c4ra11737a>.


