ADSORÇÃO DE Ni(II) UTILIZANDO CARVÃO ATIVADO PREPARADO A PARTIR DE SABUGO DE MILHO COMO ADSORVENTE
- Home
- Trabalhos
ÁREA
Química Ambiental
Autores
Guedes, G.A.J.C. (IC-UFPE) ; Campos, N.F. (UFPE) ; Oliveira, L.P.S. (UFPE) ; Gama, B.M.V. (UFPE) ; Duarte, M.M.M.B. (UFPE)
RESUMO
O objetivo deste trabalho foi avaliar a adsorção de Ni2+ utilizando carvão ativado preparado a partir de sabugo de milho como adsorvente. Para tanto, foram realizados estudos acerca do pH inicial da solução, cinética e de equilíbrio de adsorção. O pH que apresentou maior capacidade adsortiva foi 4. A cinética foi rápida, atingindo o equilibro em 100 minutos e o modelo de pseudo-segunda ordem foi o que melhor se ajustou aos dados experimentais. No equilíbrio, o modelo que melhor se ajustou foi o de Sips com capacidade máxima adsortiva de 0,57 mmol·g-1 (33,45 mg·g-1). O adsorvente preparado apresentou potencial técnico para remover o Ni2+ em solução aquosa.
Palavras Chaves
adsorção; níquel; sabugo de milho
Introdução
Devido aos impactos causados pela ação antrópica, principalmente após a Revolução Industrial, o descarte de materiais sem o devido tratamento em corpos receptores é uma das principais fontes de poluição. A situação cada vez mais crítica leva a um aumento na preocupação do homem com os efeitos da poluição ambiental (JOSEPH et al, 2019). Presente em indústrias galvânicas, metais como o níquel apresentam grave impacto no ambiente, pois não são biodegradáveis e apresentam a capacidade de se acumular em tecidos de seres vivos, sendo este efeito prejudicial à saúde, uma vez que a exposição ao Ni2+, pode levar a câncer nos ossos, nariz e pulmões (BAI; VENKATESWARLU, 2018). O níquel trata-se de um metal dúctil com alta condutividade térmica e elétrica, presente naturalmente na crosta terrestre na forma de óxidos ou sulfetos, sendo um nutriente essencial para certos microorganismos e plantas. Apesar disto, sua presença em altas concentrações resulta na inibição de atividades enzimáticas de plantas, além de apresentar efeitos tóxicos a seres vivos, sendo a ingestão por meio de água ou alimentos a principal forma de contaminação (GENCHI et al, 2020). Tendo em vista estes efeitos danosos, faz-se necessária a remoção destes metais de águas residuais, de modo a respeitar os limites estabelecidos para descarte destes contaminantes em corpos receptores. No Brasil, o Conselho Nacional do Meio Ambiente, através da Resolução CONAMA n° 430/2011 estabelece como limite máximo para o Ni2+ de 2 mg·L-1 (BRASIL, 2011). Dentre as técnicas de tratamento utilizadas para remover Ni2+ presente em águas residuais, tem-se a adsorção, que se trata de um fenômeno de superfície no qual uma fase líquida, que contém as espécies químicas que se quer adsorver (adsorvatos) estão em contato com uma fase sólida, representada por um material (adsorvente) ao qual os adsorvatos irão se aderir (CHIOU, 2002). Esta técnica se sobressai por ser um método de fácil operação, além de permitir o uso de resíduos agroindustriais como adsorventes, que podem ser usados como precursores na preparação de carvão ativado, reinserindo assim estes resíduos na cadeia produtiva e também dando uma boa finalidade no ponto de vista ambiental, uma vez que está sendo utilizado um resíduo para tratar outro (GAMA et al, 2018). O sabugo de milho trata-se de um resíduo agroindustrial que representa cerca um terço da safra do milho, sendo este material utilizado de forma alternativa como fonte de alimento para ruminantes. Contudo, apresenta produção maior que o consumo, o que resulta no descarte inadequado deste material, sendo então seu uso no preparo de carvão ativado uma alternativa viável (MARIÑO;CYPRIANO;TASIC, 2021). No intuito de se obter um processo adsortivo eficiente, deve-se avaliar diferentes fatores que influenciam a adsorção, entre eles estão: superfície do adsorvente, o efeito do pH inicial da solução, cinética de adsorção e estudos de equilíbrio (RATAN;KAUR;ADIRAJU, 2018). Com relação a superfície do adsorvente, podem ser realizadas modificações na biomassa por meio de tratamentos químicos e físicos, que ocasionam mudanças nos grupos funcionais presentes na superfície do adsorvente. A cinética de adsorção envolve a taxa de adsorção do adsorvato do fluido em determinado intervalo de tempo, até ser atingido o equilíbrio. Já o equilíbrio de adsorção fornece informações acerca da interação adsorvente-adsorvato, por meio da análise das isotermas (NASCIMENTO et al, 2014). Desse modo, o objetivo deste trabalho foi avaliar a eficiência a remoção do íon Ni2+ de solução aquosa utilizando carvão ativado preparado a partir de sabugo de milho, de modo a agregar valor a esse resíduo.
Material e métodos
O sabugo de milho foi lavado em água corrente e seco em estufa (marca Splabor, modelo SP-100A) a 105°C por 16 horas. Em seguida foi ativado com H3PO4 (Vetec, 85%), na proporção de 5:3 (m/v) a 110°C por 16 h. A carbonização ocorreu em mufla (Quimis) a 500°C por 1 h. O carvão ativado (CA) foi lavado com NaHCO3 1% (Fmaia) e água destilada para remoção do ácido residual e em seguida seco em estufa por 1 h a 60°C. O CA foi classificado em série de peneiras de Tyler na granulometria de 0,2- 1,0 mm. A solução estoque de 10 mmol·L-1 de Ni2+ foi preparada a partir do Ni(NO3)2·6H20 (Vetec, 97%) e as soluções de trabalho foram obtidas por diluição dessa. Os teores do Ni2+ foram quantificados no Espectrômetro de Absorção Atômica de Chama (Varian, AA240 FS) no comprimento de onda de 341,5 nm. Curva analítica com faixa linear de 0,05 a 1,25 mmol·L-1 foi construída com limite de detecção de 0,046 mmol·L-1, limite de quantificação de 0,065 mmol·L-1, coeficiente de correlação (r) igual a e coeficiente de variância (CV) igual a 4,6%. Os valores obtidos para r > 0,99 e CV < 5% indicaram bom ajuste linear do método, segundo Montgomery (2012). Utilizando o software Hydra & Medusa, desenvolvido por Puigdomenech (2004), foi obtido diagrama de equilíbrio químico para o íon Ni2+ a uma concentração de 1 mmol·L-1, sendo esta avaliação realizada no intuito de evitar trabalhar em região de precipitação dos metais, avaliando-se assim apenas o processo adsortivo. Já o estudo da influência do pH inicial foi realizado utilizando 0,1 g do carvão ativado que permaneceu em contato com 50 mL da solução de 1 mmol·L-1, durante 6 horas sob agitação constante a 300 rpm. Ao final, as amostras foram filtradas e os teores do metal quantificados antes e após cada experimento. Para garantir a avaliação apenas do processo adsortivo, foram também realizados ensaios nas mesmas condições sem o adsorvente. Os ensaios cinéticos foram realizados utilizando 0,1 g do CA em 50 mL da solução de Ni2+ de 1,25 mmol·L-1, 300 rpm no intervalo de tempo de 3 a 480 min a 303K, definidos em estudos anteriores. Para representação do comportamento cinético foram usados os modelos de pseudo-primeira ordem (PPO) e pseudo- segunda ordem (PSO). O estudo de equilíbrio foi realizado utilizando 0,1 g do CA em 50 mL da solução de Ni2+ nas concentrações de 0,10 a 2,00 mmol·L-1, 300 rpm por 16 h a 303K. Aos dados experimentais foram aplicados os modelos de Langmuir, Freundlich e Sips.
Resultado e discussão
No intuito de estudar a influência do pH inicial da solução no processo
adsortivo, inicialmente foi verificada a região de precipitação dos metais a
partir do diagrama de especiação química para o Ni2+, em seguida
foi realizado estudo variando o pH inicial da solução (Figura 1).
Analisando a Figura 1A, torna-se possível verificar que ocorre
precipitação a partir de pH 7, uma vez que é observada a formação de
hidróxido de níquel (II). Desta forma, no intuito de assegurar que a redução
da concentração inicial estará associada apenas ao processo adsortivo e não
de precipitação química, foi determinada a faixa de trabalho de 2 a 7 para o
estudo do efeito do pH inicial da solução, apresentado na Figura 1B.
Para o estudo do efeito do pH inicial da solução, foram realizados ensaios
com adsorvente (símbolos em azul) e sem adsorvente (símbolos vermelhos) de
concentração inicial 1 mmol·L-1 (símbolo preto). Sendo assim, por
meio da Figura 1C constatou-se que a maior capacidade adsortiva foi obtida
para pH inicial da solução igual a 4. O resultado obtido foi adotado para
realização dos estudos cinético e de equilíbrio, no intuito de favorecer o
processo adsortivo.
A evolução cinética, o comportamento do equilíbrio de adsorção do Ni2+
pelo carvão ativado de sabugo de milho, bem como os ajuste dos
modelos avaliados aos dados experimentais e seus parâmetros calculados
através do software Origin 8.0, estão apresentados na Figura 2.
Com base na Figura 2A, a adsorção do Ni2+ foi rápida nos
primeiros minutos, com a maior parte da remoção ocorrendo até 60 minutos,
devido a quantidade de sítios disponíveis no estágio inicial. O equilíbrio
do sistema é atingido após 100 minutos, para capacidade adsortiva (q) igual
a 0,27 mmol·g-1.
Já na Figura 2B, são apresentados os parâmetros dos modelos cinéticos,
sendo observado que o modelo que melhor se ajustou foi o de PSO, uma vez que
apresenta maior coeficiente de regressão linear (R2) e menor qui-
quadrado reduzido (Sr2), sugerindo que o termo de velocidade de
reação k depende da quantidade de soluto adsorvido na superfície do
adsorvente e da quantidade adsorvida no equilíbrio, onde a força motriz, é
proporcional a fração disponível de sítios ativos conforme Ho (2006).
Resultados semelhantes foram obtidos por Pahlavanzadeh e Motamedi (2020),
que utilizaram zeólito modificado como adsorvente para remoção de Ni2+
, obtendo assim um modelo de PSO, apresentando um R² igual a 0,997.
Com relação ao estudo de equilíbrio, a isoterma de adsorção e o ajuste aos
modelos para a remoção de Ni2+ utilizando o CA estão apresentados
na Figura 2C. A isoterma, segundo Giles et al, (1960), é do tipo H e
subtipo 2, o que indica uma alta afinidade do CA com o Ni2+. A Figura 2D
mostra os parâmetros obtidos para os modelos de isoterma de Langmuir,
Freundlich e Sips, e pode-se observar que o modelo de Sips apresentou melhor
ajuste (maior R2 e menor Sr2). Sua maior eficiência
em representar os dados experimentais sugere que o carvão ativado possui
superfície heterogênea, com fator de heterogeneidade (nS)
igual a 0,3.
Resultados semelhantes foram obtidos por Neris et al, (2019) que
utilizaram fibra da planta jacinto de água modificada com NaOH para remover
Ni2+, os autores constaram que o modelo de Sips apresentou melhor
ajuste com qmáx igual 0,38 mmol·g-1.
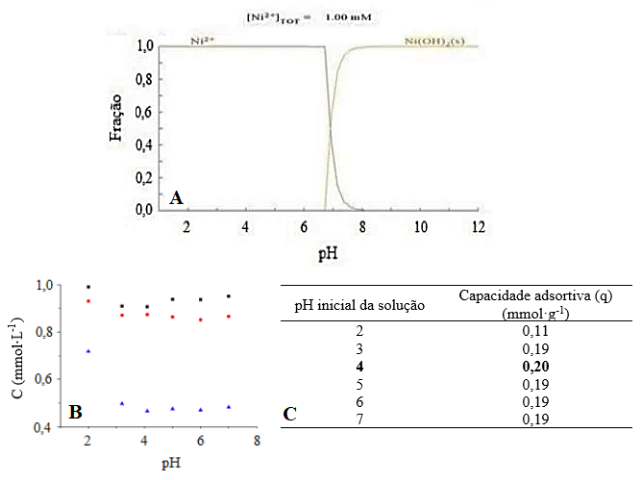
Diagrama de equilíbrio (A), avaliação da concentração da solução em função do pH inicial (B) e valores obtidos para a capacidade adsortiva pH 2-7 (C)
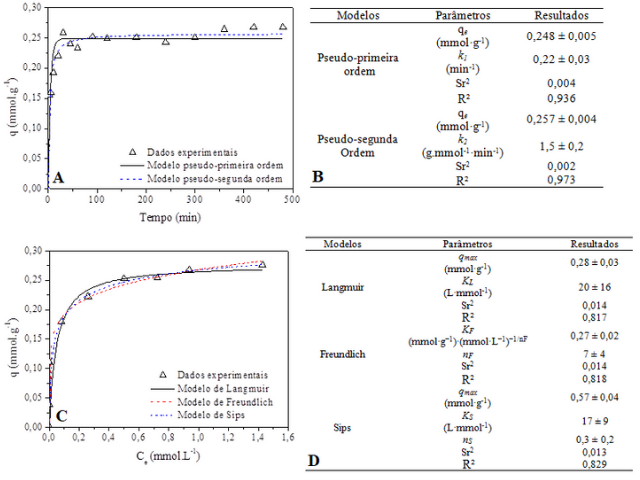
Evolução cinética e ajuste dos modelos (A), parâmetros dos modelos de PPO e PSO (B), ajuste dos modelos de equilíbrio (C) e parâmetros calculados (D)
Conclusões
Em relação ao efeito do pH inicial da solução do íon Ni2+ foi observada maior capacidade adsortiva para pH igual a 4, sendo válido ressaltar que este valor está abaixo da faixa de precipitação. O equilíbrio do processo foi rápido e atingido nos primeiros 100 minutos e o modelo que melhor descreveu o processo foi de pseudo-segunda ordem, indicando assim que se trata de uma pseudo-reação química na qual a velocidade pode ser determinada pela equação de velocidade de reação de segunda ordem. Já o estudo de equilíbrio indica que o adsorvente possui superfície heterogênea, apresentando capacidade máxima adsortiva igual a 0,57 mmol·g-1 (33,45 mg·g-1). Sendo assim, através dos estudos realizados, tem-se que a utilização do carvão ativado do sabugo de milho como adsorvente foi satisfatório para remoção de Ni2+ em solução aquosa. Vale ressaltar que o precursor do adsorvente se trata de um resíduo abundante e sem valor comercial.
Agradecimentos
Ao PIBIC/UFPE/CNPq, ao LEAQ/UFPE, ao NUQAAPE (FACEPE, processo APQ-0346- 1.06/14) e a FADE/UFPE.
Referências
BAI M.T., VENKATESWARLU P. Fixed bed and batch studies on biosorption of lead using Sargassum Tenerrimum powder: Characterization, Kinetics and Thermodynamics. Materials. Today Proceedings, v.5, 18024–18037, 2018.
BRASIL. Ministério do Meio Ambiente. Resolução nº 430, de 13 de maio de 2011. Conselho Nacional do Meio Ambiente (CONAMA), Brasília, DF, 2011.
CHIOU, C. T. Partition and adsorption of Organic Contaminants in Environmental Systems. 1ª ed. John Wiley & Sons, Inc., 2002. p. 39-52.
GAMA, B. M. V.; NASCIMENTO, G. E.; SALES, D. C. S.; RODRÍGUEZ-DÍAZ, J. M.;BARBOSA, C. M. B. M.; DUARTE, M. M. M. B. Mono and binary component adsorption of phenol and cadmium using adsorbent derived from peanut shells. Journal of Cleaner Reduction, v. 201, 219-228, 2018.
GENCHI, G.; CAROCCI, A.; LAURIA, G.; SINICROPI, M.F.; CATALANO, A. Nickel: Human Health and Environmental Toxicology. International Journal of Environmental Research and Public Health, v. 17, 679, 2020. Doi: 10.3390/ijerph17030679.
GILES, C.H.; MACEWAN, T.H.; NAKHWA, S.N.; SMITH, D. Studies in Adsorption. Part XI. A system of classification of solution adsorption isotherms, and its use in diagnosis of adsorption mechanisms and in measurement of specific surface areas of solids. Journal of Chemical Society, v.14, 3973-3993, 1960.
HO, Y-S. Review of second-order models for adsorption systems. Journal of Hazardous Materials, v. 136, 681-689, 2006.
JOSEPH, L.; JUN, B.; FLORA, J. R.V.; PARK, C.M. Removal of heavy metals from water sourcers in the developing world using low-cost materials: a review. Chemosphere, v. 229, 142-159, 2019.
MARIÑO, M.A.; CYPRIANO, D.; TASIC, L. Agroindustry residues as a source for cellulose nanofibers production. Journal of the Brazilian Chemical Society, v. 32(4), 878-888, 2021.
MONTGOMERY DC, Introdução ao controle estatístico da qualidade. Rio de Janeiro: LTC, 2012.
NASCIMENTO, R.F.; DE LIMA, A.C.A.; VIDAL, C.B.; MELO, D.Q.; RAULINO, G.S.C. Adsorção – aspectos teóricos e aplicações ambientais. 1ª ed. Fortaleza: Imprensa Universitária, 2014. p.13-54.
NERIS JB, LUZARDO F.HM, SANTOS PF, ALMEIDA ON, VELASCO FG, Evaluation of single and tri-element adsorption of Pb2+, Ni2+ and Zn2+ ions in aqueous solution on modified water hyacinth (Eichhornia crassipes) fibers. J. Environ. Chem. Eng, v. 7, 2019.
PAHLAVANZADEH, H.; MOTAMEDI, M.; Adsorption of nickel, Ni (II), in aqueous solution by modified zeolite as a cation-exchange adsorbent. Journal of Chemical Engineering Data, v.65, 185-197, 2020.
PUIGDOMENECH, I. HYDRA: Hydrochemical equilibrium-constant database. Inorganic Chemistry Software: Royal Institute of Tecnology, Estocolmo, 2004.
RATAN, J. K.; KAUR, M.; ADIRAJU, B. Synthesis of activated carbon from agricultural waste using a simple method: characterization, parametric and isotherms study. Materials Today: Proceedings, v.5, 3334-3345, 2018.


