ESTUDOS CINÉTICO E DE EQUILÍBRIO DE ADSORÇÃO DE Mn(II) USANDO CARVÃO ATIVADO PREPARADO A PARTIR DE RESÍDUO AGROINDUSTRIAL
- Home
- Trabalhos
ÁREA
Química Ambiental
Autores
Guedes, G.A.J.C. (IC-UFPE) ; Campos, N.F. (UFPE) ; Duarte, M.M.M.B. (UFPE)
RESUMO
O trabalho tem como objetivo avaliar a aplicação de sabugo de milho como precursor na preparação de carvão ativado a ser utilizado como adsorvente na remoção de Mn2+ de soluções aquosas, a partir da avaliação da cinética e do equilíbrio de adsorção. A cinética atingiu equilíbrio em 180 minutos, sendo o modelo de pseudo-segunda ordem melhor ajustado aos dados experimentais. O estudo de equilíbrio indicou que o modelo que melhor se ajustou foi o de Sips, com capacidade máxima adsortiva igual a 0,22 mmol·g-1 (12,1 mg·g-1), sendo verificado que o adsorvente apresentou resultado satisfatório na remoção do íon metálico em questão.
Palavras Chaves
adsorção; manganês; resíduo agroindustrial
Introdução
A adsorção trata-se de um processo de separação no qual ocorre o contato entre um material sólido, em geral poroso chamado de adsorvente, que é responsável por remover certas substâncias (adsorvatos) de determinado fluido (PETROVIC et al, 2017). Este método em geral é utilizado para a remoção de contaminantes presentes em águas residuais, como é o caso de metais traço como o manganês. O manganês é encontrado naturalmente em diferentes tipos de rochas e no solo, sendo o Brasil um dos países mais rico em depósitos de manganês ao redor do globo, sendo a indústria de mineração a principal fonte de contaminação de águas residuais por Mn2+, alterando as propriedades organolépticas (RÖLLIN; NOGUEIRA, 2011). Vale ressaltar que a presença de Mn2+ em água pode resultar também em danos a plantas, microorganismos e à saúde humana, devido ao efeito de biomagnificação, no qual o metal tem acúmulo progressivo ao longo da teia alimentar, estando presente em maiores concentrações em níveis tróficos mais elevados, o que pode levar a danos no sistema nervoso humano causando demência e perda da coordenação motora (LI et al, 2020). Tendo isto em vista, o Conselho Nacional do Meio Ambiente (CONAMA) cria resoluções para estabelecer critérios e padrões para proteção ambiental. Sendo assim, por meio da Resolução CONAMA n° 430 de 13 de maio de 2011, são determinados limites máximos para lançamento de efluentes em corpos receptores, sendo o valor máximo de manganês dissolvido permitido de 1,0 mg·L-1 (BRASIL, 2011). Devido a necessidade de remoção íons metálicos de meios aquosos, diferentes técnicas têm sido estudadas como uma alternativa, entre elas estão: método eletroquímico (KAZEMINEZHAD; MOSIVAND, 2017), troca iônica (BASHIRet al, 2019), precipitação química (POHL, 2020), adsorção (ZHANG et al, 2020) e filtragem por membrana (ZAIDAN et al, 2021). Dentre estas métodos, a adsorção é uma alternativa simples, e se destaca por ser um método de fácil operação, eficiente e que também permite a regeneração e reutilização do adsorvente (BONILLA- PETRICIOLET et al, 2019), sendo necessário avaliar os fatores que influenciam no intuito de obter um processo mais eficiente, entre eles tem- se a cinética e o equilíbrio de adsorção (NASCIMENTO et al, 2014). Dentre os adsorventes, o mais utilizado é o carvão ativado, uma vez que apresenta uma grande área superficial e estrutura interna bem desenvolvida. No intuito de verificar fontes alternativas para a preparação de carvão ativado a ser utilizado em processos adsortivos, pesquisadores propuseram o uso de resíduos agroindustriais como forma de reduzir os custos de produção e dar utilidade a estes materiais, reinserindo-os na cadeia produtiva e simplificando a produção do carvão ativado (NASCIMENTO et al, 2014). Como exemplo de resíduos agroindustriais que já foram utilizados como precursores na preparação do carvão ativado, têm-se: pericarpo do milho (LOYA-GONZÁLEZ et al, 2019), casca de coco (FREITAS; NOGUEIRA; FARINAS, 2019) e talo do milho (ZHAO et al, 2020). Diante do exposto, o objetivo deste trabalho foi remover Mn2+ de solução aquosa utilizando carvão ativado preparado a partir de sabugo de milho, como forma de reduzir os custos de produção e de agregar valor a esse resíduo, sendo uma alternativa ambientalmente correta pela utilização de um resíduo para tratar outro.
Material e métodos
A solução estoque de 10 mmol·L-1 de Mn2+ foi preparada a partir do Mn(NO3)2 50%, sendo as soluções de trabalho obtidas pela diluição desta. Os teores do Mn2+ foram quantificados no Espectrômetro de Absorção Atômica de Chama (Varian, AA240 FS) no comprimento de onda (λ) de 403,1 nm. Curva analítica com faixa linear de 0,05 a 1,00 mmol·L-1 foi construída e os parâmetros obtidos foram limite de detecção (LD) igual a 0,05 mmol·L-1, limite de quantificação (LQ) igual a 0,07 mmol·L-1, coeficiente de correlação (r) igual a 0,997 e coeficiente de variação (CV) igual a 4,6%. Os valores obtidos para r > 0,99 e CV < 5% indicaram bom ajuste linear do método, segundo Montgomery (2012). O sabugo de milho foi lavado em água corrente, cortado em pedaços e seco a 105°C em estufa de secagem (marca Quimis) por um período de 24 h. Posteriormente, foi triturado, lavado com água destilada e seco novamente em estufa a 60°C por 1 hora. Em seguida, a 15 g desse material foram adicionados 9 mL de ácido fosfórico (H33PO4 85%, marca VETEC), sendo a amostra homogeneizada manualmente e colocada em estufa de secagem a 110°C, por 16 horas. Logo após, o material foi transferido para uma mufla (marca Quimis) que foi aquecido a 500°C, permanecendo nesta temperatura por 1 hora. Após ser retirado da mufla e ser atingida a temperatura ambiente, o carvão ativado foi lavado com bicarbonato de sódio 1% (NaHCO3, Fmaia) e em seguida com água destilada, para remoção do ácido residual, até o filtrado atingir pH 6. Sendo posteriormente seco em estufa por 1 h a 60°C. Ao final, o carvão ativado foi fracionado para a granulometria de 0,2-1,0 mm, com o auxílio de peneiras da série de Tyler. Para o estudo cinético foi utilizado 0,1 g de carvão ativado em 50 mL da solução de Mn2+ sob agitação constante a 300 rpm, num intervalo de 0 a 480 min a 303 K nas concentrações de 0,50; 1,00 ; 1,25 mmol·L-1. Vale ressaltar que as condições experimentais para esse estudo foram definidas em estudos anteriores. Foram ajustados aos dados experimentais, por meio do software Origin 8.0, os modelos de pseudo- primeira ordem (PPO) e pseudo-segunda ordem (PSO)(HO, 2006). O estudo de equilíbrio foi realizado utilizando 0,1 g do CA em 50 mL da solução de Mn2+, variando as concentrações iniciais de 0,10 a 2,00 mmol·L-1, a 300 rpm por 16 h nas temperaturas de 293; 303; 313 e 323 K, no tempo que o sistema entrou em equilibro. Foram aplicados aos dados experimentais os modelos de Langmuir, Freundlich e Sips.
Resultado e discussão
Visando avaliar a evolução cinética do sistema, foi construído um gráfico
com os resultados obtidos experimentalmente para o Mn2+, bem como
calculados os parâmetros dos modelos avaliados e estão apresentados nas
Figuras 1A e 1B.
Com base na Figura 1A, a adsorção do Mn2+ foi rápida, ocorrendo
na primeira hora a maior parte da remoção, estando associado a quantidade de
sítios disponíveis no estágio inicial do processo adsortivo, sendo atingido
o equilíbrio após 180 min. Também é possível verificar que houve um aumento
da capacidade adsortiva à medida que a concentração inicial era maior,
possivelmente devido a relação proporcional entre a força motriz do
gradiente de concentração e da concentração inicial das soluções, de modo a
superar a resistência à transferência de massa entre adsorvente-adsorvato
conforme Larousm e Meniai, (2012). Pode ser constatado pela Figura 1B, que o
modelo de PSO é o que melhor se ajusta aos dados experimentais, uma vez que
apresenta R2 mais próximo de 1 e menor valor de
χν2. O ajuste a PSO indica que a velocidade de
adsorção depende da concentração dos íons no adsorvente. Baltrenaitè-
Gedienè, Leonaviĉienè e Baltrènas (2020), que utilizaram biocarvão preparado
a partir da lignina, no intuito de comparar o processo adsortivo para os
íons Cu2+, Mn2+ e Zn2+, encontraram para o
Mn2+ um modelo de PSO, com maior parte da remoção ocorrendo nos
primeiros 60 min do processo. Já nas Figuras 2A e 2B são apresentadas
isotermas para adsorção do Mn2+ pelo carvão ativado de sabugo de
milho em diferentes temperaturas.
Na Figura 2A pode ser verificado que as isotermas, adsorção do Mn2+
pelo carvão ativado de sabugo de milho, segundo Giles et al,
(1960), são do tipo H e subtipo 2, indicando alta afinidade do carvão
ativado com o íon metálico, nas concentrações avaliadas. Pode ser observado
também pela Figura 2A que não há influência significativa da temperatura no
processo adsortivo, uma vez que as isotermas se encontram quase que
sobrepostas e por esta razão, optou-se por realizar o ajuste dos modelos de
equilíbrio considerando os dados obtidos a 303K. Pela Figura 2B pode ser
verificado que modelo de Sips apresentou melhor ajuste, com capacidade
máxima adsortiva de 0,22 mmol·g-1 (12,1 mg·g-1)
indicando que o adsorvente possui superfície heterogênea, apresentando fator
de heterogeneidade inferior a 1 (nS = 0,7), conforme Vafajoo et al,
2018).
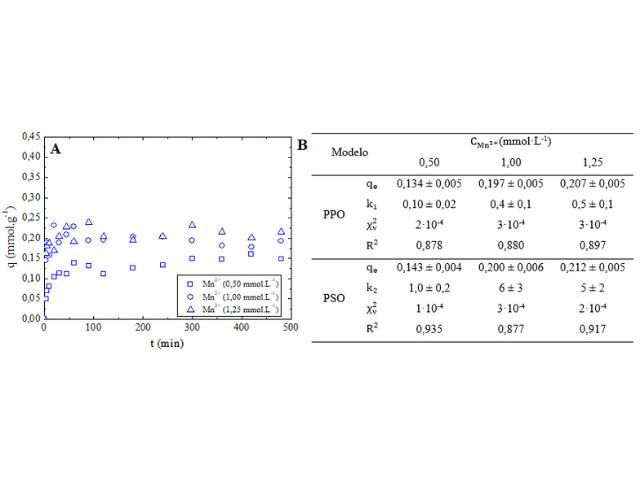
Evolução cinética da adsorção do Mn(II) pelo carvão ativado sob diferentes concentrações (A) e parâmetros calculados para os modelos de PPO e PSO (B)
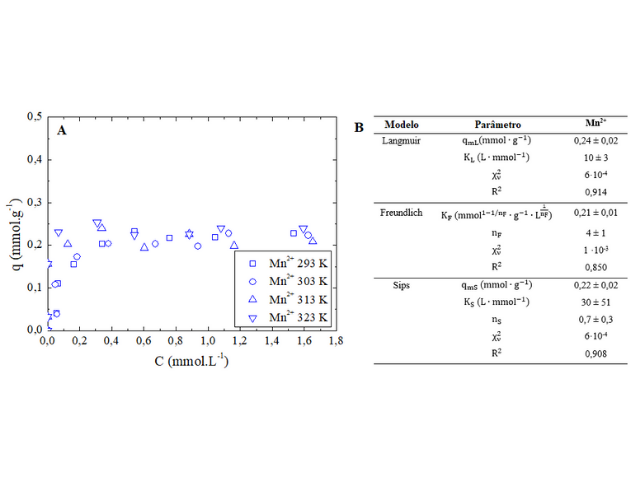
Isoterma de adsorção do Mn(II) pelo carvão ativado sob diferentes temperaturas (A), parâmetros calculados para os modelos de equilíbrio avaliados (B)
Conclusões
Desta forma, o trabalho em questão contribuiu para a discussão ambiental acerca da remoção de íons metálicos de soluções aquosas, utilizando o processo de adsorção como método de tratamento, propondo uma maneira de reaproveitar o sabugo de milho, reinserindo-o na cadeia produtiva, sendo verificado que seu uso como precursor no preparo de carvão ativado para remoção de Mn(II) foi satisfatório.
Agradecimentos
Ao PIBIC/UFPE/CNPq pelo fornecimento de bolsas de iniciação científica, ao LEAQ/UFPE por ceder espaço para condução dos experimentos, ao NUQAAPE (FACEPE, processo APQ-0346-1.06/14) pelo apoio financeiro e a FADE/UFPE.
Referências
BALTRENAITÈ-GEDIENÈ, E.; VIĈIENÈ T.; BALTRÈNAS, P. Comparison of Cu(II), Mn(II) and Zn(II) adsorption on biochar using diagnostic and simulation models. Chemosphere, v.245, 125562, 2020. Doi: 0.1016/j.chemosphere.2019.125562
BASHIR, A.; MALIK, L.A.; AHAD, S.; MANZOOR, T.; BHAT, M.A.; DAR, G.N.; PANDITH, A.H. Removal of heavy metal ions from aqueous system by ion-exchange and biosorption methods. Environmental Chemistry Letters, v.17,729-754, 2019.
BONILLA-PETRICIOLET, A.; MENDOZA-CASTILLO, D.I.; DOTTO, G.L.; DURAN-VALLE, C.J. Adsorption in water treatment. Reference Module in Chemistry, Molecular Sciences and Chemical Engineering. Elsevier, 2019, p. 1-21.
BRASIL, Ministério do Meio Ambiente. Resolução n°430, de 13 de maio de 2011. Conselho Nacional do Meio Ambiente (CONAMA), Brasília, DF, 2011.
FREITAS, J.V.; NOGUEIRA, F.G.E.; FARINAS, C.S. Coconut shell activated carbon as an alternative adsorbent of inhibitors from lignocellulosic biomass pretreatment. Industrial Crops and Products, v.137, 16-23, 2019.
GILES, C.H.; MACEWAN, T.H.; NAKHWA, S.N.; SMITH, D. Studies in Adsorption. Part XI. A system of classification of solution adsorption isotherms, and its use in diagnosis of adsorption mechanisms and in measurement of specific surface areas of solids. Journal of Chemical Society, v.14, 3973-3993, 1960.
HO, Y-S. Review of second-order models for adsorption systems. Journal of Hazardous Materials, v. 136, 681-689, 2006.
KAZEMINEZHAD, I.; MOSIVAND, S.; Elimination of copper and nickel from wastewater by electrooxidation method. Journal of Magnetism and Magnetic Materials, v.422, 84-92, 2017.
LAROUS, S.; MENIAI, A-H. Removal of copper (II) from aqueous solution by agricultural by-products-sawdust. Energy Procedia, v.18, 915-923, 2012.
LI, Y.; HUANG, H.; XU, Z.; MA, H.; GUO, Y. Mechanism study on manganese (II) removal from acid mine wastewater using red mud and its application to a lab-scale column. Journal of Cleaner Production, v.253, 119955, 2020. Doi: 10.1016/j.jclepro.2020.119955
LOYA-GONZÁLEZ, D.; LOREDO-CANCINO, M.; SOTO-REGALADO, E.; RIVAS-GARCÍA, P.; CERINO-CÓRDOVA, F.J.; GARCÍA-REYES, R.B.; BUSTOS-MARTÍNEZ, D.; ESTRADA-BALTAZAR, A. Optimal activated carbon production from corn pericarp: a life cycle assessment approach. Journal of Cleaner Production, v.219, 316-325, 2019.
MONTGOMERY, Douglas. C., Introdução ao controle estatístico da qualidade, 4 ed., LTC, 2012. p.513.
NASCIMENTO, R.F.; DE LIMA, A.C.A.; VIDAL, C.B.; MELO, D.Q.; RAULINO, G.S.C. Adsorção – aspectos teóricos e aplicações ambientais. 1ª ed. Fortaleza: Imprensa Universitária, 2014. p.13-22.
PETROVIC, M.; SOSTARIC, T.; STOJANOVIC, M.; PETROVIC, J.; MIHAJLOVIC, M.; COSOVIC, A.; STANKOVIC, S.Mechanism of adsorption of Cu2+ and Zn2+ on the corn silk (Zea mays L.). Ecological Engineering, v. 99, 83-90, 2017.
POHL, A. Removal of heavy metal ions from water and wastewaters by sulfur-containing precipitation agents. Water Air Soil Pollut, v.231, 503, 2020. Doi: 10.1007/s11270-020-04863-w
RÖLLIN, H. B.; NOGUEIRA, C. M. C. A. Manganese: Environmental Pollution and Health Effects. In book: Encyclopedia of Environmental Health, 617–629, 2011.
VAFAJOO, L.; CHERAGHI, R.; DABBAGH, R.; MCKAY, G. Removal of cobalt (II) ions from aqueous solutions utilizing the pre-treated 2-Hypnea Valentiae algae: Equilibrium, thermodynamic, and dynamic studies. Chemical Engineering Journal, v. 331, 39–47, 2018.
ZAIDAN, N.M.; AHMAD, N.; NAKAMURA, Y.; ABUBAKAR, M. Sayong ball clay membrane for cooper and nickel removal from effluent. Journal of Advanced Research in Fluid Mechanics and Thermal Sciences, v.79, 131-138, 2021.
ZHANG, Z.; CHEN, K.; ZHAO, Q.; HUANG, M.; OUYANG, X. Comparative adsorption of heavy metal ions in wastewater on monolayer molybdenum disulfide. Green Energy & Environment. 2020. Doi: https://doi.org/10.1016/j.gee.2020.06.019
ZHAO, J.; YU, L.; MA, H.; ZHOU, F.; YANG, K.; WU, G. Corn stalk-based activated carbon synthesized by a novel activation method for high performance adsorption of hexavalent chromium in aqueous solution. Journal of Colloidand Interface Science. v.57


