Desenvolvimento de novos sistemas aquosos bifásicos compostos de Polivinilpirrolidona e diferentes sais: Uma metodologia verde aplicada na recuperação de Licopeno.
- Home
- Trabalhos
ÁREA
Química Verde
Autores
Vieira, A.W. (UFVJM) ; Silva, K.C. (UFVJM) ; Mageste, A.B. (UFOP) ; Rodrigues, G.D. (UFMG) ; de Lemos, L.R. (UFVJM)
RESUMO
Sistema Aquoso Bifásico (SAB) é um tipo de extração líquido-líquido em que a água é componente majoritário e não depende de solventes orgânicos. O trabalho caracterizou novos SAB compostos por Polivinilpirrolidona e diversos sais, pelo método de titulação turbidimétrica. Estudos da influência de cátions e ânions no processo de separação de fase demonstraram que não houve diferença expressiva entre os ânions SO42- e C4H4O62-. Em relação aos cátions, o Zn2+ mostrou maior capacidade de induzir separação de fase do que Na+. No entanto, devido ao maior número de espécies por mol de Na2SO4 em relação ao ZnSO4, o Na2SO4 demonstrou maior eficiência. Licopeno particionou preferencialmente para a fase superior, provando que o SAB é um processo ambientalmente seguro na extração do analito
Palavras Chaves
Sistema Aquoso Bifásico; Polivinilpirrolidona; Licopeno
Introdução
Os sistemas aquosos bifásicos (SAB) vem sendo apresentados como uma técnica de fácil aplicação e alta segurança ambiental, pois é um tipo de extração líquido- líquido em que a água é o principal componente do sistema (PHONG, SHOW, et al., 2018). Os SAB são formados por misturas de duas soluções aquosas de diferentes classes de espécies químicas, como polímeros naturais ou sintéticos (ROOSTA, JAFARI e JAVANMARDI, 2016), surfactantes (ASSIS, DE ARAÚJO FARIA, et al., 2019) bem como sais orgânicos (PATRICIO, MAGESTE, et al., 2011)ou inorgânicos (PIRDASHTI, BOZORGZADEH, et al., 2019), líquidos iônicos (OSLOOB e ROOSTA, 2019; LI, YU, et al., 2020), entre outros (HEKAYATI, ROOSTA e JAVANMARDI, 2016; MORADI e SHAHROUZI, 2020). O uso de reagentes com baixa ou nenhuma toxicidade e que não são inflamáveis e não corrosivos permitem que um dado SAB seja facilmente preparado, manipulado e reutilizado em extrações sequenciais, mantendo o operador e o ambiente seguros, sendo esta uma das principais vantagens do SAB em comparação com as extrações por solventes (ZASLAVSKY, UVERSKY e CHAIT, 2016). Atualmente, os sistemas formados por polímero, sal e água estão entre os mais estudados, pois apresentam diversas vantagens, como a rápida alcance do equilíbrio termodinâmico e a baixa viscosidade das fases, bem como maior seletividade, uma vez que as fases coexistentes apresentam grandes diferenças físico- químicas (MASTIANI, FIROOZI, et al., 2019). Os principais fatores que afetam o comportamento de separação de fases nos SAB são a natureza química e a massa molar dos polímeros, a carga e o tamanho dos íons, o pH e a temperatura do sistema (PIRDASHTI, BOZORGZADEH, et al., 2019). Esses sistemas resultam em duas fases formadas principalmente por água, com uma fase superior com alto teor de polímero e baixo de sal e uma fase inferior com alto teor de sal e baixo de polímero, que em casos raros pode ser revertido (SOSA, FARIAS, et al., 2018). O polímero Polivinilpirrolidona (PVP) tem sido aplicado à formação de SAB devido às suas excelentes características de formação do sistema, como baixa toxicidade e alta solubilidade em água, aplicável à extração de analitos com ampla gama de hidrofobicidade/hidrofilicidade (SILVA, ABREU, et al., 2020). Alguns autores vêm caracterizando novos SAB compostos por PVP de diferentes massas molares (SADEGHI, 2005; ZAFARANI-MOATTAR e ABDIZADEH-ALIYAR, 2016) e diferentes tipos de sais (SILVA, ABREU, et al., 2020), mas ainda é necessário obter novos SAB com PVP, ampliando assim, a modulação dos processos de extração. A maioria dos estudos iniciais de partição de analitos envolvendo SAB foram aplicados à recuperação de biomoléculas como DNA (NAZER, DEHGANI e GOLIAEI, 2017), proteínas (FERREIRA, UVERSKY e ZASLAVSKY, 2018), vírus (JOSHI, TURPEINEN, et al., 2019), e várias outras estruturas celulares (SALOMA, VILLEGAS e AGUILAR, 2014). Atualmente, a aplicação de SAB abrange várias classes de substâncias como corantes naturais e sintéticos, drogas, pesticidas e íons metálicos, entre outros (IQBAL, TAO, et al., 2016; RABIEENEZHAD e ROOSTA, 2018). Neste contexto, os SAB se mostram eficientes na separação/extração de vários analitos estratégicos. O licopeno é um poderoso antioxidante que faz parte da classe dos carotenoides, sendo responsável pela cor avermelhada de frutas e legumes (DOLATABADI, ELHAMI RAD, et al., 2016). Essa biomolécula tem poderosas características de proteção do organismo humano, incluindo a redução de radicais livres gerados em diferentes reações bioquímicas (DOLATABADI, ELHAMI RAD, et al., 2016). É um composto orgânico de fórmula molecular C40H56 e tem baixa solubilidade em água (DOLATABADI, ELHAMI RAD, et al., 2016). Por essa razão, a possível extração dessa substância pelo SAB para a fase mais hidrofóbica, rica em polímero, mostrará o potencial de aplicar essa técnica como uma ferramenta simples, verde e econômica para o processo de obtenção desse analito. O trabalho caracterizou novos SAB compostos por PVP 10000 g/mol (PVP10K) e diferentes sais (Na2SO4, ZnSO4 e Na2C4H4O6). Através da determinação de seus diagramas de fase, foram avaliadas as influências nas regiões bifásicas dos sistemas devido a carga e tamanho dos cátions e da estrutura dos ânions. A partição de licopeno foi avaliada nos sistemas obtidos.
Material e métodos
Materiais Reagentes usados sem purificação adicional. Água deionizada (Deionizer Gehaka). A Polivinilpirrolidona ((C6H9NO)n, >99%) com uma m.m. média de 10000 g/mol, Licopeno (C40H56, ≥98%) e o álcool etílico (C2H5OH, ≥99,8%) foram adquiridos da Sigma Aldrich (EUA). Tartarato de sódio (Na2C4H4O6•2H2O, ≥99%), sulfato de zinco (ZnSO4•7H2O, ≥99%), sulfato de sódio (Na2SO4, ≥99%) e hidróxido de sódio (NaOH, ≥98%) foram obtidos da VETEC (Brasil). Ácido sulfúrico (H2SO4, ≥98%) foi adquirido da Isofar (Brasil). Caracterização dos SAB Titulação Turbidimétrica As curvas binodais foram obtidas aplicando-se titulação turbidimétrica em temperatura controlada, obtendo entre 30 e 40 pontos à 298,15 K. A água utilizada como solvente teve seu pH = 6 previamente ajustado (Metrohm). Nas titulações entre o PVP10K e os sais de sulfato (Na+ e Zn2+) as concentrações iniciais das soluções foram PVP10K = 55,0 (%m/m), Na2SO4 = 19,0 (%m/m) e ZnSO4 = 28,0 (%m/m). No entanto, na titulação entre PVP10K e Na2C4H4O6, as concentrações foram de 50,0 e 41,7 (%m/m), respectivamente. Determinação dos diagramas de fase e linhas de amarração As soluções estoque de cada componente foram preparadas pesando quantidades adequadas dos reagentes em uma balança analítica (Shimadzu) utilizando água com pH ajustado 6,00 como solvente. Cada SAB foi preparado misturando quantidades específicas das soluções de polímero e sal, resultando em um sistema com 10 g da massa total. Após a agitação (Fisatom Vortex), os tubos foram colocados em um banho ultra-termostático (Marconi) por 24 horas, na temperatura de 298,15 K, até que o sistema alcançasse o equilíbrio, observado pela ausência de turbidez. Finalmente, as alíquotas das fases superior (FS) e fase inferior (FI) foram extraídas e diluídas para determinar as concentrações de sal e polímeros. A concentração de sal em ambas as fases foi determinada por um Condutivímetro (Conductivimeter SI Analytics Handy 200). A concentração de polímero foi determinada pela medição do índice refração (nD) utilizando um Refratômetro (Megabrix). Todas as medições analíticas foram realizadas em triplicata. Partição do Licopeno Uma solução estoque de licopeno foi preparada em etanol na concentração de 2 g/L. Os estudos de partição foram realizados adicionando alíquotas de 300 μL da solução estoque de licopeno ao SAB, então, os sistemas foram agitados por 1 m e colocados em repouso por 24 h nas temperaturas de 278,15, 288,15 e 298,15 K. Cada experimento foi realizado em triplicata com o ensaio em branco adicionado apenas de 300 μL de etanol. As alíquotas das fases foram removidas e devidamente diluídas. O sinal analítico foi medido por espectrometria de absorção molecular (Varian Cary-50) no comprimento de onda de λ=260,0 nm. Os estudos de partição foram avaliados pelo coeficiente de partição (K) como descrito na Equação 1 (K=[Lic]FS/[Lic]FI). Onde [Lic]FS e [Lic]FI expressam a concentração molar de licopeno nas FS e FI, respectivamente.
Resultado e discussão
Curvas Binodais
A caracterização das regiões nos diagramas de fase dos sistemas onde esses
são monofásicos ou bifásicos foram realizadas pela determinação das linhas
binodais através titulação turbidimétrica. Os resultados indicam uma região
bifásica maior para o sistema formado por PVP10K + Na2SO4 + H2O seguido
pelos sistemas formados por ZnSO4 e Na2C4H4O6. Comparando os diagramas de
fase em termos de percentual mássico, resultados semelhantes foram obtidos
por Ghaffari (2019) e colaboradores nos estudos de caracterização de novos
SAB compostos de polietileno glicol de massas molares 6000 e 8000 g/mol com
diferentes combinações de sais de sódio (citrato, tartarato, sulfato).
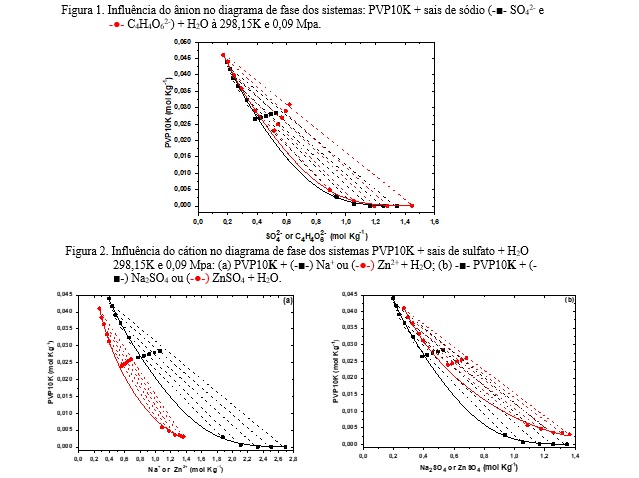
Efeito dos cátions e ânions
Para avaliar o efeito do cátion e do ânion na formação da região bifásica do
SAB, os diagramas foram plotados utilizando a concentração em mol/kg, pois a
comparação em unidades de massa pode causar erros de interpretação ao
avaliar cátions de diferentes massas molares. A Figura 1 mostra os diagramas
de fase para os sistemas caracterizados à 298,15 K em termos das
concentrações molares dos ânions. Em sistemas formados por PVP10K e sais de
sódio, não houve diferença significativa no tamanho das regiões bifásicas ao
comparar a relação entre as concentrações molares dos ânions. Essa relação
de proximidade entre os ânions em suas respectivas capacidades de induzir o
sistema ao processo de segregação de fase está relacionada às suas
habilidades de salga. Os valores de energia livre de Gibbs de hidratação
(ΔGhid) destes ânions (ΔGhyd (SO42-) = -1080 kJ/mol e ΔGhid (C4H4O62-) =
-1102 kJ/mol) são próximas, mostrando que ambos têm habilidades semelhantes
para ordenarem moléculas de água ao seu redor, diminuindo assim a
solubilidade dos polímeros (MARCUS, 1991). Comportamento semelhante é
observado ao comparar os resultados deste trabalho com outros ânions
(ZAFARANI-MOATTAR e SADEGHI, 2005; SADEGHI, RAFIEI e MOTAMEDI, 2006).
A Figura 2 mostra os diagramas de fase para os sistemas formados por PVP10K
+ Na2SO4 e PVP10K + ZnSO4 à 298,15 K e 0,09 MPa, em função das concentrações
molares dos cátions (2a) e dos sais (2b). Comparando os sistemas formados
por PVP10K e os sais de sulfato (Fig. 2a), uma menor concentração de Zn2+ em
comparação com Na+ é necessária para a segregação de fase. Assim, o Zn2+ é
um indutor de separação de fase melhor do que o Na+, porque quantidades
menores dele são necessárias para que o sistema separe fase. Os valores de
ΔGhid de Zn2+ são maiores que Na+ (ΔGhid(Na+)= -430 kJ/mol e ΔGhid(Zn2+)=
-1955 kJ/mol (MARCUS, 1991)), confirmando que Zn2+ tem uma capacidade maior
do que o Na+ em ordenar moléculas de água ao seu redor. No entanto, quando
os sais são comparados, o sistema composto por Na2SO4 tem valores de
concentração molar mais baixos em comparação ao ZnSO4 (Fig. 2b) para induzir
a separação de fase, uma vez que há uma proporção molar diferente entre
cátion/sal para Na+ (2:1) e Zn2+ (1:1). Esta conclusão é semelhante aos
resultados obtidos por Ananthapadmanabhan e Goddard (1987) em seus estudos
sobre o processo de separação de fases em sistemas compostos por PEO/SAL.
Esses autores mostraram que a eficiência em induzir a separação das fases em
SAB causadas pela influência dos sais seguiu a seguinte ordem: Na+ > Mg2+ >
Zn2+ > Li+, sendo o ânion sulfato comum na formação dos SAB.
As medidas na diferença de composição entre as FS e FI, expressando as
diferenças entre as propriedades termodinâmicas intensivas, é calculada pelo
comprimento da linha de amarração - CLA (Equação 2), que se expressa como a
diferença entre as concentrações de polímero e sal presentes nas fases: Eq.2
(CLA = (([Pol]FS - [Pol]FI)^2 + ([Sal]FS -[Sal]FI)^2))^0,5)). Onde [Pol]FS e
[Pol]FI são as concentrações em porcentagem mássica de polímero na FS e FI,
respectivamente, enquanto [Sal]FS e [Sal]FI são as concentrações de sal. À
medida que o CLA aumenta, a FS torna-se cada vez mais rica em polímero e
pobre em sal, enquanto a FI se torna mais rica em sal e pobre em polímero,
acentuando assim as diferenças físico-químicas entre as fases e,
consequentemente, aumentando o potencial de separação dos SAB.
Partição do Licopeno
A partição de licopeno nos SAB aqui caracterizados foi avaliada para mostrar
o potencial dessa técnica para a extração desse analito estratégico. Assim,
o comportamento de partição do analito (Figura 3) foi medido no SAB
avaliando o efeito do CLA, além dos cátions e ânions de formação do SAB, e a
temperatura.
Na Figura 3, o coeficiente de partição do licopeno é superior a 1 para todos
os SAB avaliados (3,98 ± 0,09 <K< 23,6 ± 0,3), indicando uma partição
preferencial do analito para a fase superior dos sistemas. De acordo com o
modelo Johansson (JOHANSSON, KARLSTRÖM, et al., 1998), derivado da teoria
Flory-Huggins, a divisão de um analito para FS de um SAB formado por
polímero/sal/água é devido a interações moleculares entálpicas entre o
licopeno e os componentes da FS. Para corroborar essa conclusão, como mostra
a Figura 3, o aumento dos valores CLA e de temperatura provocam um aumento
no valor de K. O aumento dos valores da CLA provoca um aumento na
concentração dos componentes principais em cada fase e uma diminuição na
concentração do outro componente. Isto é, a FS é mais rica em polímero e
pobre em sal, e a FI exibe um comportamento inverso (ASSIS, MAGESTE, et al.,
2021). Assim, a tendência de um soluto de particionar preferencialmente para
uma fase devido às suas interações na mesma aumentará com o aumento do valor
da CLA, que acompanha os resultados obtidos neste estudo. Além disso, um
aumento na temperatura aumentou o particionamento do licopeno para o FS,
indicando que o processo é entalpicamente direcionado. Devido às suas
características hidrofóbicas (DOLATABADI, ELHAMI RAD, et al., 2016), o
licopeno é transferido para a fase menos hidrofílica, onde suas interações
são mais favoráveis. Assim, os resultados na Figura 5 mostram que os sais
mais eficazes para induzir a transferência de licopeno para FS seguem a
seguinte sequência: Na2SO4 > ZnSO4 > Na2C4H4O6. Os sais com maior efeito de
salga promovem a transferência do analito hidrofóbico para a fase com as
mesmas características, com maior eficácia. Assim, esses SAB provaram ser
uma ótima alternativa ambientalmente segura para aplicação na extração de
licopeno.
Diagramas de Fase
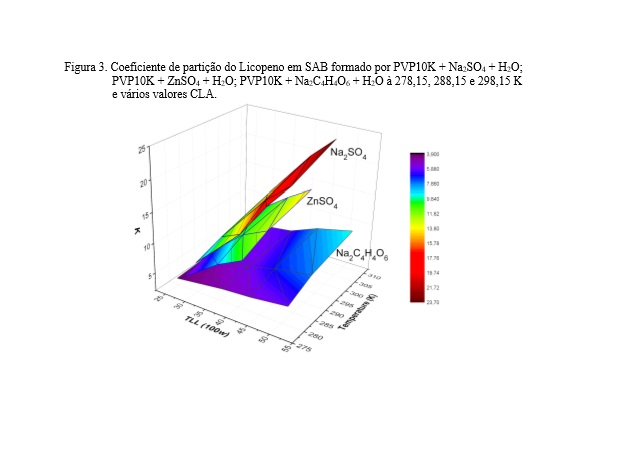
Figura 3. Coeficiente de partição do Licopeno em SAB formado por PVP10K + (Na2SO4/ ZnSO4/ Na2C4H4O6 ) em varias temperaturas e composições de sistemas
Conclusões
Os novos sistemas aquosos bifásicos formados por PVP10K + Na2SO4 + H2O, PVP10K + ZnSO4 + H2O, e PVP10K + Na2C4H4O6 + H2O à 298,15 K foram caracterizados. Com relação à influência de cátions e ânions no processo de segregação de fase, não houve diferença significativa entre os ânions SO42- e C4H4O62-. Em relação aos cátions, o Zn2+ mostrou maior capacidade de induzir a separação de fases do que Na+. No entanto, o Na2SO4 demonstrou maior eficiência no processo de separação de fases do que o ZnSO4. Todos os sistemas caracterizados neste trabalho possuem a água como seu principal componente e estão livres de solventes orgânicos, sendo assim, compatíveis com os princípios da química verde. Além disso, os SAB foram aplicados à partição de licopeno, e uma interação entálpica entre o soluto e os componentes da fase superior é a força motriz responsável pelo processo. O SAB formado por PVP10k + Na2SO4 + H2O mostrou valores K de até 23,6 ± 0,3 e têm enorme potencial de aplicação na extração/purificação do licopeno.
Agradecimentos
Agradecemos o apoio financeiro concedido pela Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG)(APQ-01308-18), o Conselho Nacional de Desenvolvimento Científico e Tecnológico(CNPq)(425913/2018-0) e à UFVJM.
Referências
ANANTHAPADMANABHAN, K. P.; GODDARD, E. D. Aqueous Biphase Formation in Polyethylene Oxide-Inorganic Salt Systems. Langmuir , New York, v. 3, p. 25-31, 1987.
ASSIS, R. C. et al. , Extraction of arsenic(III) in aqueous two-phase systems: A new methodology for determination and speciation analysis of inorganic arsenic. Microchemical Journal, v. 147 , p. 429-436, 2019.
ASSIS, R. C. et al. Application of aqueous two-phase system for selective extraction and clean-up of emerging contaminants from aqueous matrices. Talanta , v. 223, p. 121697, 2021.
DOLATABADI, Z. et al. Modeling of the lycopene extraction from tomato pulps. Food Chemistry, v. 190 , p. 968-973, 2016.
FERREIRA, L. A.; UVERSKY, V. N.; ZASLAVSKY, B. Y. Phase equilibria, solvent properties, and protein partitioning in aqueous polyethylene glycol-600-trimethylamine N-oxide and polyethylene glycol-600-choline chloride two-phase systems. Journal of Chromatography A, v. 1535, p. 154-161, 2018.
GHAFFARI, S. et al. Partitioning of cefazolin in aqueous two-phase systems containing poly(ethylene glycol) and sodium salts (citrate, tartarate, and sulphate). Fluid Phase Equilibria , v. 488, p. 54-61, jun. 2019.
HEKAYATI, J.; ROOSTA, A.; JAVANMARDI, J. Liquid–liquid equilibria in the quinary Liquid–liquid equilibria in the quinary presence of glucose and ethanol: Experimental investigation and thermodynamic modeling. Thermochimica Acta, v. 625 , p. 47-52, 2016.
IQBAL, M. et al. Aqueous two-phase system (ATPS): an overview and advances in its applications. Biological Procedures Online, v. 18, p. 18, October 2016.
JOHANSSON, H. O. et al. Driving forces for phase separation and partitioning in aqueous two-phase systems. Journal of Chromatography B: Biomedical Sciences and Applications, v. 711 , p. 3-17, 1998.
JOSHI, P. U. et al. Tie line framework to optimize non-enveloped virus recovery in aqueous two-phase systems. Journal of Chromatography B, v. 1126-1127, p. 121744, set. 2019.
KARMAKAR, R.; SEN, K. Aqueous biphasic extraction of metal ions: An alternative technology for metal regeneration. Journal of Molecular Liquids, v. 273, p. 231-247, jan. 2019.
LI, M. et al. Construction of an integrated platform for 5-HMF production and separation based on ionic liquid aqueous two-phase system. Journal of Molecular Liquids, v. 313, p. 113529, 2020.
MARCUS, Y. Thermodynamics of Solvation of Ions - Part 5.Gibbs Free Energy of Hydration at 298.15 K. J. CHEM. SOC. FARADAY TRANS., v. 87, n. 18, p. 2995-2999, 1991.
MASTIANI, M. et al. Polymer-Salt Aqueous Two Phase System (ATPS) Micro-Droplets for Cell Encapsulation. Scientific Reports, v. 9 , p. 15561, 2019.
MORADI, F.; SHAHROUZI, J. R. Phase equilibrium and partitioning of cephalosporins (cephalexin, cefazolin, cefixime) in aqueous two-phase systems based on carbohydrates (glucose, fructose, sucrose, maltose) / acetonitrile. Fluid Phase Equilibria, v. 507, p. 112388, 2020.
NAZER, B.; DEHGANI, M. R.; GOLIAEI, B. Plasmid DNA affinity partitioning using polyethylene glycol – sodium sulfate aqueous two-phase systems. Journal of Chromatography B, v. 1044-1045, p. 112-119, fev. 2017.
OSLOOB, M.; ROOSTA, A. Experimental study of choline chloride and K2HPO4 aqueous two-phase system, and its application in the partitioning of penicillin G. Journal of Molecular Liquids, v. 279 , p. 171-176, 2019.
PATRICIO, P. D. R. et al. Phase diagram and thermodynamic modeling of PEO plus organic salts + H2O and PPO + organic salts + H2O aqueous two-phase systems. Fluid Phase Equilibria, v. 305 , p. 1-8, 2011.
PHONG, W. N. et al. Recovery of biotechnological products using aqueous two phase systems. Journal of Bioscience and Bioengineering, v. 126, n. 3, p. 273-281, set. 2018.
PIRDASHTI, M. et al. Phase equilibria of aqueous mixtures of PEG with formate salt: Effects of pH, type of cation, polymer molecular weight and temperature. Fluid Phase Equilibria, v. 485 , p. 158-167, 2019.
RABIEENEZHAD, A.; ROOSTA, A. Experimental study and thermodynamic modelling of penicillin-G extraction using PEG 6000 and K2HPO4 aqueous two-phase system. The Journal of Chemical Thermodynamics, v. 120 , p. 54-59, 2018.
ROOSTA, A.; JAFARI, F.; JAVANMARDI, J. Journal of Chemical & Engineering Data, v. 61, p. 565-570, 2016.
SADEGHI, R. Measurement and correlation of phase equilibria for several PVP + salt aqueous two-phase systems at 303.15 K. Fluid Phase Equilibria, v. 237, p. 40–47, 2005.
SADEGHI, R.; RAFIEI, H. R.; MOTAMEDI, M. Phase equilibrium in aqueous two-phase systems containing poly(vinylpyrrolidone) and sodium citrate at different temperatures—Experimental and modeling. Thermochimica Acta , v. 451, p. 163–167, 2006.
SALOMA, E. E.; VILLEGAS, P. V.; AGUILAR, O. Continuous aqueous two-phase systems devices for the recovery of bilogical products. Food and Bioproducts Processing, v. 92, p. 101-112, 2014.
SILVA, K. C. et al. Aqueous two-phase systems formed by different phase-forming components: Equilibrium diagrams and dye partitioning study. Fluid Phase Equilibria, v. 520, p. 112664, 2020.
SKOOG, D. A. et al. Fundamentals of analytical chemistry. [S.l.]: [s.n.], 2014.
SOSA, F. H. B. et al. Measurement and correlation of aqueous two-phase systems of polyvinylpyrrolidone (PVP) and manganese sulfate: Effects of molecular weight and temperature. Fluid Phase Equilibria, v. 472, p. 204-211, 2018.
ZAFARANI-MOATTAR, M. T.; ABDIZADEH-ALIYAR, V. Thermodynamic studies on the complete phase diagram of the ternary aqueous system containing polyvinylpyrrolidone 3500 and sodium sulfate at different temperatures: Experiment and correlation. J. Chem. Thermodynamics, v. 98, p. 71-80, 2016.
ZAFARANI-MOATTAR, M. T.; SADEGHI, R. Effect of temperature on the phase equilibrium of aqueous two-phase systems containing polyvinylpyrrolidone and disodium hydrogen phosphate or trisodium phosphate. Fluid Phase Equilibria, v. 238 , p. 129-135, 2005.
ZASLAVSKY, B. Y.; UVERSKY, V. N.; CHAIT, A. Analytical applications of partitioning in aqueous two-phase systems: Exploring protein structural changes and protein–partner interactions in vitro and in vivo by solvent interaction analysis method. Biochimica et Biophysica Acta, v. 1864, n. 5, p. 622-644, maio 2016.


