ESTUDO DA CONVERSÃO DE SACAROSE EM OCTAACETATO DE SACAROSE (SOA) COM AVALIAÇÃO DE MODELOS CINÉTICOS.
- Home
- Trabalhos
ÁREA
Química Verde
Autores
da Silva, M.L.M. (UFPE) ; Miranda de Farias, P.H. (UFPE) ; Medeiros de Lima Filho, N. (UFPE)
RESUMO
O Octaacetato de Sacarose (SOA) é um produto não tóxico sintetizado a partir da acetilação da sacarose, podendo ter aplicações em diversos setores industriais, como fabricação de adesivos plastificantes e excipientes farmacêuticos, e não apenas em setores alimentícios, como o caso do reagente de partida, a sacarose. O presente trabalho avaliou o efeito dos seguintes parâmetros de síntese: tempo de reação, carga de catalisador e temperatura da reação. Posteriormente, foi proposto um modelo cinético para a reação. De acordo com os resultados obtidos, as melhores condições para o melhor rendimento (90%) foram de 120 minutos, 10% de catalisador e temperatura de 130°C. Por fim, a partir da cinética da reação, foi encontrado um valor para a constante cinética de k1'=0,0003 s-1.
Palavras Chaves
Acetilação catalítica; Octaacetato de sacarose; Sacarose
Introdução
A chamada biomassa renovável terrestre é constituída de diversos produtos de baixas e altas massas molares e de diversas naturezas químicas, como por exemplo, açúcares, aminoácidos, terpenos, lipídios, e biopolímeros de altas massas molares, como celulose, hemicelulose, quitina, amido, lignina e proteínas. Essas podem ter 3 destinos: alimentação, produção de energia (bicombustíveis) e fabricação de novos produtos. O setor sucroquímico vem crescendo desde o século passado com o intuito de inserir a sacarose e outros carboidratos em mercados além do setor alimentício, bem como para a substituição de derivados do petróleo para diminuir a toxidade de alguns produtos que causam danos tanto ao ecossistema como aos seres humanos (RIVERA et al. 2012). Tradicionalmente, os critérios para priorizar uma rota de síntese baseia-se na disponibilidade, no preço das matérias-primas, nos rendimentos do processo e em consumo de energia. Por isso o ciclo de vida do produto deve seguir os seguintes critérios: ser comercialmente útil; apresentar o mínimo de toxicidade para humanos e meio ambiente; ser fabricados em processos viáveis e ter usos diversificados (RIVERA et al., 2012). A sacarose, juntamente com a glicose, são os principais carboidratos de baixa massa molar para a síntese orgânica. Dos vários processos envolvendo a sacarose como matéria-prima, alguns já são viáveis para aplicação em escala industrial(FERREIRA, SILVA, FERREIRA, 2013; FERREIRA, ROCHA, SILVA, 2009). A acetilação é uma das técnicas mais utilizada para a proteção de grupos hidroxil em carboidratos, a acetilação de açúcares sendo barato e útil, para a síntese natural de ésteres de sacarose, onde a reação muitas vezes é alcançada utilizando catalisadores solúveis como acetato de sódio ou hidróxido de sódio acompanhado do agente de acetilação em excesso, anidrido acético(SILVA, 2007). Até onde se sabe, o último trabalho reportado na literatura envolvendo a síntese química do SOA foi realizado por LINSTEAD et al. (1940). SILVA (2007) , em seus estudos preliminares propôs uma nova rota para síntese química do SOA, tendo sido a base para o presente estudo. O octaacetato de sacarose (SOA) é um pó cristalino de gosto amargo, inodoro, com oito grupos de acetato e absortividade molar em 210nm, ele possui inúmeras aplicações como: produção de adesivos, plastificante, lâminas de vidro ou incorporado em resinas sintéticas de composições básicas semelhantes, como o octaacetato de celulose. Por conter um sabor extremamente amargo e ser um composto não tóxico, ele é usado como aditivos de bebidas, alimentos e substituto de outros produtos para o desenvolvimento de drogas pediátricas. Além disso, é utilizado em pesticidas e inseticidas orgânicos com a finalidade de combater pragas e evitar o envenenamento acidental (STAGNER et al., 2019;GADDAM, 2018; PETKOVA,2017). O SOA juntamente com o CO2 supercrítico vem sendo utilizado para o aperfeiçoamento das propriedades mecânicas e de hidrofobicidade dos papeis. Como o SOA é solúvel no CO2 supercrítico que é um solvente não tóxico, foi possível realizar o revestimento do produto em papeis, os materiais com e sem revestimento foram analisados através de espectroscopia FT-IR, UV-Vis, microscopia eletrônica de varredura (MEV), microscopia de força atômica (MFA) e teste de hidrofobicidade. Os resultados obtidos foram papeis mais resistentes mecanicamente e mais hidrofóbicos, além de ser um processo barato e totalmente reciclável. Outra aplicação recente foi a utilização do SOA juntamente com CO2 supercrítico na indústria farmacêutica com a produção de excipientes farmacêuticos de aspirina e paracetamol. Estudos realizados por RAMACHANDRAN et al.(2021) mostraram que essa combinação entre o SOA e o solvente verde faz com que o excipiente se torne vitrificado e o princípio ativo seja liberado gradativamente aumentando a eficiência do medicamento, diferentemente da utilização dos solventes orgânicos acetato de etila e acetona. Neste estudo, tanto o octaacetato de sacarose como um de seus subprodutos, pentaacetato de glicose, possuem resultados satisfatórios para os excipientes farmacêuticos dos medicamentos testados. (ANTONY, 2018; RAMACHANDRAN 2021). Para este estudo, foi realizada a reação de acetilação, substituindo os grupos hidroxila pelos grupos acetato, para a formação do octaacetato de sacarose. Com esta reação será possível obter um produto com maior valor agregado, baixo custo de produção e em um tempo relativamente baixo, para separação total do produto (SILVA, 2007). O objetivo geral do presente trabalho visou avaliar a síntese do octaacetato de sacarose, de acordo com parâmetros como tempo de reação, quantidade de catalisador e temperatura da reação, para cada parâmetro analisado foram realizadas três reações variando as condições de cada parâmetro estudado (tempo, temperatura ou catalisador) e mantendo os outros dois constantes
Material e métodos
A metodologia utilizada foi adaptada de Silva (2007). A Cromatografia Líquida de Alta Eficiência (CLAE) foi a técnica utilizada para identificação e quantificação dos compostos. Foi utilizada uma coluna C18, em fase reversa, eluição isocrática, fase móvel acetonitrila e água (60:40), e detector DAD/Uv-Vis. O procedimento experimental se deu de acordo com as seguintes etapas: A primeira etapa do estudo foi a preparação dos padrões, tanto do octaacetato de sacarose, quanto dos subprodutos da reação (pentaacetato de glicose e o tetraacetato de frutose). No balão foi adicionado 150 mL de anidrido acético e com 3,75 g de acetato de sódio. Após a temperatura atingir 130°C, foi adicionado o reagente principal. Tanto na reação de preparação do pentaacetato de glicose quanto na preparação do tetraacetato de frutose foi adicionado uma massa 19,64g de glicose e frutose, respectivamente. Ambas as reações foram realizadas numa agitação com 530 rpm por 15 min. A reação de síntese do octaacetato de sacarose foi realizada com os mesmos equipamentos utilizados na produção dos padrões, a princípio, foi utilizado 150 mL de anidrido acético e 3,75 g de acetato de sódio. após o aquecimento até a temperatura desejada, foi adicionada 37,5 g de sacarose, a reação ocorreu em 180 min. Posteriormente, foi adicionado água gelada (aproximadamente 0°C) e deixado em repouso por cerca de 30 minutos. Em seguida, formou-se duas fases, onde na mais densa estava o produto formado, realizou-se 3 lavagens e adicionou-se etanol 95% para recristalização do SOA. Para verificar da influência do tempo no rendimento da reação, foi realizada uma reação, como descrito anteriormente, sendo coletada amostras a cada 15 minutos nos primeiros 60 minutos, e em seguida a cada 30 minutos até completar 180 minutos de reação. Onde o rendimento é definido como a razão entre a concentração de octaacetato de sacarose sintetizada em relação a concentração inicial de sacarose multiplicado por 100. Para o estudo da influência da massa de catalisador, foram realizadas 3 reações para a produção do SOA com as seguintes quantidades de acetato de sódio: 1,875g, 3,75g e 5,625g, sendo 5, 10 e 15% m/m, em relação à sacarose, respectivamente. A temperatura (130ºC) e o tempo de reação (120 min) permaneceram constantes. Outro parâmetro que foi estudado foi a influência da temperatura na reação, onde foram realizadas 3 reações, com temperaturas de 110°C, 120°C e 130°C, com objetivo de verificar qual temperatura ideal para a maior conversão do produto e rendimento em octaacetato de sacarose. O tempo e a massa de catalisador, assim como as quantidades de anidrido acético e sacarose permaneceram constantes. Por fim foi realizada a cinética da acetilação da sacarose para a formação do SOA, posteriormente, foi feita uma modelagem para avaliar o comportamento da reação de 0 min a 180 min numa temperatura de 130°C e 10% (m/m) da concentração do catalisador.
Resultado e discussão
A partir dos cromatogramas das amostras coletadas nos tempos predeterminados
(como descrito na seção Materiais e Métodos), foi possível observar a
evolução do rendimento da reação em função do tempo, como mostrado na Figura
1.Observando a Figura 1, foi identificado que o rendimento do SOA de 15 min até
120 min tem um crescimento acentuado, estabilizando próximo dos 120 min com
um rendimento de 90%. Neste intervalo de tempo, a reação começou a
apresentar uma coloração amarronzada, indicando uma degradação da sacarose
ainda existente no meio, dificultando a produção de SOA por diminuição de
reagente disponível no meio reacional, e, consequentemente, impossibilitando
um rendimento superior. Portanto, 120 min foi o tempo ideal de síntese do
SOA, nas condições estudadas. Esse resultado mostrou uma economia de tempo,
e também no processo de síntese, quando comparado os resultados obtidos por
Linstead et al. (1940).
Em relação à influência da quantidade de catalisador na reação, foi possível
identificar que foram obtidos rendimentos na mesma ordem de grandeza para as
três quantidades testadas: 81,10%, 90,93% e 88,75% de rendimento para uma
quantidade de catalisador (m/m) de 5, 10 e 15%, respectivamente. Assim, o
rendimento mais satisfatório foi para a concentração de catalisador de 10%
(90,93%), sendo esta a concentração ideal de catalisador. LINSTEAD et al.
(1940) obtiveram o SOA com uma alta concentração de catalisador em relação à
sacarose, chegando a 50%. Portanto, o resultado neste trabalho é um avanço
interessante, uma vez que foi possível obter com uma quantidade muito
inferior de catalisador, diminuindo o custo da sua produção.
Em relação à influência da temperatura da reação, a partir das 3 condições
testadas (1,79%, 78,11% e 90,93% para temperaturas de 110, 120 e 130°C,
respectivamente), foi possível identificar uma relação diretamente
proporcional (crescente) entre o rendimento e a temperatura, ou seja, quanto
maior a temperatura maior o rendimento da reação, sendo a temperatura de
130°C a melhor das condições estudadas. À 110°C, houve um rendimento baixo
(1,79%). Vale salientar que um aumento de temperatura do meio reacional
superior a 135 °C, a sacarose pode sofrer uma quebra da sua ligação
glicosídica, formando glicose e frutose, que serão acetilados e,
consequentemente, a reação terá um rendimento de SOA inferior ao desejado.
Assim sendo, 130°C é a temperatura ideal, nas condições estudadas, visando a
maximização do rendimento reacional.
MODELAGEM CINÉTICA
De acordo com a Figura 2, a determinação da constante da reação e modelagem
cinética são definidas a partir da equação (4a) em que 8 mols de anidrido
acético (AC) reagem com Sacarose (S) formando um mol de octaacetato de
sacarose (SOA), junto com um mol de ácido acético (Ac).
As equações à esquerda na Figura2 (b) expressam a variação da concentração de
sacarose (S) e de octaacetato de sacarose (SOA) com relação ao tempo de
reação. A constante de equilíbrio é definida de acordo com a reação (1a).
Já as equações à direita figura2(b) expressam as concentrações finais da
sacarose e do SOA em função tempo. A partir dessas equações foi possível
calcular o valor da constante aparente k1'=0,0003s-1, que engloba todas as
constantes do meio reacional como: catalisador da reação (acetato de sódio; AS),
agente de acetilação em excesso (Anidrido acético; AAc) e constante de
equilíbrio Keq.
Na modelagem na Figura2(c) é possível observar a curva de consumo da sacarose
(em azul), a curva teórica da produção de SOA e a curva experimental do SOA (em
laranja), sendo esta última com o erro de 3,995% em relação a curva teórica,
o que mostra que o ajuste realizado é aceitável.
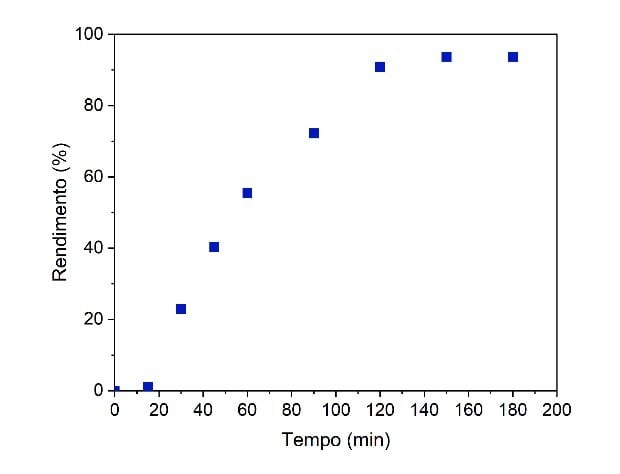
Evolução do SOA em relação ao tempo de acordo com os seguintes parâmetros, temperatura 130°C e massa do catalisador 10 % (m/m).
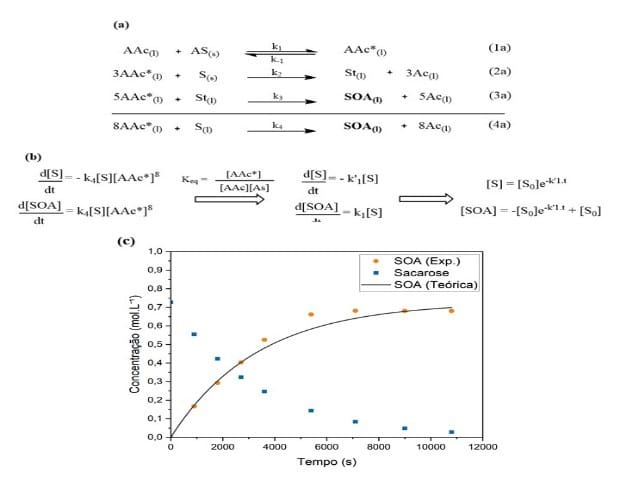
(1a) à (4a) reações de síntese do SOA; (2b) equações cinéticas da concentração de sacarose e do SOA de acordo com o tempo; 2c modelagem cinética.
Conclusões
A partir dos dados obtidos no estudo da influência do tempo de reação, foi possível observar um rendimento de 90% em um tempo de reação de 120 min numa temperatura de 130°C, de acordo com estudo, foi verificado que para tempos além de 120 min a conversão seria praticamente idêntica, devido a pouca quantidade de sacarose no sistema reacional. Para os estudos da quantidade de catalisador, o que obteve um maior rendimento foi a reação realizada com 10% (m/m) em relação ao reagente principal que era a sacarose. Para concentrações inferiores de acetato de sódio houve uma diminuição do rendimento, já para 15% rendimento foi praticamente o mesmo, mostrando que um uso numa concentração maior traria apenas prejuízo econômico. Em estudos realizados avaliando o rendimento do octaacetato de sacarose de acordo com a temperatura, foi possível um maior rendimento em 130°C, cerca de 90%. Para as temperaturas de 120°C e 110°C os rendimentos foram,respectivamente, 78,1% e 1,78%, esse baixo rendimento na temperatura de 110°C mostra que as reações de acetilação envolvendo a sacarose não devem ser realizadas nesta faixa de temperatura. A cinética da reação mostrou um ótimo ajuste da curva experimental em relação a teórica, com o ajustamento da constante no valor de k1'=0,0003(1/s) pseudo- primeira ordem. Por fim, pôde ser verificado que o maior rendimento adquirido na reação foi com os seguintes parâmetros: um tempo de 120 min, uma concentração de catalisador de 10%(m/m) em relação a sacarose e uma temperatura de 130°C.
Agradecimentos
Ao Laboratório de Processos Catalíticos (LPC) pelo espaço e disponibilidade dos equipamentos para realização deste estudo.
Referências
•ANTONY, A., Ramachandran, J. P., Ramakrishnan, R. M., &Raveendran, P. (2018). Sizingofpaperwith sucrose octaacetateusingliquidandsupercriticalcarbondioxide as a greenalternativemedium. Journalof CO2 Utilization, 28, 306-312.
•FERREIRA, V. F; ROCHA, D. R; SILVA, F. C. Potencialidades e oportunidades na química da sacarose e outros açúcares. Química Nova, v. 32, n. 3, p. 623-638, 2009.
•FERREIRA, V.F; SILVA, F.C; FERREIRA, P.G. Carboidratos como fonte de compostos para a indústria de química fina. Química Nova, v. 36, n. 10, p. 1514-1519, 2013.
•GADDAM, Shalini; STAGNER, William C. Sucrose Octaacetate Chemical Kinetics and Shelf Lives at Various Formulation pHs. AAPS PharmSciTech, v. 19, n. 1, p. 176-183, 2018.
•LINSTEAD, R. P. et al. The stable form of sucrose octaacetate. Journal of the American Chemical Society, v. 62, n. 11, p. 3260-3263, 1940.
•PETKOVA, N. et al. “Green” Synthesisof Sucrose OctaacetateandCharacterizationof Its PhysicochemicalPropertiesandAntimicrobialActivity. Chemical andBiochemicalEngineeringQuarterly, v. 31, n. 4, p. 395-402, 2017.
•RAMACHANDRAN, J. P., Kottammal, A. P., Antony, A., Ramakrishnan, R. M., Wallen, S. L., &Raveendran, P. (2021). Green processing: CO2-induced glassificationof sucrose octaacetateand its implications in thespontaneous release ofdrugfromdrug-excipientcomposites. Journalof CO2 Utilization, 47, 101472.
•RIVERA, N. A., Rodríguez, D. A., Morán, A. C., Solano, A. H.,Sucroquímica, alternativa de diversificación de la agroindustria de la caña de azúcar. Multiciencias, v. 12, n. 1, p. 7-15, 2012.
•SILVA, Romero Timóteo da. Desenvolvimento e avaliação da tecnologia de produção de ésteres homogêneos de sacarídeos por acetilação catalítica. Dissertação de mestrado, Universidade Federal de Pernambuco, 2007.
•STAGNER, W. C.; GADDAM, S.; PARMAR, R.; GHANTA, A. K. Chapter Five - Sucrose octaacetate, v. 44, p. 267-291, 2019


