ABSORÇÃO QUÍMICA DE CO2 EM MICRORREATOR UTILIZANDO SOLUÇÃO DE AMINA
- Home
- Trabalhos
ÁREA
Química Computacional
Autores
Neves, C. (INSTITUTO MAUÁ DE TECNOLOGIA) ; Trevelato, I. (INSTITUTO MAUÁ DE TECNOLOGIA) ; Parpulov, G. (INSTITUTO MAUÁ DE TECNOLOGIA) ; Liberatore, B. (INSTITUTO MAUÁ DE TECNOLOGIA) ; Zanone, A. (INSTITUTO MAUÁ DE TECNOLOGIA)
RESUMO
Como o gás carbônico é um dos principais causadores do aquecimento global e é um catalisador para as mudanças climáticas e ecológicas, este trabalho tem como objetivo estudar a absorção de CO2 em uma solução aquosa de amina utilizando um microrreator. O microrreator foi construído e montado com o intuito de promover a absorção de CO2 em solução aquosa de monoetanolamina e foi possível observar a absorção do CO2 no solvente, garantindo que ocorresse a captura deste gás mesmo com a diluição do solvente. O mesmo processo será simulado utilizando fluidodinâmica computacional, de modo a validar o modelo computacional proposto e avaliar a hidrodinâmica do microrreator, de forma que seja possível definir qual a melhor geometria e vazões para a captura do CO2.
Palavras Chaves
Gás Carbônico; Microrreator; Absorção
Introdução
O aumento das emissões antrópicas de CO2 contribuiu para uma maior concentração de CO2 na atmosfera nos últimos anos, principalmente devido ao rápido desenvolvimento de indústrias químicas e de energia, a busca por alternativas que minimizem o aquecimento global tornou-se um desafio crítico para a comunidade internacional (Zhu, et al., 2020). O emprego de soluções de alcanoaminas para a remoção de gases ácidos de correntes gasosas é bastante utilizado nos processos de absorção e dessorção (stripping). (ROCHELLE, 2009). Contudo, o processo de absorção apresenta altos custos de investimento e operacional, caracterizando-se pelo alto consumo de energia, principalmente na etapa de regeneração do absorvedor e da dessorção (stripping) do CO2 (KIERZKOWSKA E CHACUK, 2011). Nesse contexto, esse projeto tem por intuito a determinação das melhores condições de operação de um microrreator, capaz de realizar a absorção de CO2 utilizando-se do solvente monoetanolamina – MEA. Além disso, pretende-se determinar a eficiência de absorção e comparar o processo em estudo com outras tecnologias também utilizadas (como colunas de absorção).
Material e métodos
Para a fabricação do microrreator, foram utilizados moldes de acrílico obtidos empregando-se de uma fresadora por comando numérico por computador (Fresadora CNC JCUT-4040 PCB) a partir de diferentes configurações, figura 1(a) e (b). Para o ensaio de captura de CO2, foi utilizado gelo seco em um kitassato conectado a uma bomba peristáltica. Em uma segunda bomba peristáltica, foi conectado água destilada, em um primeiro teste, e o solvente aquoso de monoetanolamina – MEA (98%, Garden Química Indústria e Comércio Ltda) em um segundo teste. Utilizou-se corante também para facilitar a visualização. – Figura 2-c. Foi realizado um teste qualitativo a partir da comparação visual entre os resultados obtidos para a absorção utilizando a água e utilizando o solvente MEA em diferentes concentrações (7,5% e 15,0%). Já o teste quantitativo, contemplou a determinação da concentração das amostras por meio da titulação potenciométrica em triplicata com ácido clorídrico 0,5 M. A titulação foi realizada através de uma tituladora automática TitroLine easy da Schott Instruments. Os pontos de viragem foram identificados pela determinação do ponto de inflexão da curva pH versus volume de ácido. Foi necessário, para isso, determinar o ponto no qual a segunda derivada (Figura 2-b) equivale a zero. Em alguns ensaios, não foi possível identificar o ponto de inflexão pela segunda derivada, devido a oscilações, causadas por erros experimentais, sendo necessário a determinação por meio do ponto mínimo da primeira derivada (Figura 2-a), pois uma vez que a segunda derivada é zero, pode-se afirmar que a primeira derivada é um ponto crítico – ponto de mínimo.
Resultado e discussão
A partir da comparação do ensaio controle, utilizando água ao invés do solvente,
e dos ensaios utilizando MEA, pode-se afirmar que, visualmente, o microrreator é
muito eficiente na absorção de CO2, utilizando-se solução de amina, uma vez que
a bolha deixa de ser visível à olho nu logo no começo do canal (conforme figura
2-d), o que não ocorre quando se utiliza água, no qual a bolha de CO2 permanece
até o final do canal. É interessante comentar que o tamanho da bolha diminui ao
longo do canal do microrreator, o que confirma que o gás está sendo absorvido,
conforme indicado na figura 2-d pelos círculos coloridos.
O primeiro ponto de viragem refere-se à titulação da MEA não reagida e metade do
carbamato de MEA, enquanto a segunda viragem representa a titulação do restante
do carbamato de MEA. Portanto, a concentração de CO2 é dada pelo dobro da
quantidade de ácido utilizada entre a primeira e segunda viragem (V2). Enquanto
a MEA representa a diferença entre o volume gasto na primeira viragem (V1) e V2.
A MEAH+ pode ser determinada pela quantidade de MEA inicial menos a quantidade
de MEA na forma de carbamato. Assim determinamos todas as espécies químicas
presentes na fase líquida.
A quantidade teórica de CO2 que pode ser absorvido em MEA é 0,5 mol CO2/mol de
MEA (SARTORI e SAVAGE, 1983). Considerando o resultado obtido, que indica que
foi atingido 40% da capacidade de absorção do MEA, pode-se afirmar que o
processo realizado ainda apresenta oportunidades de otimização, uma vez que foi
utilizado excesso de solvente, contudo, o sistema foi capaz de absorver 100% do
CO2 disponibilizado para absorção. Por outro lado, estudou-se como essas
variáveis afetam o rendimento do processo através de simulações.
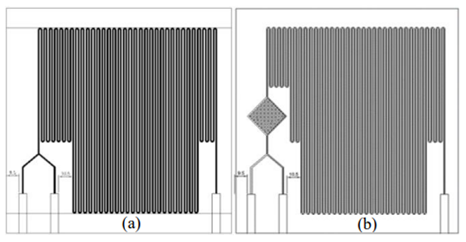
Representação geométrica de diferentes configurações do microrreator.
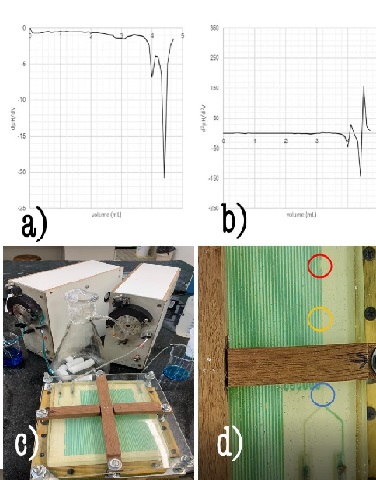
(a) Primeira derivada do pH. (b) Segunda derivada do pH. (c) Sistema experimental (microrreator). (d) Absorção gasosa nos canais do microrreator.
Conclusões
Pode-se afirmar que foi possível visualizar a absorção de CO2 ao longo do processo experimental, atingindo uma eficiência de absorção de 100%. A diminuição das bolhas ao longo do canal do microrreator confirma a absorção do gás, ou seja, o sistema é eficaz do ponto de vista de absorção. O sucesso da absorção foi obtido justamente pela quebra das bolhas na entrada do equipamento. Além disso, pode-se afirmar que com a quantidade de solvente utilizada, ainda seria possível absorver mais CO2 caso fosse necessário, uma vez que só foi utilizado 40% da capacidade de absorção da amina.
Agradecimentos
Agradecemos ao Instituto Mauá de Tecnologia por ceder os laboratórios e equipamentos necessários para o desenvolvimento do microrreator e realização do procedimento experimental.
Referências
Harish Ganapathy, S. S. (2016). Process intensification characteristics of a microreactor absorber for enhanced CO2 capture. Applied Energy, 416-427.
Wallace-Wells, D. (2019). A terra inabitável: uma história do futuro (1ª edição ed.). Companhia das Letras.
Kai Zhu, C. Y. (2020). Theoretical approach to CO2 absorption in microreactors and reactor volume prediction. Chemical Engineering & Processing: Process Intensification.
Alan Gabelman, S.-T. H. (1999). Hollow fiber membrane contactors. Journal of Membrane Science, 159, 61-106.
Morais, S. N. (2018). Captura de CO2 em mistura multicomponente utilizando microrreatores.
Bhown, A. S., & Freeman, B. C. (2011). Analysis and status of postcombustion carbor dioxide capture technologies. Environmental Science & Technology, 45, 8624-8632.
Feron, P. H., & Hendriks, C. A. (2005). Capture process principles and costs. Oil and gas science and technology, 451 - 459.
Yang, H., Xu, Z., Fan, M., Gupta, R., Slimane, R. B., Bland, A. E., & Wright, I. (2008). Progress in carbon dioxide separation and capture. Journal of Environmental Sciences, 14 - 27.
KIERZKOWSKA-PAWLAK, H.; CHACUK, A. Kinetics of CO2 desorption from aqueous N-methyldiethanolamine solutions. Chemical Engineering Journal, n. 168, p. 367-375, 2011.
ROCHELLE, G. T. Amine scrubbing for CO2 capture. Science, v. 325, p. 1652-1654, 2009.
Santos, A. E. (2012). Estudos de Absorção de CO2 com soluções aminadas. Instituto Superior de Engenharia de Lisboa.
SARTORI, G.; SAVAGE, D. W. Sterically hindered amines for CO2 removal from gases. Industrial and Engineering Chemistry Fundamentals, v. 22, n. 2, p. 239-249, 1983.
Katopodes, N. D. (2019). Volume of Fluid Method.


