Autores
Martínez, A.J. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Martin, M. (PASANTIA UNIVERSIDAD NACIONAL DE COLOMBIA) ; Duarte, A. (UNIVERSIDAD NACIONAL DE COLOMBIA)
Resumo
El campo de aplicación de los derivados del fullereno C60 es amplio
debido a la posibilidad de sintetizar una variedad de moléculas que pueden exhibir
propiedades únicas. Para contribuir en la investigación de la síntesis de un nuevo
monoaducto de C60, una fulleropirrolidina, a partir de ácido 5-
aminoisoftalico (1). Se llevó a cabo la síntesis del: 5-aminoisoftalato de
dimetilo (2), 5-(cianometilamino)isoftalato de dimetilo (3), y el
ácido 5-(carboximetilamino)isoftalico (4); donde, 4 y 3 son
moléculas no reportadas previamente en la literatura. La naturaleza del precursor,
y la obtención de los compuestos sintetizados, se verificó mediante las señales en
sus espectros FT-IR, RMN 1H y RMN 13C.
Palavras chaves
Fulleropirrolidina; Síntesis de α-aminoacidos; Iluros de azometino
Introdução
Desde el descubrimiento del fullereno C60, y su posterior producción
en masa, se ha venido desarrollado una química bastante enriquecida a su
alrededor. Una numerosa cantidad de compuestos derivados se han sintetizado por
medio de metodologías y reacciones especializadas en fullerenos. Esto ha
permitido que la química de los fullerenos se extienda a una gran cantidad de
áreas, encontrándose aplicaciones de estos en: fotovoltaica, química de
sensores, química farmacéutica, química cosmética, electrónica, química
supramolecular, etc (LU et al, p. 32, 2021).
Las fulleropirrolidinas son derivados de C60 de gran importancia. Su
estructura es la de un anillo de pirrolidina anclado en la superficie del
fullereno, específicamente por un enlace [6,6], y que puede estar sustituida en
el nitrógeno o en los carbonos adyacentes a este. La obtención de estos
derivados de fullereno se da por medio de una reacción de cicloadición 1,3-
dipolar de un iluro de azometino sobre el fullereno C60. La obtención
de los iluros de azometino suele hacerse a través de la descarboxilación de
sales de iminio derivadas de la condensación de α-aminoácidos con aldehídos
(YAMADA et al, p. 50, 2021). La facilidad de agregar sustituyentes en
tres posiciones diferentes del anillo de pirrolidina, permite alterar la
solubilidad, los niveles de energía, las interacciones moleculares, las
orientaciones en fase sólida y la energía superficial del derivado (LI et al, p.
4161, 2012), y adecuar el monoaducto para un amplio rango de aplicaciones.
El buen desempeño de los de derivados depende de sus características químicas y
estructurales, directamente relacionadas con los grupos funcionales que hacen de
parte su estructura. En el caso del PCBM ([6,6]fenil-C61-butirato de
metilo), un derivado ampliamente investigado, es claro que la presencia del
fragmento fenilo (aromático) es necesaria para su buen desempeño en celdas
fotovoltaicas (KARAKAWA et al, p. 20889, 2014). Moléculas similares al PCBM,
pero con sustituyentes tales como tienilos, furanos, trifenilaminos,
dimetilfluorenos, etc; no han mostrado mejora en el desempeño. En el caso del
CPTA (ácido [60]fulleropirroldinotricarboxilico), se ha demostrado que la
presencia de los grupos carboxilo, altamente hidrofílicos, favorecen el
alineamiento de los niveles de energía entre las capas de las celdas
fotovoltaicas; esto debido a un mejor contacto e interacción entre las capas
que, a su vez, optimiza el transporte de electrones (YANG et al, p. 1903621,
2019). De la misma manera, la presencia de grupos carboxilo o de grupos que
contienen nitrógeno, son fundamentales para el diseño de moléculas por auto-
ensamble y para la estabilización de estructuras supramoleculares por medio de
puentes de hidrogeno o por formación de enlaces covalentes coordinados, en el
caso de estructuras con centros metálicos. Un ejemplo claro es el MOF
bidimensional ensamblado por Echegoyen y colaboradores (PENG et al, p. 160,
2013), en el que dos pares de grupos fenilpiridino unidos a un átomo de
metanofullereno permiten la disponibilidad de los pares electrónicos de los
nitrógenos y una geometría adecuada para la estabilidad del MOF.
Este trabajo permitió la síntesis de las 3 moléculas mencionadas, 2 ,
3, y 4, en el contexto de la obtención de un nuevo derivado del
fullereno C60, de tipo fulleropirrolidina, a partir del ácido 5-
aminoisoftalico (1), un compuesto cuyos grupos funcionales, hacen
previsible que el derivado que se obtenga pueda resultar útil en química
supramolecular y fotovoltaica y ser un aporte a la investigación en síntesis de
nuevos derivados a partir de precursores inexplorados, que abre la posibilidad
al diseño de muchos otros mediante rutas sintéticas similares a la dispuesta en
este trabajo.
Material e métodos
Ácido 5-aminoisoftalico (1)
El ácido 5-aminoisfotalico es un compuesto solido de color blanco, insoluble en
agua y en la mayoría de disolventes orgánicos. Tiene mayor solubilidad en
metanol (28,9g/L).
Síntesis del 5-aminoisoftalato de dimetilo (2)
En un balón, el ácido 5-aminoisoftalico (1) (0.8660 g, 4.8 mmoles) fue disuelto
en metanol (30 mL). El balón fue dispuesto en un montaje para reflujo, provisto
de plancha de calentamiento, baño de aceite y agitación magnética. Luego se
agregó 1 mL de ácido sulfúrico. La mezcla de reacción se mantuvo a 55 °C y con
agitación permanente durante 12 horas. Al cabo de este tiempo, se dejó a
temperatura ambiente se retiró metanol por destilación en un rotaevaporador
hasta obtener una suspensión, luego se agregó agua destilada (20 mL) y se
neutralizó a pH=7.0 con carbonato de sodio. Se observa precipitado blanco el
cual se resuspendió en la solución, dentro de un embudo de decantación y la
suspensión se extrajo con 3 porciones de cloroformo (10 mL). El extracto en
cloroformo se lavó con porciones de agua destilada (5 mL), se secó con sulfato
de sodio anhidro y finalmente se retiró el disolvente por destilación en
rotavapor.
Síntesis del 5-(cianometilamino)isoftalato de dimetilo (3)
En un balón, fue disuelto el 5-aminoisoftalato de dimetilo (2) (0,305 g, 1.4
mmoles), en THF (5 ml), y luego se agregó bromoacetonitrilo (196 µL, 2,8 mmoles)
y DIPEA (480 µL, 2,8 mmoles). El balón se dispuso en un montaje de reflujo como
el descrito en la Sección 2.3.2 a 66 °C durante 20 horas. La reacción fue
monitoreada por CCD hasta observar el agotamiento de 2. Luego se dejó enfriar a
temperatura ambiente, se observa precipitado blanco es filtrado y lavado con 3
veces con THF (5 mL). El disolvente del filtrado es retirado por destilación en
rotavapor obtenido un sólido rojo. Luego, se agregan 10 mL de etanol y con ayuda
de ultrasonido se disuelve el sólido rojo obteniendo una suspensión de un sólido
blanco el cual es filtrado y lavado con 3 porciones de etanol (5 mL).
Síntesis del ácido 5-(carboximetilamino)isoftálico (4)
En un balón, el dimetil 5-(cianometilamino)isoftalato (3) (0.2714 g, 2.02 mmol)
se adicionó en una solución acuosa de NaOH 3M (7 mL) y una solución de H2O2 50%
(3 mL) quedando en suspensión. Se dispuso el balón en un montaje de reflujo con
un papel humedecido con CuSO4 (6H2O) para monitorear la generación de
NH3,
indicativo del desarrollo de la reacción. Al final de la reacción se obtuvo una
solución homogénea amarilla. Esta solución se neutralizó con HCl 4 M, por
adición lenta, gota a gota, de la solución, agitación para homogenizar, y
monitoreo del pH resultante, cada vez. En el transcurso de esa neutralización
precipitó un sólido ligeramente amarillento en el intervalo pH=3.9-4.0. El
sólido es separado, secado y lavado con disolventes orgánicos.
Resultado e discussão
La Figura 1 esquematiza la secuencia de reacciones seguida para la obtención de
4; presenta la numeración de los átomos de carbono en la estructura de
cada compuesto para facilitar la lectura de la asignación de las señales en los
espectros de RMN e IR.
Ácido 5-aminoisoftalico (1)
La pureza de 1 se verificó por CCD y su identidad, por IR, RMN 1H
(400 MHz, MeOD) δ: 7.95 (s, 1H; H2), 7.55 (s, 2H; H4 y
H6). Punto de fusión: 295° (descomposición).
Síntesis del 5-aminoisoftalato de dimetilo (2)
Se obtuvo un sólido blanco, puro (CCD, acetato de etilo (EtOAc)-éter de petróleo
40-60 (éter de pet.) 1:3; /sílicagel G (SiO2), Rf: 0.48) con un 92%
de rendimiento. FT-IR (KBr), ῡ(cm-1) = 3459 (νN-H), 3366 (νN-H),
2952 (ν=C-H), 1710 (νC=O), 1245 (ν=C–O). RMN 1H (400 MHz, MeOD) δ
7.90 (s, 1H, H2), 7.53 (s, 2H; H4 y H6), 3.91
(s, 6H; OCH3). RMN 1H (400 MHz, CDCl3) δ: 8.08
(s, 1H; H2), 7.54 (s, 2H; H4 y H6), 3.94 (s,
7H; OCH3 + NH solapados).
Síntesis del 5-(cianometilamino)isoftalato de dimetilo (3)
Se obtiene un sólido puro (CCD, EtOAc-Eter de Pet. 1:3; /SiO2, Rf:
0.36) con un 61% de rendimiento. FT-IR (KBr), ῡ(cm-1) = 3381 (νN-H),
2964 (ν =C-H), 2259 (ν-C≡N), 1724 (ν C=O). RMN 1H (400 MHz,
CDCl3) δ: 8.22 (s, 1H; H2), 7.59 (s, 2H; H4 y
H6), 4.30 (t, J ≈ 6.9 Hz, 1H; NH), 4.24 (d, J ≈ 6.2 Hz, 2H;
H9), 3.97 (s, Hz, 6H; OCH3). RMN 13C (100 MHz,
CDCl3) δ: 166.15 (C7 y C8), 145.32
(C5), 131.94 (C1 y C3), 122.18 (C2),
118.36 (C3 y C6), 116.19 (C12; CN), 52.49
(C10 y C11; OCH3), 32.52 (C9).
Síntesis del ácido 5-(carboximetilamino)isoftálico (4)
Se obtuvo un sólido ligeramente amarillento. Rendimiento: 80%. RMN 1H
(400 MHz, DMSO) δ 7.73 (s, 1H; H2), 7.28 (s, 2H; H4 y
H6), 3.67 (s, 2H; CH2-α NH, CN). RMN 13C (101
MHz, DMSO) δ 173.19 (C10), 168.84 (C7 y C8),
148.78 (C5), 134.19 (C1 y C3), 118.47
(C2), 116.32 (C6 y C4), 46.67 (C9).
El compuesto 4 fue caracterizado por medio de espectroscopia RMN
13C. Las señales atribuibles a los carbonos de los grupos carboxilo,
en 172.19 ppm y 168.84 ppm, y la desaparición de la señal del carbono del
nitrilo (116.19 ppm, en RMN 13C de 3), comprueban la
hidrolisis efectiva de 3 para producir el α-aminoácido 4 (en el
espectro RMN 13C de 3 aparece una sola señal de carbono de
grupos carboxílicos, en 166.15 ppm). La simetría de la estructura de 4,
justifica la aparición de solo cuatro señales de carbonos aromáticos
químicamente no equivalentes (148,78 ppm, 134,19 ppm, 118.47 ppm, y 116.32 ppm).
La señal en 46.67 ppm indica la presencia del grupo metileno del sustituyente
carboximetilamino, -NHC2HCOOH. El espectro RMN 1H
del compuesto
4 se observa en la Figura 2. Se observan dos señales de los protones del
anillo aromático en 7.73 ppm y 7.28 ppm, singletes que integran para 1H y 2H
respectivamente, estas señales son características del anillo en los compuestos
1, 2, 3 y 4 debido a que la sustitución del anillo
no fue alterada. Se observa la ausencia de la señal de los protones de los
grupos metoxilo presentes en 3.97 ppm (6H) en el espectro RMN 1H del
éster de dimetilo de 3. En este espectro se observa también la
desaparición de la señal de los protones del grupo amino (4.30 ppm, en RMN
1H de 3) y la aparente ausencia de acoplamiento de la señal
del metileno en 3.67 ppm que se presenta como un singlete. Las señales de los
protones unidos a nitrógeno, N-H, suelen ser ensanchadas debido al momento
cuadrupolar del nitrógeno-14 (I=1) y a otros factores como interacciones con el
solvente, la concentración, temperatura, la posibilidad de formar puentes de
hidrogeno, etc (JACOBSEN, N., p. 32, 2017). Que no se detecte la señal de NH en
el espectro RMN 1H de 4 puede obedecer a este fenómeno, el
cual es similar al debido momento cuadrupolar del oxígeno-17 (I=5/2), que
ilustra la ampliación e intensificación de la señal en 6.27 ppm de la Figura 2.
Cabe resaltar que la reacción de alquilación de amina (de 2 a 3)
evidencia la acción de la base de Hunig, N,N-diisopropiletilamina (DIPEA), que
favorece la alquilación selectiva y directa de la amina para la obtención de α-
aminoácidos N-sustituidos (después de la hidrolisis). En principio, el hecho de
sustituir el uso de DIPEA por el de trietilamina no dio buenos resultados, no se
observó reacción; en otros casos suele generar problemas como bajos
rendimientos, baja especificidad o la formación de sales de amonio cuaternario
(BHATTACHARYYA et al, p. 18223, 2014). Los inconvenientes en el uso de la
trietilamina se explican principalmente porque la nucleofilicidad de esta base
compite con 2 en el ataque nucleofílico al haluro de alquilo (el
bromoacetonitrilo). La N,N-diisopropiletilamina posee la basicidad necesaria y
el impedimento estérico apropiado sobre el nitrógeno para sustraer el protón y
formar la sal de amonio cuaternario, sin que su nucleofilicidad le permita
competir mejor en el ataque nucleofílico mencionado. De esta manera, se halla
recomendable esta metodología para la obtención directa de gran variedad de
aminoácidos precursores de fulleropirrolidinas N-sustituidas.
El compuesto 1 presenta características llamativas que han sido
aprovechadas por otros autores. Este compuesto es fluorescente bajo longitudes
de onda alrededor de 365nm (ultravioleta) y admite autoensamblaje en MOFs (SHETA
et al, p. e4777, 2019). En general, todos los productos de la ruta sintética
desarrollada en este también presentan fluorescencia. Por lo tanto, un derivado
de fulleropirrolidina sintetizado con este precursor puede llegar a presentar
propiedades similares y potenciales aplicaciones en química supramolecular,
química de sensores y demás.
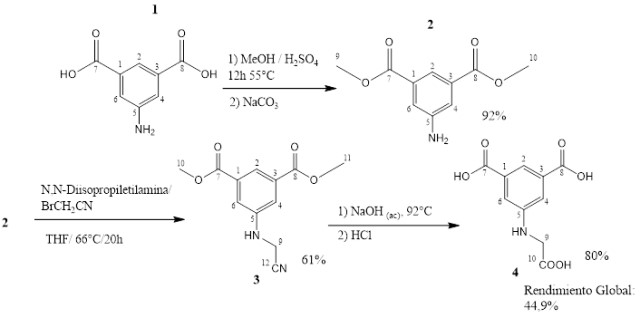
Esquema de la ruta de síntesis del ácido 5- (carboximetilamino)isoftalico (4).
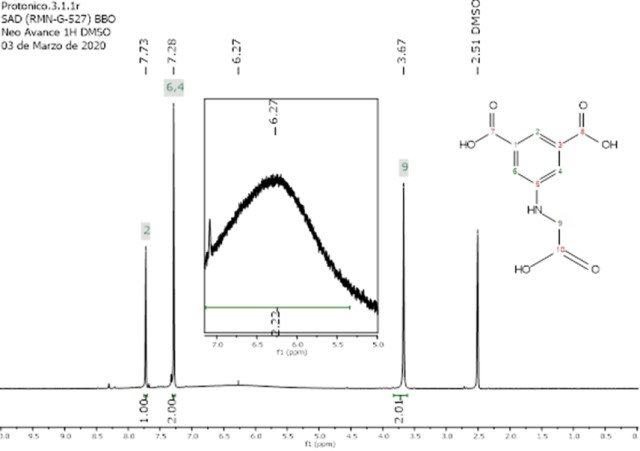
Espectro RMN 1H del ácido 5- (carboximetilamino)isoftalico (4). Tomado en DMSO- d6, 99.5%-d con TMS como estándar de referencia interna.
Conclusões
La metodología propuesta para la síntesis del compuesto 4 (Rto. Global 44,9%),
precursor para la síntesis de un nuevo derivado de fulleropirrolidina N-
sustituido, resulta en la síntesis y caracterización de dos moléculas nuevas que
no habían sido reportadas anteriormente: el compuesto 3 y 4. La síntesis del
compuesto 3 se hace por medio de la alquilación del grupo amino del compuesto 2,
el uso de DIPEA permite una alquilación directa generando un producto de fácil
separación y alta pureza. Es recomendable el uso de DIPEA para la síntesis de α-
aminoácidos. La posterior hidrolisis de 3 y posterior separación del producto, 4,
por medio de la alteración del pH es un método de separación efectivo y simple.
Todas las moléculas sintetizadas fueron caracterizadas por medio de espectroscopia
IR (1-3), RMN 1H (1-4) y RMN 13C (3-4) y todos presentaron fluorescencia. Se
obtiene el compuesto 4, un precursor para la reacción de iluros de azometino sobre
C60, por medio de la ruta de síntesis propuesta en este trabajo que permitiría
también la síntesis de una gran variedad de nuevos precursores y,
consecuentemente, derivados de fulleropirrolidina.
Agradecimentos
Al Prof. Dr. Eliseo Avella Moreno; a la Universidad Nacional de Colombia, Facultad
de Ciencias (proyecto No. 45627); y al Departamento Administrativo de Ciencia,
Tecnología e Innovación-COLCIENCIAS (proyecto No. 110171249591)
Referências
BHATTACHARYYA, S.; PATHAK, U.; MATHUR, S.; VISHNOI, S.; JAIN, R.. Selective N-alkylation of primary amines with R–NH2·HBr and alkyl bromides using a competitive deprotonation/protonation strategy. RSC Advances, 4(35), p.18229, 2014.
JACOBSEN, N. NMR data interpretation explained : understanding 1D and 2D NMR spectra of organic compounds and natural products. Hoboken, New Jersey: John Wiley & Sons, Inc., pp.15-32, 2017.
KARAKAWA, M.; NAGAI, T.; ADACHI, K.; IE, Y.; ASO, Y. N-phenyl[60]fulleropyrrolidines: alternative acceptor materials to PC61BM for high performance organic photovoltaic cells. J. Mater. Chem. A, 2(48), pp.20889-20895, 2014.
LI, C.; YIP, H.; JEN, A. Functional fullerenes for organic photovoltaics. Journal of Materials Chemistry, 22(10), p.4161, 2012.
LU, X.; AKASAKA, T.; SLANINA, Z. Handbook of fullerene science and technology. 1st ed. Singapore: Springer Singapore, pp.1-32, 2021.
PENG, P.; LI, F.; NETI, V.; METTA-MAGANA, A; ECHEGOYEN, L. Design, Synthesis, and X-Ray Crystal Structure of a Fullerene-Linked Metal-Organic Framework. Angewandte Chemie International Edition, 53(1), pp.160-163, 2013.
SHETA, S.; EL-SHEIKH, S.; ABD-ELZAHER, M.; WASSEL, A. A novel nano-size lanthanum metal-organic framework based on 5-amino-isophthalic acid and phenylenediamine: Photoluminescence study and sensing applications. Applied Organometallic Chemistry, 33(4), p.e4777, 2019.
YAMADA, M.; NAGASE, S.; AKASAKA, T. Functionalization of Fullerenes: Addition Reactions. In: Lu, X., Akasaka, T., Slanina, Z. (eds) Handbook of Fullerene Science and Technology. Springer, Singapore, 2021.
YANG, Z.; ZHONG, M.; LIANG, Y.; YANG, L.; LIU, X.; LI, Q.; ZHANG, J.; XU, D. SnO 2 ‐C 60 Pyrrolidine Tris‐Acid (CPTA) as the Electron Transport Layer for Highly Efficient and Stable Planar Sn‐Based Perovskite Solar Cells. Advanced Functional Materials, 29(42), p.1903621, 2019.
















