Autores
Silva, A.T. (UTFPR) ; Rosa, M.F. (UNIOESTE) ; Lobo, V.S. (UTFPR)
Resumo
O solvente tem grande influência nos dados espectrofotométricos como absorção e
emissão, provocando uma alteração na posição, intensidade e forma da banda de
absorção ao variar a polaridade do solvente, um fenômeno conhecido como
solvatocromismo. Este trabalho teve por objetivo estudar o efeito dos
substituintes no comportamento solvatocrômico dos derivados de chalcona, 1-(4-
metoxifenil)-3-[4-(dimetilamino)fenil]-prop-2-en-1-ona (chalc22), 1-(4-
aminofenil)-3-[4-(dimetilamino)fenil]prop-2-en-1-ona (chalc32) e
1-(4-bromofenil)-3-[4-(dimetilamino)fenil]prop-2-en-1-ona (chalc52). Foi
observado que os diferentes substituintes não apresentaram efeito significativo
nas propriedades solvatocrômicas, independente das suas propriedades elétrons
doadoras ou elétron aceptoras.
Palavras chaves
benzilidenoacetofenonas; solvatocromismo; sensores de ambiente
Introdução
O solvatocromismo descreve as mudanças na posição dos máximos das bandas de
absorção (e emissão) dependendo da polaridade do meio. Um deslocamento para
menores comprimentos de onda com aumento da polaridade do solvente é conhecido
como deslocamento hipsocrômico, caracterizando um solvatocromismo negativo.
Deslocamentos para maiores comprimentos de onda são conhecidos como deslocamento
batocrômico, caracterizando um solvatocromismo positivo (Buncel et al.,
1990; Reichardt, 1994).Além das interações específicas entre a molécula e o
solvente, muitas moléculas podem formar um
estado de transferência interna de cargas, ou um estado de transferência interna
de cargas com rotação. Se a molécula possui um grupo doador de elétrons (D) e um
grupo aceptor de elétrons (A),após a excitação pode existir um aumento na
separação de cargas da molécula. Se o solvente é polar, então as espécies com
separação de cargas podem tornar-se o estado de mais baixa energia. Em um
solvente não-polar as espécies sem separação de cargas, podem ter energia mais
baixa. Então, o papel da polaridade do solvente não é somente diminuir a energia
do estado excitado devido a efeitos gerais de solvente, mas também governar qual
estado tem a energia mais baixa (Reichardt,2003). Dimroth et al. (1963)
propuseram um parâmetro de polaridade de solvente denominado ET(30)
que era baseado na banda de absorção mais deslocada para maiores comprimentos de
onda do corante N-piridínio fenolato betaína. A escala de ET(30) era
dada na dimensão de kcal mol-1, uma unidade não recomendada pelo SI.
Para contornar esta limitação foi proposta a escala ETN,
que trabalha com valores normalizados e, portanto, é adimensional. As
benzilidenoacetofenonas (1,3-difenil-prop-2-enonas), mais conhecidas como
chalconas, são compostos comumente encontrados na natureza (Sobrinho & Ferreira,
2002), que podem ser sintetizadas em laboratório pelo método de condensação
Claisen-Schmidt (Solomons & Fryhle, 2010). Estruturalmente estes compostos são
cetonas α,β-insaturadas, que apresentam dois anéis aromáticos interligados por
três carbonos, denominados anel A e anel B (Figura 1), podendo apresentar
diferentes substituintes tanto em um quanto outro anel. Devido ao amplo espectro
de atividades biológicas, as chalconas são alvo de vários estudos de síntese,
isolamento de fontes naturais, identificação e investigação de propriedades
biológicas. Na literatura são encontrados vários registros sobre as diferentes
atividades biológicas, como os relatados nos trabalhos de revisão de Singh et
al. (2014), Sharma et al. (2016), Mahapatra & Bharti (2016), Gaonkar & Vignesh
(2017) e Rocha et al. (2020). Dentre as principais bioatividades mencionadas
encontram-se atividades antiviral, inseticida, mutagenicidade, anti-
inflamatória, anti-histamínica, anti-ulcerogênica, antimicrobiana,
antiprotozoária, quimiopreventiva e antitumoral (Piñero et al.,2006; Won et al,
2005; Ammaji et al., 2020).O objetivo deste trabalho é analisar o efeito nas
propriedades solvatocrômicas em chalconas com diferentes substituintes no anel
A, mantendo o mesmo substituinte no anel B, em função de suas características
doadoras ou aceptoras de carga, por meio dos seus espectros de absorção.
Material e métodos
As chalconas utilizadas neste experimento, mostradas na Figura 1, foram
sintetizadas por meio da reação de condensação de Claisen-Schmidt, purificadas
por recristalização em etanol e caracterizadas por ponto de fusão em tubo
capilar (Fisatom 430D) e FTIR (Perkin-Elmer Frontier) empregando-se a técnica de
ATR. Para cada uma das chalconas sintetizadas foram preparadas soluções-estoque
na concentração de 5 × 10-3 mol L-1 em éter etílico. Desta
solução foram retiradas dez alíquotas de 100 μL, que foram transferidas para
balões volumétricos de 10 mL. Após a evaporação do solvente os balões foram
avolumados com solventes orgânicos de diferentes polaridades, obtendo-se ao
final soluções na concentração de 5 × 10-5 mol L-1.Os
solventes empregados neste estudo, e seus respectivos valores de ET
N, entre parênteses, foram: ciclohexano [CHX] (0,006), metil-t-butil
éter [MTBE] (0,124), 1,4-dioxana [DIOX] (0,198), acetato de etila [ACET]
(0,228), diclorometano [DCM] (0,309), N,N-dimetilformamida [DMF] (0,386),
dimetilsulfóxido [DMSO] (0,444), acetonitrila [ACN] (0,460), isopropanol [ISOP]
(0,546) e n-propanol [PROP] (0,617). Todos os solventes eram grau PA e foram
estocados sobre peneira molecular ou CaSO4 anidro para remoção de
traços de água.Os espectros de absorção foram obtidos em um espectrofotômetro
Shimadzu UV1800 empregando-se uma cubeta de quartzo de 10 mm de caminho óptico e
varrendo-se o intervalo de 200 a 500 nm. Os espectros de absorção foram
normalizados para melhor visualização do comprimento de onda onde ocorre os
máximos de absorção (λmax) para efeito de comparação.
Para a análise dos resultados foram traçados gráficos de λmax (nm) x
ETN empregando-se planilha eletrônica Excel for Windows®.
Resultado e discussão
Os três derivados apresentaram coloração variando do amarelo pálido (chalc22 e
chalc52) ao amarelo vivo (chalc32). Os pontos de fusão obtidos foram 130, 170 e
145 oC, respectivamente para chalc22, chalc32 e chalc52 (PF da
literatura: 169-170 oC Liu et al., 2006 para chalc32 e 143
oC Arshad et al., 2017, para chalc52). Foi observado
experimentalmente, para os três derivados estudados, o deslocamento batocrômico
do máximo de absorção com o aumento da polaridade do solvente, caracterizado
como um solvatocromismo positivo, como exemplificado para o derivado chalc22
(Figura 2a). As Figuras 2b, 2c e 2d mostram o gráfico de λmax (nm) x
ETN para os três derivados estudados. Observa-se
claramente que todos apresentaram coeficiente angular positivo, característico
de um solvatocromismo positivo. Pelo estudo realizado, os três derivados
apresentaram coeficientes angulares próximos, indicando, neste caso, que o
substituinte no anel proveniente da cetona (anel A) apresenta pouca, ou nenhuma
influência sobre o comportamento solvatocrômico das chalconas, isto também pode
ser verificado pelo valor de Δλmax, que é aproximadamente igual para
todos os derivados (36 nm para chalc22, 37 nm para chalc32 e 39 nm para
chalc52). Gaber et al. (2008) observaram o mesmo comportamento para um
derivado chalcônico semelhante, com a presença do grupo dimetilamino no anel B e
o grupo tienil no lugar do anel A. Segundo os autores este comportamento
solvatocrômico é característico de uma transição permitida do tipo π→π* com
característica de transferência de carga (ICT) de um grupo doador de elétrons
(D) para um grupo aceptor de elétrons (A), formando uma estrutura com
características zwiteriônica, sendo então mais bem estabilizada por
solventes polares, diminuindo assim a diferença de energia entres os estados
HOMO e LUMO, e deslocando o máximo para maiores comprimentos de onda. No nosso
estudo o grupo dimetilamino (NMe2) atua como doador de carga, e
esperava-se que a presença do Br no anel A fosse atuar como aceptor de carga,
acarretando uma maior separação de cargas. Entretanto o que se verificou
experimentalmente foi que o Br praticamente não apresentou influência
no comportamento solvatocrômico, principalmente quando comparado aos
substituintes dos outros derivados, chalc22 (OMe) e chalc32 (NH2),
que são reconhecidos doadores de carga por ressonância, e cujos Δλmax
, para o mesmo intervalo de ETN, foram próximos. Estudos
anteriores de nosso grupo, tendo átomo de flúor no anel A e o grupo dimetilamino
no anel B, mostraram comportamento semelhante, ou seja, a presença do átomo
retirador de elétrons no anel A não acarretou aumento do efeito solvatocrômico
quando comparado ao derivado semelhante, porém sem o átomo de flúor. Neste caso
o Δλmax observado foi de 40 nm, estando próximo dos valores
encontrados neste estudo. Desta forma podemos inferir que o grupo que atua como
aceptor de carga na estrutura chalcônica seja a carbonila, como proposto por El-
Daly et al. (2013), e, portanto, somente o substituinte no anel B
apresentará algum efeito no comportamento solvatocrômico, dependendo da sua
característica doadora ou aceptora de carga.
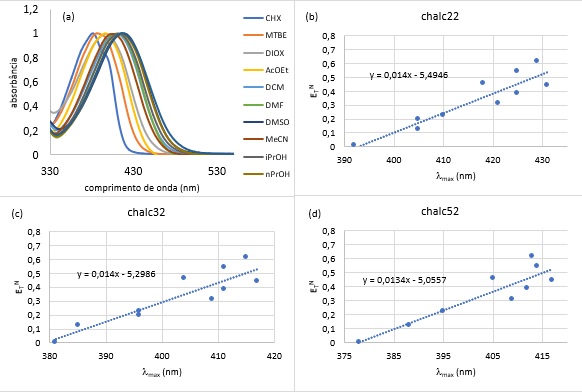
(a) Espectros de absorção do derivado chalc22 em 10 diferentes solventes; Gráficos de lmax x ETN para os derivados chalc22(b), chalc32(c) e chalc52(d)
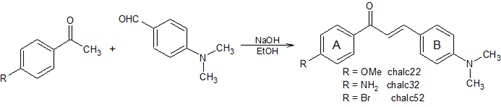
Rota sintética das chalconas estudadas neste trabalho, mostrando o anel A e anel B
Conclusões
Este estudo do comportamento solvatocrômico de três derivados de chalcona
demonstrou que estes compostos apresentam deslocamento positivo do λmax quando
estão presentes na estrutura um grupo doador de carga no anel B, atuando a
carbonila cetônica como aceptora, independente da presença ou não de grupos
aceptores de carga no anel A.
Agradecimentos
À CAPES e Fundação Araucária pelo auxílio financeiro.
Referências
AMMAJI, S.; MASTHANAMMA, S.; BHANDARE, R. R.; ANNADURAI, S.; SHAIK, A. B. Antitubercular and antioxidant activities of hydroxy and chloro substituted chalcone analogues: Synthesis, biological and computational studies. Arabian Journal of Chemistry, v. 15, 103581, 2020.
ARSHAD, M.N.; AL-DIES, A.A.M.; ASIRI, A.M.; KHALID, M.; BIRINJI, A.S.; AL-AMRY, K.A.; BRAGA, A.A.C. Synthesis, Crystal structures, spectroscopic and nonlinear optical properties of chalcone derivatives: A combined experimental and theoretical study. Journal of Molecular Structure, v. 1141, 142-156, 2017.
BUNCEL, E.; RAJAGOPAL, S. Solvatochromism and solvent polarity scales. Accounts of Chemical Research, v. 23, n° 7, p. 226-231, 1990.
EL-DALY, S.; ASIRI, A.M.; OBEID, A.Y.; KHAN, S.A.; ALAMRY, K.A.; HUSSEIN, M.A.; AL-SEHEMI, A.G. Photophysical parameters and laser activity of 3(4-dimethylamino-phenyl)1-1-(2,5-dimethyl-thiophen-3-yl)-propenone (DDTP): A new laser dye. Optics & Laser Technology, v. 45, 605-612, 2013.
GABER, M.; EL-DALY, S.A.; FAYED, T.A.; EL-SAYED, Y.S. Photophysical properties, laser activity and photoreactivity of a heteroaryl chalcone. A model of solvatochromic fluorophore. Optics & Laser Technology, v. 40, 528-537, 2008.
GAONKAR, S.L. & VIGNESH, U.N. Synthesis and pharmacological properties of chalcones: a review. Research on Chemistry Intermediate, 43, 6043-6077, 2017.
MAHAPATRA, D.K. & BHARTI, S.K. Therapeutic potential of chalcones as cardiovascular agents. Life Sciences, 148, 154-172, 2016.
NIU, C.-G.; GUAN, A.-L.; ZENG, G.-M.; LIU, Y.-G.; LI, Z.-W. Fluorescence water sensor based on covalente immobilization of chalcone derivative. Analitica Chimica Acta, v. 577, 264-270, 2006.
PANNIPARA M.; ASIRI, A. M.; ALAMRY, K. A.; ARSHAD, M. N.; EL-DALY, S. A. Spectroscopic Investigation, Effect of Solvent Polarity and Fluorescence Quenching of a New D-π-A Type Chalcone Derivative. Journal of Fluorescence, v. 24, 1629-1638, 2014.
PIÑERO, J.; TEMPORAL, R. R.; SILVA-GONÇALVES, A. J.; JIMÉNEZ, I. A.; BAZZOCCHI, I. L.; OLIVA, A.; PEREIRA, A.; LEON, L. L.; VALLADORES, B. New administration model of trans-chalcone biodegradable polymers for the treatment of experimental leishmaniasis. Acta Tropica, 98, p. 59-65, 2006.
REICHARDT, C. Solvents and Solvent Effects in Organic Chemistry. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim, 2003.
REICHARDT, C. Solvatochromic Dyes as Solvent Polarity Indicators. Chemical Reviews, v. 94, n. 8, p. 2319-2358, 1994.
ROCHA, S.; RIBEIRO, D.; FERNANDES, E. FREITAS, M. A systematic review on anti-diabetic properties of chalcones. Current Medicinal Chemistry, 27, 2257-2321, 2020.
SHARMA, R.; KUMAR, R.; KODWANI, R.; KAPOOR, S.; KHARE, A.; BANSAL, R.; KHURANA, S.; SINGH, P.; ANAND, A.; KUMAR, V. Recent developments in biological activities of chalcones: A mini review. European Journal of Medicinal Chemistry, 85, 758-777, 2014.
SINGH, S.; THOMAS, J.; ROY, B.; PHARTYAL, R.; SALUJA, S.; KUMAR, S. A review on mechanisms of anti-tumor activity of chalcones. Anti-Cancer Agents in Medicinal Chemistry, 16, 200-211, 2016.
SOBRINHO, D. C. & FERREIRA, J. C. N.; Fotoquímica de chalconas fluoradas no estado sólido. Química Nova, v. 25, no . 1, p. 62-68, 2002.
SOLOMONS, T. W. G; FRYHLE, C. B.: Química orgânica. V.2. Rio de Janeiro: LTC, 2006.
WON, S. J.; LIU, C.-T.; TSAO, L.-T.; WENG, J.-R.; KO, H.-H.; WANG, J.-P.; LIN, C.-N. Synthetic chalcones as potential anti-inflammatory and cancer chemopreventive agents. European Journal of Medicinal Chemistry, 40, 103-112, 2005.
















