Autores
dos Santos, C.V.P. (UFRJ) ; de Mattos, M.C.S. (UFRJ)
Resumo
Lactonas estão presentes em substâncias com atividade biológica naturais e
sintéticas. Sua síntese costuma utilizar reagentes caros e/ou tóxicos, por
exemplo, ácidos de Lewis fortes e catalisadores de ouro ou ciclopentadienona-
ferro. Os substratos também são variados, sendo comum o uso de ácidos
carboxílicos insaturados e hidróxi-ácidos carboxílicos.
Nossa abordagem utiliza o ácido tricloroisocianúrico (TCCA) para transformar
dióis em lactonas em condições suaves e com reagentes de baixa toxicidade e
seguros. O TCCA é comercializado como cloro para piscina na forma de pastilhas
ou discos com elevada pureza.
Foram testados 6 dióis e obtidas quatro lactonas com conversões cromatográficas
entre 93->99% em reações a temperatura ambiente e em até 4 horas utilizando TCCA
e piridina.
Palavras chaves
Lactona; Álcool; Ácid tricloroisocianúrico
Introdução
Lactonas são definidas pela IUPAC como ésteres cíclicos de ácidos carboxílicos,
sendo estes ciclos saturados ou não. A nomenclatura comum para lactonas segue a
indicação α, β, etc, a partir do carbono vizinho à carbonila seguido do prefixo
vulgar do ácido carboxílico associado.
As lactonas estão presentes em substâncias que possuem atividade biológica
(SARTORI et al., 2021), dentre elas: antibióticos, anti-inflamatórios,
herbicidas, inibidores de enzimas, tripanocida, leishmanicida, antitumorais,
além de usos industriais como aromatizantes e precursores de polímeros.
Há na literatura exemplos de preparações de lactonas a partir de variados
substratos. A halolactonização (GONZALEZ et al., 1990) parte de um ácido
carboxílico insaturado para obter uma halolactona (bromo ou iodo) em condições
suaves. A partir de um hidróxi-ácido graxo (MUKAIYAMA et al., 1976) e refluxo
com um sal de piridíneo é possível obter a macrolactona em bom rendimento. O uso
de anidrido aromático com grupo desativante associado a um forte ácido de Lewis
como Ti(IV) transforma (SHIINA et al., 2004) hidróxi-ácidos em lactonas. O uso
de catalisador de ouro (SHU et al., 2010) transforma álcoois com alquinos
terminais em butirolactonas, enquanto que o uso de NIS em condições radicalares
(GAO et al., 2014) permite a lactonização de ácidos 2-arilbenzoicos. A obtenção
de lactonas a partir de dióis é possível a partir do uso de catalisadores a
ciclopentadienona-ferro (TANG et al., 2020).
O ácido tricloroisocianúrico (1,3,5-tricloro-1,3,5-triazina-2,4,6-triona, Figura
1, TCCA), é um heterociclo da classe das N-cloroimidas. Se apresenta
como um sólido branco com odor de Cl2 e é comumente disponibilizado
comercialmente sob a forma de grânulos ou discos compactos (esta é a forma
disponível no varejo como “cloro de piscina” com cerca de 95% de TCCA). A
redução do TCCA gera o ácido cianúrico como subproduto inócuo que pode ser
reciclado ou simplesmente descartado por ser biodegradável – de 95-98% é
transformado microbiologicamente em CO2 após 72 h (SALDICK, 1974).
Devido a presença de três equivalentes de cloro eletrofílico, alta reatividade,
baixo custo, segurança e conveniência de manipulação e estocagem o TCCA é uma
ótima escolha para reações como eletrófilo (MENDONÇA et al., 2011), nucleófilo
(associado) (SINDRA et al., 2020) e como potente oxidante (DOS SANTOS e DE
MATTOS, 2021) de álcoois.
Hiegel estudou oxidações de álcoois secundários e primários com TCCA, obtendo
respetivamente cetonas (HIEGEL e NALBANDY, 1922) e ésteres metílicos (HIEGEL e
GILLEY, 2003). Neste último estudo ele apontou para a possibilidade de obter
lactonas a partir de dióis utilizando três casos e argumentou a possiblidade da
lactona ser obtida a partir da oxidação do lactol pelo TCCA. Em um estudo muito
limitado (KONDO et al., 1995) foi comparada a formação de butirolactona a partir
de butano-1,4-diol e diferentes N-cloroimidas, em que o TCCA apresentou a
melhor conversão cromatográfica (85%) quando comparado a N-
bromosuccinimida (57%), N-bromoacetamida (82%) e N,N-
diclorobenzeno-sulfonamida (80%).
A partir do nosso interesse prévio em reações de oxidação de álcoois (DOS SANTOS
e DE MATTOS, 2021) e dos resultados de Hiegel, estamos propondo uma metodologia
conveniente para a obtenção de lactonas a partir da oxidação de dióis com TCCA e
piridina.
Material e métodos
Para o estudo de condições de reação foram empregados o butano-1,4-diol e o
cis-ciclo-hexano-1,2-dimetanol como substratos. Partindo de 0,002 mol (2
mmol) de substrato e da mistura de solventes diclorometano/acetonitrila, foram
avaliados a equivalência molar de TCCA, a proporção e volume da mistura de
solventes, uso e equivalência de bases orgânicas, tempos de reação e condições
térmicas da reação. O curso da reação foi analisado por cromatografia gasosa
acoplada a espectrometria de massas (CG-EM) por ressonância magnética nuclear
(RMN) de 1H e 13C para amostras isoladas.
Procedimento padrão: a um balão de 25 mL de capacidade contendo o diol (2 mmol),
água destilada (20 mmol) e base (2 mmol, quando presente) foram adicionados
diclometano (5 - 7 mL), acetonitrila (5 - 3 mL) e TCCA granulado (1,67 mmol) e a
mistura foi agitada à temperatura ambiente por 2-4 horas. Ao término da reação a
solução sobrenadante foi extraída com clorofórmio: isopropanol (3:1) e água
destilada (2 x), a fase orgânica seca (Na2SO4 anidro) e
filtrada em coluna de sílica com pequena camada de alumina ácida no topo
utilizando diclorometano como eluente. Após rotaevaporação, o óleo amarelado
obtido foi analisado por CG-EM e RMN.
Resultado e discussão
A otimização da proporção de solventes, de água destilada e de TCCA foi
realizada com butano-1,4-diol como substrato (Tabela 1). Os resultados são
referentes às conversões cromatográficas.
As condições utilizadas na Entrada 1 foram herdadas das utilizadas com sucesso
para a oxidação de álcoois benzílicos e secundários com TCCA (DOS SANTOS e DE
MATTOS, 2021). Mesmo com apenas 0,80 mmol foi possível a conversão de 78% de
butirolactona e observar, através de injeção do cru da reação, a presença de
cloreto de 4-hidroxibutiroila como intermediário de reação.
O aumento de TCCA levou à melhora das conversões, mas a ausência de água foi no
sentido contrário. Na verdade, os melhores resultados foram obtidos com o
aumento de 14 mmol para 20 mmol de água, o que é interessante uma vez que o a
produção de ácido carboxílico como subproduto não ocorre nas condições ótimas.
Apesar dos bons resultados com a proporção 5 mL de diclorometano e 5 mL de
acetonitrila, foi necessário diminuir a proporção de acetonitrila devido a
dificuldades encontradas durante o processo de isolamento. Assim, o uso de 3 mL
de acetonitrila e 7 mL de diclorometano permitiu alcançar resultados
satisfatórios com 4 h de reação. Entretanto, a adição de 2 mmol de piridina
acompanhada de aumento de TCCA se mostrou superior por eliminar a formação de
pequenas quantidades de subprodutos identificados nas demais condições.
A otimização do uso de bases foi feita utilizando o cis-ciclo-
hexano-1,2-dimetanol (Tabela 2) devido a maior possibilidade de α-cloração.
As entradas 1 (excesso de 20% molar de cloro ativo) e 2 (excesso de 50% molar de
cloro ativo) demonstraram que o aumento de TCCA teve pouco impacto no consumo do
diol. O uso de acetona, uma base muito suave utilizada na oxidação de álcoois
secundários (DOS SANTOS e DE MATTOS, 2021) teve resultado insatisfatório, assim
como o uso de trietilamina.
A piridina se mostrou uma base mais eficiente que as demais, sendo os melhores
resultados obtidos com o uso de 2 mmol de piridina e 1,67 mmol de TCCA (excesso
de 50% molar de cloro ativo, Tabela 2, Entrada 8), sendo esta condição a eleita
como condição padrão para o uso de piridina.
A partir dos resultados de otimização foram realizadas oxidações com TCCA e
diferentes dióis. O Esquema 1 resume os resultados obtidos.
Apesar dos bons resultados para síntese de butirolactona e cis-hexa-
hidro-isobenzofuran-1(3H)-ona ao utilizar piridina, as sínteses de
valerolactona e caprolactona não se beneficiaram e igual forma. Para as reações
em que não se utilizou piridina a quantidade TCCA empregada foi diminuída de
1,67 mmol para 1,47 mmol.
Durante a síntese de caprolactona foi observada a produção concorrente do éster
a até 20,8%. O aumento do volume da reação de 10 mL para 20 mL, sendo 14 mL de
diclometano e 6 mL de acetonitrila, diminuiu bastante a ocorrência desse
subproduto.
A tentativa de obter amidas através da oxidação de aminoálcoois, notadamente
N,N-2-etanolamina e N,N,N-tri-2-etanolamina
resultou em misturas complexas, sendo observada a presença de cloretos de acila
no meio reacional.
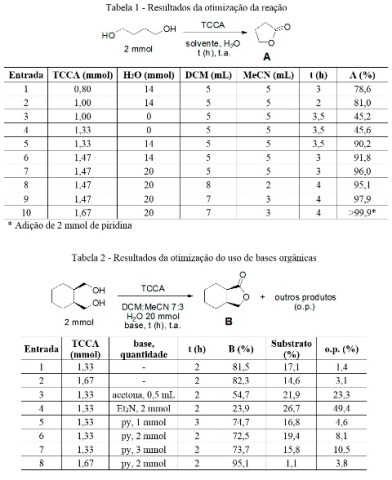
A Tabela 1 resume as proporções de solventes, água, TCCA e tempos de reação, enquanto a Tabela 2 resume o uso e proporção de bases orgânicas com TCCA.
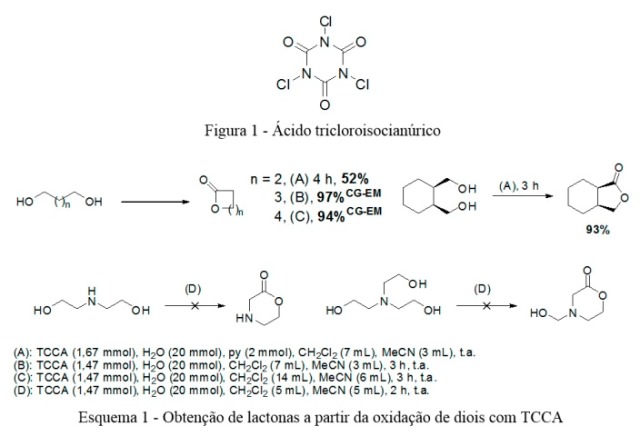
Estrutura do TCCA (1) e resultados de síntese de lactonas a partir de diois com TCCA (2).
Conclusões
Nossa metodologia permitiu a obtenção de lactonas em elevadas conversões
cromatográficas (93->99%) e rendimentos bons a ótimos (52-93%) a partir da reação
dos respectivos dióis com TCCA em misturas de diclorometano e acetonitrila. As
reações foram feitas em condições suaves e convenientes utilizando reagentes
baratos, seguros e de baixa toxicidade e com isolamento conveniente.
Agradecimentos
Agradecemos ao IQ/UFRJ pela infraestrutura oferecida, CVPS agradece a FAPERJ pelo
apoio financeiro por meio do Doutorado Nota 10 e o prof MCSM agradece ao CNPq pelo
apoio financeiro por meio de bolsa de pesquisa.
Referências
DOS SANTOS, C. V. P.; DE MATTOS, M. C. S.; A convenient protocol for the oxidation of benzyl and secondary alcohols to carbonyl compounds by trichoroisocyanuric acid, Lett. Org. Chem., n. 11, v. 18, p. 854-861, 2021.
GAO, P.; WEI, Y.; NIS-mediated oxidative lactonization of 2-arylbenzoic acids for the synthesis of dibenzopyranones under metal-free conditions, Synthesis, n. 46, v. 3, p. 343-347, 2014.
GONZALEZ, F. B., BARTLETT, P. A.; Stereocontrolled iodolactonization of acyclic olefinic acids: the trans and cis isomers of 4,5-dihydro-5-iodomethyl-4-phenyl-2(3H)-furanone, Org. Synth., v. 7, p. 164, 1990.
HIEGEL, G. A.; NALBANDY, M.; The oxidation of secondary alcohols to ketones with trichloroisocyanuric acid, Synthetic Commun., v. 22, n. 11, p. 1589-1595, 1992.
HIEGEL, G. A.; GILLEY, C. B.; The oxidation of primary alcohols to methyl esters and diols to lactones using trichloroisocyanuric acid, Synthetic Commun., v. 33, n. 12, p. 2003-2009, 2003.
KONDO, S.; KAWASOE, S.; KUNISADA, H.; YUKI, Y.; Conveninent synthesis of lactones by the reaction of diols with N-halolamides, Synthetic Commun., v. 25, n. 5, p. 719-725, 1995.
MENDONÇA, G. F.; SENRA, M. R.; ESTEVES, P. M.; MATTOS, M. C. S.; Trichloroisocyanuric acid in 98% sulfuric acid: A superelectrophilic medium for chlorination of deactivated arenes, Appl. Catal. A, n. 401, p. 176-181, 2011.
MUKAIYAMA, T.; USUI, M.; SAIGO, K.; The facile synthesis of lactones, Chem. Lett., n. 1, v. 5, p. 49-50, 1976.
SALDICK, J.; Biodegradation of cyanuric acid, App. Microb., v. 8, n. 6, p. 1004-1008, 1974.
SARTORI, S. K.; DIAZ, M. A. N.; MUÑOZ, G. D.; Lactones: Classification, synthesis, biological activities, and industrial applications, Tetrahedron, v. 84, 2021.
SHIINA, I.; An effective method for the synthesis of carboxylic esters and lactones using substituted benzoic anhydrides with Lewis acid catalysts, Tetrahedron, v. 60, n. 7, p. 1587-1599, 2004.
SHU, C.; LIU, M-Q.; SUN, Y-Z.; YE, L-W.; Efficient synthesis of γ-lactones via gold-catalyzed tandem cycloisomerization/oxidation, Org. Lett., n. 14, v. 18, p. 4958-4961, 2012.
SINDRA, H. C.; DOS SANTOS, C. V. P.; DE MATTOS, M. C. S.; Trihaloisocyanuric acids: useful reagents for conversion of benzaldehydes into benzylidene dihalides under Appel conditions, Lett. Org. Chem., v. 17, n. 8, p. 590-595, 2020.
TANG, Y.; MEADOR, R. I. L.; MALINCHAK, C. T.; HARRISON, E. E.; MCCASKEY, K. A.; HEMPEL, M. C.; FUNK, T. W.; (Cyclopentadienone)iron-catalyzed transfer dehydrogenation of symmetrical and unsymmetrical diols to lactones, J. Org. Chem., n. 85, v. 4, p. 1823-1834, 2020.
















