Autores
Velandia Arrieta, A. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Rivera Monroy, Z.J. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Garcia Castañeda, J.E. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Fierro Medina, R. (UNIVERSIDAD NACIONAL DE COLOMBIA)
Resumo
Los péptidos organometálicos (POM) son obtenidos por síntesis de péptidos en fase
solida (SPPS) pero el tratamiento con ácido fuerte requerido para separar el
péptido de la resina degrada los motivos organometálicos. Como alternativa se
implementó una estrategia una estrategia basada en la síntesis convergente en
solución para la obtención de POM. Para obtener el producto se sintetizó por SPPS
una molécula “Linker” con un grupo maleimido N-terminal y un residuo de
etilendiamina en el extremo C-terminal. Se realizó en solución la reacción entre
ácido ferrocenocarboxílico y la amina primaria del linker para obtener el Linker-
Ferroceno, que posteriormente se conjugó con el péptido C-Ahx-RRWQWRFKKLG mediante
una adición de Michael para obtener el POM Fc-EDA-AAAFF-Mhx-S-(Ahx-CRRWQWRFKKLG).
Palavras chaves
Ferroceno ; Adición de Michael; Péptidos organometalicos
Introdução
Los motivos organometálicos han sido de gran interés en los últimos años debido
a sus aplicaciones a nivel biológico. Motivos como el ferroceno (Fc) han
demostrado tener actividad antifúngica, antimicrobiana y anticancerígena por sí
solos (van Staveren et al, p.2, 2004). Su tamaño, rigidez y lipofilicidad, así
como su estructura compacta tipo sándwich les permite penetrar fácilmente la
membrana celular e interactuar directamente con el ADN (Jaouen et al, p. 2,
2006). La coordinación de un motivo organometálico a una molécula peptídica
activa puede incrementar su estabilidad, mejorar su selectividad y aumentar la
actividad citotóxica, por lo que su síntesis es de gran interés (Chantson et al,
p.2, 2006). De manera similar, la conjugación de moléculas peptídicas con
motivos fluorescentes como la carboxifluoresceina es relevante para el
seguimiento de la interacción de estas moléculas, con diferentes microorganismos
y estudiar su mecanismo de acción (Fischer et al, p. 1, 2003).
El método más utilizado para la obtención de los péptidos es la Síntesis de
Péptidos en Fase Sólida (SPPS por sus siglas en inglés), ya que esta metodología
es eficiente con rendimientos altos. En esta metodología la cadena peptídica se
construye soportada sobre una resina y la adición secuencial de los aminoácidos
permite asegurar que se sintetice la secuencia correcta. En trabajos reportados
previamente en el grupo de investigación de Síntesis y Aplicación de Moléculas
Peptídicas (SAMP) se ha demostrado que es posible acoplar motivos como el OrgSn
y el Fc a la cadena peptídica creciente; sin embargo, el proceso de desanclaje
del péptido del soporte sólido y la desprotección de las cadenas laterales
requiere condiciones fuertemente acidas, por lo que se utiliza un coctel que
contiene concentraciones de ácido trifluoroacético (TFA) de 92,5%, lo que en
muchos casos degrada el motivo organometálico unido a la secuencia peptídica.
Por esta razón, se requiere estudiar a fondo el proceso de clivaje en la
síntesis de péptidos conjugados con estos motivos y explorar alternativas
sintéticas que permitan la obtención de estos péptidos conjugados evitando el
tratamiento ácido.
La síntesis convergente es una metodología que permite la unión de una molécula
o un péptido a un sitio especifico de una secuencia peptídica. La estrategia
propuesta consiste en: (i) Obtención de una molécula “Linker” que contiene un
grupo amino libre en un extremo y un grupo maleimido en el otro extremo,
mediante síntesis en fase sólida usando una resina cloruro de 2-Cloro-Tritil,
(ii) reacción en solución entre el Fc-COOH y el péptido linker mediante la
formación del enlace amida y (iii) reacción de acople entre el grupo maleimido
del Linker-Fc y el grupo tiol del residuo de cisteína del péptido mediante una
adición de Michael en solución (figura 1).
Esta estrategia sintética cuenta con ventajas debido a que se puede incorporar
cualquier motivo que contenga un ácido carboxílico a cualquier sitio de la
secuencia y se evita el tratamiento ácido que puede degradar los motivos lábiles
en estas condiciones.
En este documento se detallan los resultados obtenidos en cuanto a la síntesis
de una molécula linker Mhx-FFAAA-EDA, el péptido C-Ahx-RRWQWRFKKLG, el acople de
Fc al linker sintetizado y la unión del péptido y el Linker-Fc en solución para
generar el POM Fc-EDA-AAAFF-Mhx-S-(Ahx-CRRWQWRFKKLG).
Material e métodos
Síntesis de péptidos en fase solida (resina Rink Amida)
(i) Acondicionamiento de la resina Rink amida con DMF por 2h y tratamiento
con piperidina al 2,5% (15 min × 3). Lavados con DMF (6 × 1 min) y DCM (3 × 1
min). La desprotección fue monitoreada mediante test de Kaiser.
(ii) Reacción de acoplamiento: Fmoc-aminoácido/DCC/6-Cl-HOBt (1:1:1 eq; 5
excesos respecto a los mEq de resina) en DMF por 5 min. La mezcla de reacción
fue adicionada a la resina y dejada en agitación constante por 4 h. Lavados con
DMF (6 × 1 min) y DCM (3 × 1 min). El acople fue monitoreado mediante test de
Kaiser.
(iii) Tratamiento con piperidina al 2,5% (15 min × 3). Lavados con DMF (6 × 1
min) y DCM (3 × 1 min). La desprotección fue monitoreada mediante test de Kaiser
(iv) Las etapas de acople del aminoácido y de desprotección se realizaron
secuencialmente las veces necesarias para obtener el péptido con la longitud,
estructura y composición de interés.
(v) Clivaje y desprotección de las cadenas laterales con solución de
desanclaje que contiene TFA/TIPS/EDT/H2O (92,5/2,5/2,5/2,5 v/v) durante 8 h.
El péptido crudo fue precipitado con éter etílico a -20°C, lavado con éter
etílico y centrifugado por 5 min a 2500 rpm descartando el sobrenadante 5 veces.
El éter remanente fue eliminado por evaporación a temperatura ambiente.
Síntesis de péptidos en fase solida (resina 2-Cloro-Tritil)
(i) Acondicionamiento de la resina 2-Cloro-Tritilo y acople de
etilendiamina: Una solución de etilendiamina en DCM fue adicionada a la resina
cloruro de 2-cloro tritil y la solución se dejó en agitación por 24 h. Se
hicieron lavados con una solución que contenía DCM/CH3OH/DIPEA; (17:2:1 v/v),
luego DMF (6 × 1 min) y DCM (3 × 1 min).
Las etapas (ii), (iii) y (iv) son equivalentes a la síntesis usando la resina
Rink Amida.
Síntesis de péptidos en solución
(i) Síntesis del motivo Linker-Fc: Preactivación del Fc-COOH mezclando Fc-
COOH/DCC/6-Cl-HOBt (1:1:1 eq; 3 excesos respecto al linker) en DCM por 5 min. La
mezcla fue adicionada al linker (5 mg, 1 meq) y dejada en agitación durante 1h.
El acople fue monitoreado mediante test de Kaiser y por RP-HPLC
(ii) Adición de Michael: Se tomaron 200 μL de la solución del Linker-Fc (1eq)
y se evaporó el DCM a temperatura ambiente. Se adicionó 200 μL de ACN y se llevo
a 1mL con agua. Posteriormente, se añadió 1eq del péptido sintetizado usando la
resina Rink Amida y se dejó en reacción por 1h.
Caracterización de péptidos
Análisis por RP-HPLC. El péptido crudo (1 mg/mL) fue inyectado en un
cromatógrafo Agilent serie 1200 con columna monolítica Chromolith® C18 (50×4,6
mm), detector a 210 nm, gradiente de elución de 20-100% de solvente B (0,05% de
TFA en ACN) en 9 min, temperatura ambiente y flujo de 2 mL/min, solvente A
(0,05% de TFA en H2O).
LC-MS. Los péptidos crudos y productos de reacción fueron analizados en un UHPLC
Bruker Impact II LC Q-TOF MS equipado con ionización por electrospray (ESI) en
modo positivo.
Resultado e discussão
En la primera etapa de esta investigación se sintetizó, mediante SPPS, un
péptido organometálico correspondiente a la secuencia Fc-Ahx-RWQWAWQWR, usando
resina Rink Amida (0,46 meq/g). Una vez se acoplaron todos los aminoácidos y el
Fc-COOH sobre el soporte sólido, se procedió a realizar la reacción de
desanclaje que se da de manera simultánea con la desprotección de las cadenas
laterales, ya que los enlaces en ambos casos son lábiles en medio ácido. Para
este proceso se utilizó un coctel de clivaje compuesto por TFA/H2O/EDT/TIPS
92,5:2,5:2,5:2,5 v/v. La resina-péptido fue mezclada con el coctel (10:1 p/v) y
la mezcla de reacción fue dejada a temperatura ambiente con agitación constante
durante 8 h. La mezcla de reacción fue analizada por LC-MS utilizando un equipo
UHPLC acoplado a un detector de masas ESI-QTOF. El perfil cromatográfico (TIC)
obtenido se observa en la Figura 2, donde encontraron cuatro especies, mediante
el espectro de masas de cada señal se determinó que tres de ellas corresponden a
productos de degradación (A-C) y la especie más hidrofóbica (D) corresponde al
péptido organometálico esperado. Dado que el proceso de desanclaje del POM de la
resina da lugar a especies de degradación que disminuyen los rendimientos y
conducen a procesos dispendiosos de purificación, se buscó una alternativa de
síntesis que permita obtener estas moléculas evitando el tratamiento ácido.
Se decidió emplear la síntesis convergente como alternativa para la
incorporación del Fc a los péptidos en solución y así no someter los POM a
condiciones de reacción fuertes.
Para la nueva estrategia se siguieron las etapas que se describen a
continuación: (i) Se obtuvo, mediante SPPS (sobre resina Rink amida), el péptido
C-Ahx-RRWQWRFKKLG. Su síntesis solo presentó dificultad en el acople de la Arg
(R) del extremo N-terminal, los demás aminoácidos solo requirieron un ciclo de
acople. El perfil cromatográfico obtenido mediante RP-HPLC muestra una especie
mayoritaria cuya masa experimental corresponde con la masa teórica. (ii)
Posteriormente, se obtuvo el péptido Mhx-FFAAA-EDA (linker), mediante SPPS
usando resina 2-Cloro-Tritil. Al unir primero la etilendiamina (EDA) a la resina
se genera un péptido que se obtiene tiene en el extremo C-terminal una amina
primaria, que puede reaccionar con el Fc-COOH, en solución. Adicionalmente, en
el extremo C terminal, se unió el ácido 6-maleimidohexanoico (Mhx), que permite
llevar a cabo la adición de Michael con el grupo tiol de la cisteína incorporada
en el péptido descrito en (i).
El linker se diseñó de tal manera que cumpliera con dos criterios: por un lado,
que fuera posible su precipitación después del clivaje, lo cual facilitaría su
purificación; Y por otro lado, que las cadenas laterales no fueran reactivas. La
síntesis del linker requirió de múltiples ciclos de acople, especialmente para
los dos últimos aminoácidos y el residuo de Mhx. Este resultado sugiere que se
deben estudiar otras secuencias de longitud y composición diferente para
optimizar la síntesis del linker. El linker fue separado de la resina por
tratamiento con TFA al 1% y fue caracterizado mediante RP-HPLC y LC-MS. El
perfil cromatográfico presentó una especie mayoritaria cuya masa correspondió
con la masa teórica.
Este linker fue empleado para introducir el motivo de Fc en solución, para esto
el Fc-COOH fue tratado con DCC para la formación de un éster activo, al cual se
le adicionó el linker que contiene un grupo amino para formar el enlace amida.
Usando el test de Kaiser se verificó la obtención del producto después de 1 h.
La mezcla de reacción fue analizada mediante RP-HPLC observando la presencia de
una especie mayoritaria. Finalmente, el linker conjugado con el ferroceno (Fc-
EDA-AAAFF-Mhx) se mezcló con el péptido C-Ahx-RRWQWRFKKLG para obtener Fc-EDA-
AAAFF-Mhx-S-(Ahx-CRRWQWRFKKLG), mediante la adición de Michael en solución.
En la Figura 3, se muestra el perfil cromatográfico de la mezcla de reacción
analizada por LC-MS, donde se identificó la señal correspondiente al POM
esperado, también se observaron señales de las especies precursoras, esto
sugiere que se deben optimizar las condiciones de reacción para favorecer la
formación del producto. Sin embargo, es importante resaltar que los productos de
degradación del motivo organometálico no fueron observados. Adicionalmente, los
péptidos (Fc-linker y CRRWQWRFKKLG) involucrados en la síntesis convergente se
emplearon crudos, y se pudo demostrar la viabilidad de la síntesis del POM por
esta estrategia, reduciendo significativamente el consumo de solventes
involucrados en los procesos de purificación, lo cual está enmarcado en la
química verde. Estos resultados son promisorios ya que demuestran la viabilidad
sintética de péptidos conjugados con motivos organometálicos y su posible
aplicación para la funcionalización de péptidos con moléculas de diferente
naturaleza como motivos organometálicos y fluorescentes.
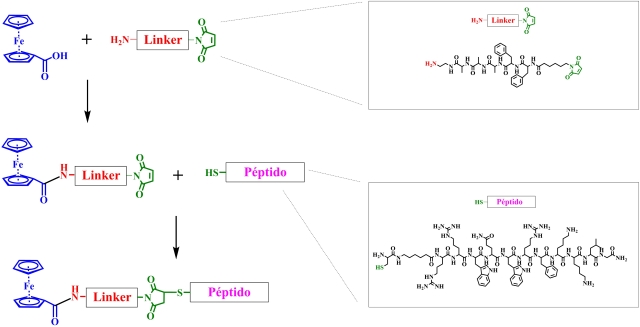
Esquema general de síntesis convergente. Péptido: C- Ahx-RRWQWRFKKLG, Linker: Mhx-FFAAA-EDA
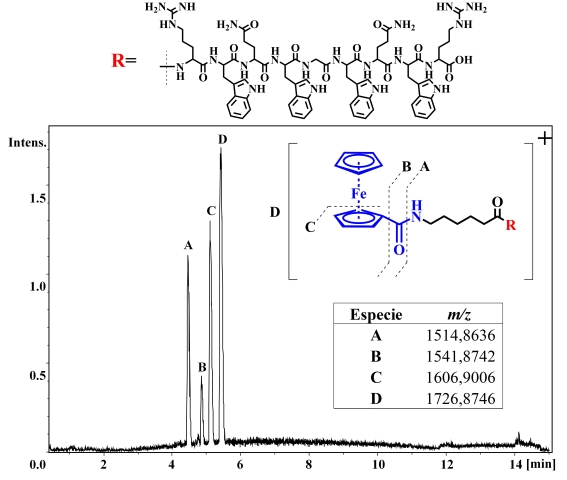
Perfil cromatográfico del POM tras el proceso de clivaje y asignación de las especies según el análisis de masas.
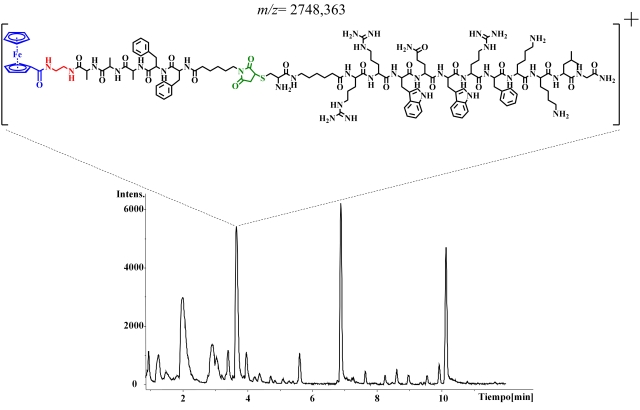
Perfil cromatografico de la mezcla de reacción entre el Linker-Ferroceno y el péptido con cisteina, obtenido en LC-MS
Conclusões
La síntesis de péptidos conjugados con ferroceno se realizó mediante la
metodología SPPS para determinar la viabilidad sintética de los mismos. Se
evidenció que el tratamiento ácido degrada el POM causando que los rendimientos
sean muy bajos. Se implementó la síntesis de POMs en solución, empleando química
click. Esta metodología permitió la obtención del POM usando precursores crudos,
evitando varios procesos de purificación. Nuestros resultados permiten sugerir
esta nueva metodología es amigable, requiere menos consumos de solventes y permite
la incorporación de motivos no peptídicos en cualquier sitio de la secuencia.
Agradecimentos
Esta investigación fue financiada por MINCIENCIAS, código del proyecto 66986,
contrato RC 845-2019.
Referências
VAN STAVEREN, D.; METZLER-NOLTE, N. Bioorganometallic Chemistry of Ferrocene. Chemical Reviews, 2004, 104, 12, 5931–5986.
FISCHER, R.; MADER, O.; JUNG, G.; BROCK, R. Extending the Applicabili of Carboxyfluorescein in Solid-Phase Synthesis. Bioconjugate Chemistry, 2003, 14, 3, 653–660.
JAOUEN, G.; TOP, S.; VESSIERES, A.; Organometallics Targeted to Specific Biological Sites:
the Development of New Therapies. Bioorganometallics: Biomolecules, Labeling, Medicine, 2005, 3, 65-95.
CHANTSON, J.; VITTORIA VERGA FALZACAPPA, M.; CROVELLA, S.; METZER-NOLTE, N. Solid-Phase Synthesis, Characterization, and Antibacterial Activities of Metallocene–Peptide Bioconjugates. ChemMedChem, 2006, 1, 11, 1268-1274.
















