Autores
Esteche, J. (CEDECOR - CIC-UNLP) ; Bejarano, N. (CEDECOR - CIC-UNLP) ; Lafuente, L. (LAB. BIOCAT. Y BIOTRANSF- UNQ) ; Lewkowicz, E. (LAB. BIOCAT. Y BIOTRANSF- UNQ) ; Ponzinibbio, A. (CEDECOR - CIC-UNLP)
Resumo
El presente trabajo informa la síntesis de nuevos compuestos, O(N)-glicósidos
heterocíclicos a partir de reacciones de condensación y reducción. Los mismos
cuentan con una gran variedad de aplicaciones biológicas por lo que su síntesis es
de gran interés. En particular, esta clase de compuestos han presentado
bioactividad antitumoral y antibacteriana, entre otras según lo reportado
recientemente en literatura. En el presente trabajo se ha logrado sintetizar,
purificar y caracterizar estructuralmente, a partir del protocolo propuesto, una
familia de doce compuestos nuevos con estructuras análogas a nucleósidos.
Palavras chaves
éteres de oxima; O(N) glicósidos; bases de schiff
Introdução
Las Bases de Schiff son muy utilizadas en la síntesis orgánica para la formación
de enlaces C-N. Es así como se convierten en excelentes compuestos de partida
para la obtención de moléculas más complejas. (RUDRAPAL, 2013) Partiendo de la
obtención de éteres de oximas que son bases de Schiff derivados de
carbohidratos, se obtendrán compuestos muy versátiles que permitirán la síntesis
de análogos de nucleósidos. (SHELTON et al, 2016).
El objetivo del presente trabajo es la obtención de éteres de oximas, derivados
tanto de la D-glucosa como de la D-galactosa (A), a partir de la condensación de
un aminoxi azúcar (B) y diferentes aldehídos heterocíclicos (C), como lo es el
indol-3-carboxialdehido, utilizando reacciones ya estudiadas en el grupo de
trabajo (LAFUENTE et al, 2020). Luego la reducción del doble enlace C=N
permitirá obtener los correspondientes O(N)-glicósidos (E).
Material e métodos
Se colocan en un balón de dos bocas 1 mmol de B y 1 mmol de C en 10 mL de CH2Cl2
previamente secado. La reacción se lleva a cabo bajo atmósfera de nitrógeno a
temperatura ambiente y con agitación durante 24h y siguiendo el avance de esta
mediante cromatografía en capa delgada (CCD). En el caso de los derivados de D-
galactosa, será necesario agregar además dos gotas de HCl concentrado para
catalizar la reacción.
Una vez finalizada la misma, se realizan lavados con H2O, luego solución al 5%
de NaHCO3 y finalmente otro lavado con H2O para aislar el producto, luego se
evapora el solvente en evaporador rotatorio. Para purificar el producto, se
realiza una cromatografía en columna con solvente de elución Hexano/AcOEt 1:1,
logrando separar de manera efectiva los isómeros E y Z.
La reducción de los compuestos D se realiza con NaBH3CN. Se colocan 0,7 mmol de
D, 2 mL de ácido acético y 2,34 mmol del reductor en un balón, se comienza la
agitación y se controla la reacción mediante CCD, finalizando la reacción en
aproximadamente 1 hora.
A la mezcla de reacción se le agregan 2 mL de H2O, luego se realizan lavados con
solución 5% de NaHCO3, y luego se realizan extracciones con CH2Cl2. Para
purificar los compuestos, se realiza una cromatografía de columna con solvente
de elución Hexano/AcOEt 7:3.
Resultado e discussão
En primer lugar, se protegieron los grupos hidroxilo del azúcar formando grupos
acetilos. Luego se llevaron a cabo dos reacciones que involucran el carbono
anomérico, permitiendo obtener el azúcar con un grupo aminoxi en dicho carbono,
variando las condiciones de reacción se lograron obtener ambos anómeros (α y β).
Como último paso se realizó una reacción de condensación entre la 1-aminoxi-4-O-
acetil-D-glucosa (o D-galactosa, según corresponda) y el aldehído heterocíclico
correspondiente, permitiendo así la obtención de los éteres de oxima deseados B.
Los compuestos sintetizados fueron purificados exhaustivamente y estudiadas sus
estructuras mediante espectroscopía de RMN, es así como se logró determinar de
manera inequívoca su estructura, incluyendo tanto la configuración anomérica
como la geometría E/Z del doble enlace formado.
Como último paso, se procedió a realizar la reducción del doble enlace C=N
utilizando NaBH3CN agente reductor específico, obteniendo así nuevos compuestos
que fueron purificados por cromatografía en columna y caracterizados también
mediante un riguroso análisis de los espectros de RMN 1H, 13C, gCOSY y gHSQC.
El protocolo planteado para llevar a cabo la síntesis de los O(N)-glicósidos
pudo llevarse adelante, por lo cual se pudieron obtener doce compuestos nuevos,
incluyendo las bases de Schiff y sus productos de reducción, en el siguiente
esquema se muestran los seis derivados de la D-galactosa.
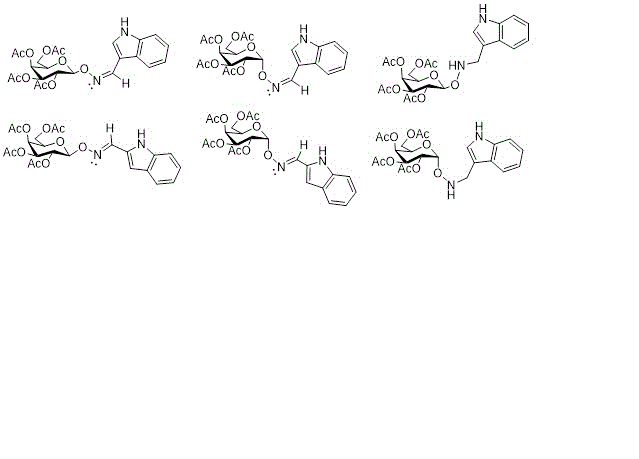
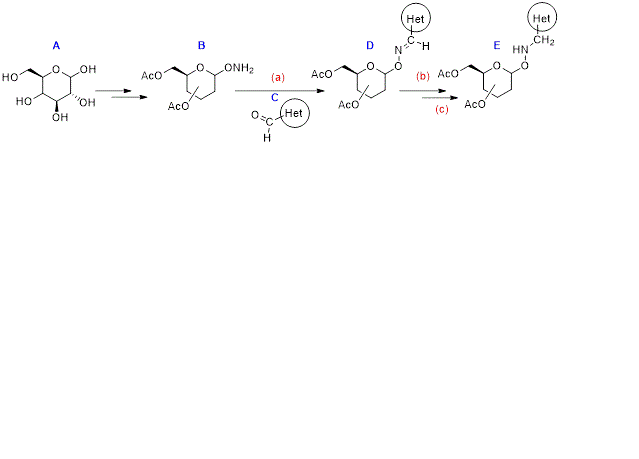
Esquema de la síntesis realizada
Conclusões
La síntesis de los compuestos objetivo pudo llevarse a cabo de manera exitosa,
pudiendo analizar y caracterizar sus estructuras por métodos espectroscópicos
(RMN). Se obtuvieron nuevos O(N)-glicósidos tanto los anómeros α como β derivados
del indol. En el caso de las bases de Schiff se pudieron separar los isómeros E/Z
y caracterizarlos estructuralmente por separado. Continuaremos con el trabajo
realizando las reacciones de desprotección de los grupos acetilos y ensayando la
bioactividad estos compuestos en colaboración con otros grupos de trabajo
especializados en la temática.
Agradecimentos
A la Facultad de Ciencias Exactas de la Universidad Nacional de La Plata, al Lic.
Omar Guaymas por su asistencia en la realización de espectros de RMN, a la CIC -
PBA y al CONICET.
Referências
a) LAFUENTE, L.; ROJAS, A.; PIRO, O.; ECHEVERRÍA, G.; PONZINIBBIO, A. Synthesis, NMR and X-ray studies on novel heteroaromatic aldoxime O-ether 2- and 2,3-unsaturated glycosides Tetrahedron Lett. 61, 152241, 2020. b) LAFUENTE, L.; SANTIAGO, C.; ROJAS, A.; PIRO, O.; ECHEVERRÍA, G.; PONZINIBBIO, A. Selective Synthesis and Molecular Structure of Novel Aminooxyglycosyl Derivatives Bearing Hydroxyphenyl Moieties. ChemistrySelect, 5, 864, 2020.
RUDRAPAL, M.; DE, B. Chemistry and biological importance of heterocyclic Schiff's bases. International Research Journal of Pure & Applied Chemistry, 3, 232, 2013.
SHELTON, J., Lu, X.; HOLLENBAUGH, J. A.; CHO, J. H.; AMBLARD, F.; SCHINAZI; R. F. Metabolism, biochemical actions, and chemical synthesis of anticancer nucleosides, nucleotides, and base analogs. Chemical Reviews, 116, 14379, 2016.
















