Autores
Niño, F. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Becerra, C. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Orozco, F. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Cuervo, P. (UNIVERSIDAD NACIONAL DE COLOMBIA)
Resumo
Se implementó una metodología simple, limpia y rápida con la que se logró obtener
de forma simultánea, 34 derivados de 3-(aminopirazol-4-il)-3-hidroxiindol-2-onas.
La metodología empleada consistió en una síntesis paralela combinatoria asistida
por ultrasonido de los derivados mencionados, a partir de 1-aril-3-metil-5-
aminopirazoles en reacción con derivados isatínicos. Dentro del mismo estudio se
evaluaron las condiciones óptimas de reacción con respecto a disolvente,
catalizador, tiempo y temperatura de reacción; con las que se lograron obtener
rendimientos entre el 52 y 92% de los productos finales.
Palavras chaves
Ultrasonido; Pirazol; Isatina
Introdução
La síntesis combinatoria paralela es una herramienta poderosa y un método
robusto para la obtención simultánea de varias moléculas que requieran pureza
aceptable para bioensayos. Todas las posibles combinaciones son formadas en un
paso, de modo que se obtienen conjuntos de compuestos llamados bibliotecas, a
partir de pocos reactantes (BALKENHOHL F., et al, p. 2288, 1996).
La síntesis de los compuestos de interés se basa en la reacción de Morita-
Bayllis-Hillman en la que se requieren de tres componentes: Un alqueno activado,
un electrófilo y un catalizador. Esta reacción es de gran interés sintético dado
a que permite generar enlaces C-C, en orden de generar aductos por la
condensación de la olefina con un compuesto carbonílico (ROBIETTE R., et al, p.
15513, 2007).
En este estudio se busca implementar la sonoquímica como método de inducción,
debido a que ofrece amplias ventajas y aplicaciones en comparación con el
calentamiento convencional, al tiempo que implementa equipos relativamente
baratos. La fuerza motriz de la activación sonoquímica se basa en el fenómeno de
la cavitación, por lo que se requiere que al menos una de las fases de la
reacción esté en estado líquido. Las reacciones asistidas por ultrasonido poseen
varias mejoras para la química sintética clásica debido a que se obtienen
reacciones más rápidas y limpias, con respecto a las metodologías basadas en
calentamientos convencionales. Existen varios reportes en donde se evidencia que
la inducción por ultrasonido, incide en factores tan importantes como son la
regio, quimio y estereoselectividad, aumento en los rendimientos de reacción,
disminución de los tiempos y temperaturas de reacción. Así mismo, se han
reportado reacciones no catalizadas con mejores rendimientos que otras técnicas
sintéticas tradicionales (MASON, T, p. 443, 1997).
Los aductos de pirazol-isatina han sido estudiados en la última década, por
tratarse de moléculas que pueden utilizarse en reacciones de ciclación para
obtener derivados de espirotiazepindionas (KARNAKAR, K., et al, p. 3497, 2012) o
espiropiridindionas (CHEN, H., et al, p. 5686, 2011). Adicionalmente, se ha
encontrado que algunas moléculas con estos esqueletos poseen actividad
antimicrobiana, abriendo la posibilidad de que algunos de los compuestos
obtenidos, sean considerados como antibióticos promisorios. Esto eleva la
importancia del estudio, debido a que se busca obtener una gran biblioteca de
compuestos con posible actividad biológica (ROMO, P., et al, p. 2020, 2020).
En este trabajo se presenta una aproximación a la síntesis combinatoria en
paralelo de pirazolil-3-hidroxiindolonas, bajo la metodología presentada en el
esquema 1, usando tiempos de reacción más cortos y temperaturas más bajas con
respecto a reportes previos (PUSHECHNIKOV, A., et al, p. 1140, 2002). Además,
bajo esta metodología se lograron obtener rendimientos en promedio mayores que
los reportados anteriormente en la literatura.
Material e métodos
Procedimiento general para la síntesis de 1-aril-3-metil-5-aminopirazoles (3a-
e): Se preparó una solución de la correspondiente arilhidracina (10 mmol) en 5
mL de HCl 3M. A esta solución se agregaron 820 mg (10 mmol) de 3-
aminocrotononitrilo. La mezcla se mantuvo en agitación por 10 minutos, luego se
agregaron nuevamente 5 mL de HCl y se calentó por 15 minutos adicionales
obteniendo una solución de color amarillo. La mezcla de reacción fue enfriada
agregando hielo picado y se neutralizó goteando amoniaco concentrado hasta
obtener un medio básico. Finalmente, el precipitado formado fue filtrado al
vacío y lavado con agua fría, dando lugar a un sólido correspondiente a los
precursores de tipo aminopirazolico.
Procedimiento para la síntesis de N-alquil isatinas (6a-d): Se disolvieron 1,47
g (10 mmol) de isatina en 5 mL de DMF, sobre esta solución se agregaron 2,76 g
(20 mmol) de K2CO3. A la mezcla de reacción se agregaron 10 mmol del
correspondiente bromuro de alquilo y se procedió a calentar a reflujo, hasta
terminar la reacción. Posteriormente se procedió a agregar hielo picado sobre la
solución resultante, induciendo así la precipitación de un sólido, el cual fue
filtrado al vacío, lavado con agua fría y secado a temperatura ambiente, dando
lugar a las correspondientes N-alquil isatinas 6b-d.
Procedimiento de síntesis de la 1-acetil-(1H)-indol-2,3-diona (6e): Se
disolvieron 1,47 g (10 mmol) de isatina en 7 mL de anhídrido acético. La
solución fue calentada hasta el término de la reacción y posteriormente se
enfriar a temperatura ambiente, obteniendo un precipitado amarillo que fue
filtrado al vacío, lavado con agua fría y secado a temperatura ambiente, el cual
correspondió a la 1-acetil-1H-indol-2,3-diona 6e.
Procedimiento general para la síntesis paralela de los aductos pirazol-isatina:
En un baño de ultrasonido adaptado con una gradilla se colocaron 35 tubos de
ensayo. A cada tubo de ensayo se le agregaron 0.2 mmol de la correspondiente
isatina (A, B, 6a-e) y se procedió a cada uno de los tubos 1 mL de una solución
alcohólica 0,2 M del correspondiente pirazol (3a-e). Por último, se agregaron
100 µL de solución de yodo 0,02 M en etanol al 96%. De manera paralela, los 35
tubos de ensayo fueron sonicados por 30 minutos a temperatura ambiente. Los
sólidos obtenidos en cada tubo fueron filtrados al vacío y lavados con 2 mL de
etanol frío. Finalmente, todos los sólidos fueron secados a 40°C por 20 minutos,
obteniendo los aductos que serán especificados más adelante.
Resultado e discussão
El primer paso del estudio consistió en realizar la síntesis de los precursores
aminopirazólicos y los derivados de isatina. Los derivados de 1-aril-3-metil-5-
aminopirazoles fueron sintetizados bajo una metodología de ciclocondensación
clásica de arilhidracinas y β-aminocrotononitrilo en un medio ácido. Bajo esta
metodología se obtuvieron 5 de los 7 aminopirazoles 1-sustituidos planteados
como precursores en este estudio, con rendimientos entre el 73 y 83%. Cada
compuesto fue caracterizado por espectroscopía IR, resonancia magnética nuclear
de 1H y 13C, coloración y punto de fusión.
La síntesis de los precursores tipo isatina N-sustituida se basó en reacciones
de tipo SN2 entre la isatina y varios agentes alquilantes como el sulfato de
dimetilo y haluros de etilo, propilo y bencilo, y finalmente en presencia de
anhídrido acético como reactivo y disolvente, dando lugar a cinco isatinas N-
sustituidas con rendimientos entre el 51 y 92 %. De igual manera, estos cinco
precursores fueron caracterizados por espectroscopía IR y resonancia magnética
nuclear de 1H y 13C.
Por otro lado, con el fin de determinar las condiciones óptimas para la
reacción, se evaluaron solventes como acetonitrilo, etanol y mezcla de metanol :
agua en proporción 1 a 1, catalizadores como p-TsOH, yodo, AcOH en distintas
cantidades, en la reacción del 5-amino-1-fenil-3-metilpirazol 3a con isatina
para obtener el correspondiente aducto. En principio se ensayaron diversas
condiciones mediante la metodología de calentamiento convencional, obteniendo el
mejor rendimiento con etanol como disolvente, yodo al 1% como catalizador y una
temperatura de 40°C por 2 horas, obteniendo un rendimiento global del 88%.
Posteriormente, se evaluaron las mismas condiciones anteriores de disolvente y
catalizador, bajo la metodología de inducción por ultrasonido, obteniendo un
rendimiento del 92 % a temperatura ambiente y logrando una sustancial reducción
del tiempo de reacción a 30 minutos, lo cual deja en evidencia las ventajas de
utilizar la sonoquímica en la síntesis orgánica.
Finalmente, al realizar la síntesis combinatoria en paralelo asistida por
ultrasonido de las 35 combinaciones de precursores posibles utilizando las
condiciones óptimas determinadas, se obtuvieron 34 compuestos de los 35
esperados. No se logró sintetizar el aducto correspondiente a la reacción entre
la N-bencilisatina y el 5-amino-3-metil-1-(4-metoxifenil)pirazol codificado como
A-3e en la tabla 1. De igual manera, los 34 compuestos de la serie que se
lograron sintetizar, se obtuvieron en rendimientos del 52 al 99,9 % en un tiempo
de reacción de 30 minutos, como se observa en la tabla 1. Todos los compuestos
fueron caracterizados por espectroscopía IR, resonancia magnética nuclear de 1H
y 13C, espectrometría de masas de alta resolución con ionización por electrospay
(HRMS – ESI), coloración y punto de fusión.
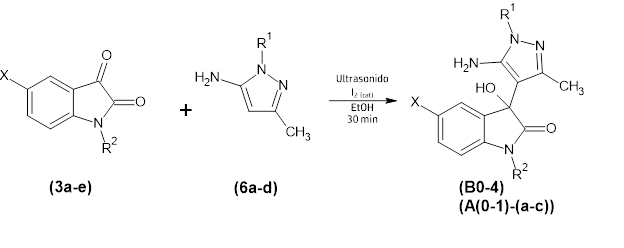
Síntesis paralela combinatoria asistida por ultrasonido de aductos pirazol-isatina.
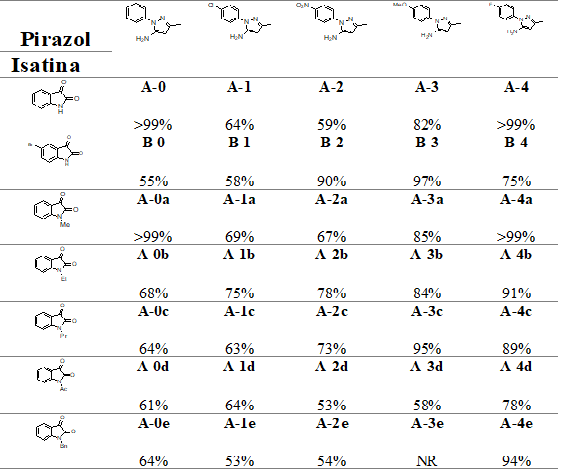
Rendimientos de la síntesis paralela de los aductos pirazolilindolinónicos bajo las condiciones óptimas.
Conclusões
Se desarrolló una metodología asistida por ultrasonido para la síntesis
combinatoria en paralelo de una serie de 34 derivados de 3-(pirazol-4-il)-3-
hidroxiindol-2-onas. Con esta estrategia los compuestos mencionados se obtuvieron
en rendimientos mayores a los reportados previamente por metodologías
convencionales. Además, el protocolo permite una fácil y rápida purificación,
además de respetar los parámetros de la química verde al ampliar el espacio
químico, con nuevas moléculas que podrían tener un amplio espectro de actividad
farmacológica deseable.
Agradecimentos
Referências
BALKENHOHL F., BUSSCHE-HÜNNEFELD C., LANSKY A., ZECHEL C., Combinatorial synthesis of small organic molecules, Angew. Chem. Int. Ed. 35, 2288-2337, 1996.
CHEN, H.; SHI, D. Efficient One-Pot Synthesis of Spiro[Indoline-3,4′-Pyrazolo[3,4-e][1, 4]Thiazepine]Dione via Three-Component Reaction. Tetrahedron Lett, 67 (31), 5686–5692, 2011.
KARNAKAR, K.; NARAYANA MURTHY, S.; RAMESH, K.; HARSHA VARDHAN REDDY, K.; NAGESWAR, Y. V.D.; CHANDRAKALA, U.; PRABHAVATHI DEVI, B. L. A.; PRASAD, R. B. N. A Novel One-Pot Synthesis of Spiro[Indoline-3,4′-Pyrazolo[3,4-e][1,4] Thiazepine] Diones Using Recyclable Bioglycerol-Based Sulfonic Acid Functionalized Carbon Catalyst. Tetrahedron Lett. 53 (27), 3497–3501, 2012.
MASON, T. J., Ultrasound in Synthetic Organic Chemistry. Chem. Soc. Rev., 26 (6), 443, 1997.
PUSHECHNIKOV, A. O.; VOLOCHNYUK, D. M.; TOLMACHEV, A. A. Interaction of Izatins with Some Five-Membered Aminoheterocycles. Synlett, No. 7, 1140–1142, 2002.
ROBIETTE R., AGGARWAL V., HARVEY J., Mechanism of the Morita-Baylis-Hillman Reaction: A computational investigation, J. Am. Chem. Soc., 129, 15513-15525, 2007.
ROMO, P. E.; INSUASTY, B.; ABONIA, R.; CRESPO, P.; QUIROGA, J. Synthesis of New Oxindoles and Determination of Their Antibacterial Properties. Heteroat. Chem. 2020, 2020.
















