Autores
Monroy-cardenas, M. (UNIVERSIDAD DE TALCA) ; Guzman, L. (UNIVERSIDAD DE TALCA) ; Martinez-cifuentes, M. (UNIVERSIDAD DE CONCEPCION) ; Araya-maturana, R. (UNIVERSIDAD DE TALCA)
Resumo
En este trabajo se reporta la síntesis de una serie de acilbenzofuranos, el
estudio teórico de sus energías de disociación de enlace (DBE), utilizando la
teoría del funcional de la densidad (DFT), y sus actividades antioxidantes
mediante DPPH y FRAP. En general los compuestos con un gem-dimetilo en el anillo
furanico presentan valores menores de DBE, en comparación a los que presentan un
metilo en la misma posición, lo cual concuerda con las actividades antioxidantes
experimentales (DPPH y FRAP).
Palavras chaves
Antioxidantes; DBE; acilbenzofuranos
Introdução
En gran medida, la actividad biológica de los fenoles se atribuye a su capacidad
antioxidante frente a especies reactivas de oxígeno (ROS). La transferencia de
un átomo de hidrógeno (HAT) de un grupo hidroxilo fenólico, o la transferencia
monoelectrónica (SET) son los principales mecanismos implicados en estas
reacciones. Previamente, se han realizado estudios teóricos sobre energía de
disociación de enlace en derivados de moléculas con interés biológico (Martínez-
Cifuentes et al., 2016, 2017). Encontrando que la energía de disociación del
enlace CH, de los grupos metilenos unidos a un anillo fenolico, son
prácticamente iguales a las de los enlaces OH no quelados de estos mismos. Por
tanto, se concluyó que los radicales libres se podrían generar de forma
concomitante a partir de este tipo de grupos, en estos compuestos.
En este estudio se sintetizaron 6 derivados de benzofuranos fenólicos y se
determinó su capacidad antioxidante frente a DPPH y FRAP. Además, se estudiaron
in silico todas las DBEs de los grupos metilos, metilenos, metinos e hidroxilos
fenólicos, según corresponda, mediante DFT.
Material e métodos
La síntesis de los benzofuranos se realizó mediante el procedimiento descrito
por (Urra, Muñoz, Córdova-Delgado, et al., 2018). La correspondiente quinona
(0.5 g) en diclorometano seco (70 mL) fue adicionada a una solución de (E)-4-
(propil-1-en)morfolina o 4-2-metilpropil-1-en)morfolina en el mismo solvente a
0°C. Luego se deja subir la temperatura y se mantiene por 8 h a temperatura
ambiente. El crudo de reacción fue purificado por cromatografía flash con
hexano:acetato de etilo 8:1 como eluyente, los compuestos fueron completamente
caracterizados mediante 1H-RMN, 13C-RMN y espectrometría de masas de alta
resolución.
Los cálculos de DBE fueron realizados usando el programa Gaussian 09(Frisch et
al., n.d.) utilizando la teoría del funcional de la densidad (DFT), con el
funcional ωb97x y el conjunto de funciones bases 6-311++G(d, p). Como la BDE ha
mostrado sufrir una influencia del medio(Chai & Head-Gordon, 2008; Chipem et
al., 2011; Mostafa Alizade‑ Harakiyan et al., 2018), utilizando el modelo
continuo polarizable de tipo conductor (C-PCM) para modelar el medio acuoso.
Resultado e discussão
Los benzofuranos fueron obtenidos con rendimientos entre 27 y 93%. El estudio de
sus actividades antioxidantes permite observar que aquellos con el grupo gem-
dimetilo presentan mayor capacidad en relación a sus pares monometilados,
exceptuando el caso del MBF1 en el ensayo de DPPH, en donde el resultado se
invierte. Las mayores actividades antioxidantes de los productos gem-dimetilados
se corresponden con sus DBEs. Ya que, como se puede observar en la tabla 2, las
DBEs de la ruptura del enlace OH del grupo fenólico siempre son menores para las
moléculas con el gem-dimetilo. Estas son 7.75 Kcal/mol menores para MBF1 con
respecto a MBF01, 6.25 Kcal/mol para MBF21 con respecto a MBF021 y 5.67 Kcal/mol
para MBF61 con respecto a MBF061. Además, se puede observar que en las moléculas
sin el gem-dimetilo la DBE menor, no es la correspondiente a la ruptura del
enlace OH. De hecho, en el caso del MBF061 la DBE de los grupos metilenicos de
las posiciones R1 y R2 son en promedio 4.3 Kcal/mol menores a la de ruptura del
grupo OH.

Metodología sintética, estructuras y actividades antioxidantes mediante métodos DPPH y FRAP
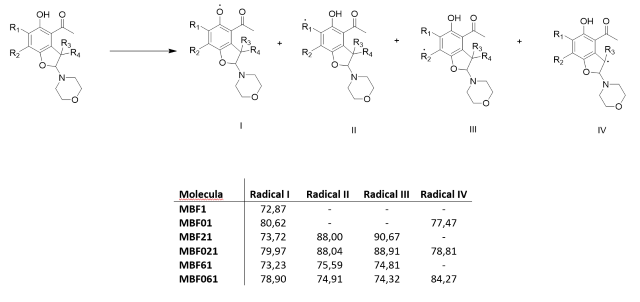
I) formación en grupo hidroxilo, II y III) formación en grupo metilo y metileno, IV) formación en grupo metino. Todas las DBE están en Kcal/mol.
Conclusões
Este estudio ha permitido evaluar el efecto de pequeños cambios estructurales
sobre la formación de enlaces de hidrógeno, y del efecto de estos en la
competencia entre diferentes grupos dadores de átomos de hidrógeno, que se ve
reflejada en las actividades antioxidantes de estos compuestos.
Agradecimentos
Proyecto fondecyt 1221874 y 11170142, el proyecto ACT210097 y al Programa de
Doctorado en Investigacion y Desarrollo de Compuestos Bioactivos de la Universidad
de Talca.
Referências
Chai, J. Da, & Head-Gordon, M. (2008). Systematic optimization of long-range corrected hybrid density functionals. Journal of Chemical Physics, 128(8). https://doi.org/10.1063/1.2834918
Chipem, F. A. S., Dash, N., & Krishnamoorthy, G. (2011). Role of nitrogen substitution in phenyl ring on excited state intramolecular proton transfer and rotamerism of 2-(2′-hydroxyphenyl) benzimidazole: A theoretical study. Journal of Chemical Physics, 134(10), 1–9. https://doi.org/10.1063/1.3562124
Frisch, M. J., Trucks, G. W., Schlegel, H. B., Scuseria, G. E., Robb, M. A., Cheeseman, J. R., Scalmani, G., Barone, V., Mennucci, B., & Petersson, G. A. (n.d.). Revision A.01, Gaussian 09; Gaussian, Inc.: Wallingford, CT, USA, 2009. .
Martínez-Cifuentes, M., Salazar, R., Ramírez-Rodríguez, O., Weiss-López, B., & Araya-Maturana, R. (2017). Experimental and theoretical reduction potentials of some biologically active ortho-carbonyl para-quinones. Molecules, 22(4). https://doi.org/10.3390/molecules22040577
Martínez-Cifuentes, M., Weiss-López, B., & Araya-Maturana, R. (2016). A computational study of structure and reactivity of N-substitued-4-piperidones curcumin analogues and their radical anions. Molecules, 21(12), 1–10. https://doi.org/10.3390/molecules21121658
Mostafa Alizade‑ Harakiyan, Jangjoo, A. G., Tohid Jafari‑Koshki, Ali Fatemi, & Mesbahi, A. (2018). Radiobiological modeling of acute esophagitis after radiation therapy of head, neck, and thorax tumors: The influence of chemo‑radiation. Journal of Cancer Research and Therapeutics, 14(7), 1525–1534. https://doi.org/10.4103/jcrt.JCRT
Urra, F. A., Muñoz, F., Córdova-Delgado, M., Ramírez, M. P., Peña-Ahumada, B., Rios, M., Cruz, P., Ahumada-Castro, U., Bustos, G., Silva-Pavez, E., Pulgar, R., Morales, D., Varela, D., Millas-Vargas, J. P., Retamal, E., Ramírez-Rodríguez, O., Pessoa-Mahana, H., Pavani, M., Ferreira, J., … Araya-Maturana, R. (2018). FR58P1a; a new uncoupler of OXPHOS that inhibits migration in triple-negative breast cancer cells via Sirt1/AMPK/β1-integrin pathway. Scientific Reports, 8(1), 1–16. https://doi.org/10.1038/s41598-018-31367-9
















