Autores
Kerek, A.L. (UEPG) ; Ramos, R.H. (UEPG) ; Protachevicz, E. (UEPG) ; Ricardo, J.F. (UEPG) ; Fiorin, B.C. (UEPG)
Resumo
O objetivo do trabalho consistiu na síntese, caracterização espectroscópica e atividade
antioxidante da (2E)-3-fenil-1-(2-piridinil)-2-propen-1-ona e (2E)-3-(2-furil)-1-(2-
piridinil)-2-propen-1-ona. Os produtos das sínteses foram caracterizados pelas
espectroscopias de infravermelho (FT-IR) e ressonância magnética nuclear (RMN). Com o
uso da RMN foi possível verificar a presença da dupla ligação vinílica formada na reação,
além de verificar a configuração trans característica para as azachalconas. Quanto a
atividade antioxidante de inibição do radical DPPH as chalconas sintetizadas apresentaram
resultados promissores, com a CHAL02 apresentando, na concentração de 100 mM, uma
inibição de 45,89%, podendo ser considerada um promissor antioxidante.
Palavras chaves
síntese orgânica; caracterização; atividade antioxidante
Introdução
As chalconas estão presentes como metabólitos secundários em diversas estruturas das
plantas, apresentando diversas funções, como por exemplo, atração para polinização,
pigmentação, além de atividades protetivas, como antifúngica, antibacteriana e
antioxidante (HERNÁNDEZ-RODRÍGUEZ; BAQUERO; LARROTA, 2019). Apresentam
uma estrutura geral 1,3-difenil-2-propen-1-ona, sendo consideradas cetonas α,β-
insaturadas, precursores naturais dos flavonoides (PATIL et al. 2009), e podem, através
de rotas sintéticas serem obtidas com a presença de diversos substituintes, com o intuito
de potencializar alguma atividade biológica de interesse, e nesse cenário podemos
colocar a presença de um anel piridínico na estrutura dessa classe de compostos,
resultando nas azachalconas, que são relatadas na literatura com boas propriedades anti-
inflamatória, antibacteriana, antiviral, antioxidante, entre outras (RADHAKRISHNAN, 2015;
SALEEM, 2021). Para a síntese desses compostos a metodologia mais comum é através
da condensação de Claisen-Schmidt, com catálise homogênea ácida ou básica.
(ZHUANG, 2017). Para verificar se os produtos de síntese possuem uma pureza
adequada foram realizadas caracterizações espectroscópicas, como por exemplo,
Espectroscopias no Infravermelho com Transformada de Fourier (FT-IR) e a Ressonância
Magnética Nuclear (RMN) de 1H, 13C e bidimensionais. Essa pureza
dos compostos é fundamental para a aplicação em atividades biológicas, pois deve-se ter
apenas o composto de estudo nas análises (ROZMER; PERJÉSI, 2016). Com isso, o
intuito deste trabalho foi a síntese, caracterização espectroscópica e atividade
antioxidante das azachalconas: (2E)-3-fenil-1-(2-piridinil)-2-propen-1-ona (CHAL01) e
(2E)-3-(2-furil)-1-(2-piridinil)-2-propen-1-ona (CHAL02).
Material e métodos
Para a síntese da (2E)-3-fenil-1-(2-piridinil)-2-propen-1-ona e (2E)-3-(2-furil)-1-(2-
piridinil)-2-propen-1-ona, utilizou-se o método de condensação aldólica de Claisen-
Schmidt, com catálise homogênea básica, empregando uma solução aquosa de hidróxido
de potássio 50%. Para isso adicionou-se a um balão de fundo redondo, a 2’-acetilpiridina
(0,01 mol) e 6 mL de solução de KOH (50%), e deixou-se em agitação magnética, com
banho de gelo, por 30 minutos. Posteriormente adicionou-se o benzaldeído (0,01 mol)
deixando a mistura reacional sob agitação, em banho de gelo, por um período de 24 h.
Esta é uma metodologia adaptada de Ciupa et. al 2012.
Após a obtenção dos compostos partiu-se para as caracterizações espectroscópicas. As
análises de FT-IR, foram realizadas em espectrômetro Shimadzu FT-IR Prestige-21, com
as amostras sendo preparadas em pastilha de brometo de potássio (KBr) e as condições
de operação do equipamento foram de 64 scans, resolução de 4 cm-1 e a faixa analisada
foi de 400-4000 cm-1. Já os espectros de RMN foram obtidos no espectrômetro de
ressonância magnética nuclear - Bruker 400MHz, AVANCE III, utilizando-se
aproximadamente 20 mg do composto em CDCl3, com tetrametilsilano (TMS)
como referência interna e temperatura da probe mantida próxima de 25 °C.
A atividade antioxidante foi avaliada pela metodologia de inibição do radical DPPH, que
consiste primeiramente na adição, de 160 μL de uma solução 1,5 mM de DPPH, seguida
da adição de 40 μL das soluções das amostras de estudo em variadas concentrações. Em
seguida deixou-se em descanso em ambiente livre de luminosidade por 30 minutos. O
último passo consistiu na leitura da absorbância no comprimento de onda de 517 nm, de
acordo com a metodologia descrita por Hamlaoui e colaboradores (2018).
Resultado e discussão
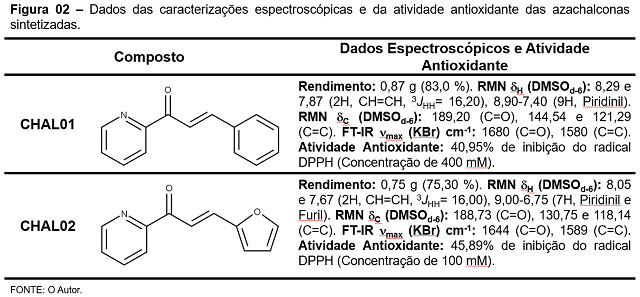
Para verificar a eficiência das sínteses e a pureza dos compostos foram realizadas as
caracterizações por FT-IR e RMN. Pelo FT-IR observou-se a presença de bandas em
aproximadamente 1680 e 1580 cm-1, que são referentes as ligações da
carbonila (C=O) e da ligação vinílica (C=C), proveniente da formação das azachalconas,
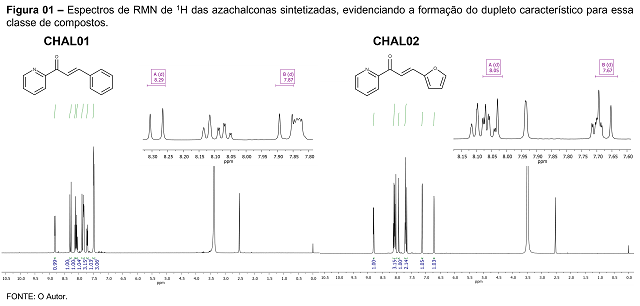
respectivamente (Figura 01). Para a CHAL01, observou-se através dos espectros de RMN
de 1H, a formação do produto desejado, a azachalcona, principalmente no que
diz respeito a formação da ligação dupla vinílica. Para isso verificou-se um sinal, na forma
de um dupleto, com δ=8,29 ppm proveniente do hidrogênio vinílico α-carbonílico e com
constante de acoplamento JHαHβ de 16,11 Hz, e outro dupleto, com δ=7,87
ppm, que corresponde ao hidrogênio vinílico β-carbonílico e com constante de
acoplamento JHβHα de 16,20 Hz, evidenciando assim a formação da chalcona
de interesse, conforme mostrado na Figura 01. Esses valores vão de acordo com os
descritos na literatura para azachalconas, caracterizando um valor comum para
acoplamento trans hidrogênio-hidrogênio pela ligação dupla (CIUPA, 2012; SALEEM,
2021). A CHAL02 apresentou um perfil semelhante do primeiro produto. Com relação a
atividade antioxidante de inibição do radical DPPH, a CHAL02 apresentou, na
concentração de 100 mM, uma inibição de 45,89%, enquanto a CHAL01, teve inibição
máxima de 40,95% do DPPH, porém somente na concentração de 400 mM. Essa
diferença está relacionada, provavelmente, com a presença do anel furano em sua
estrutura. Esses resultados são promissores para as azachalconas, porém é necessário o
estudo de outras metodologias de atividade antioxidante. A Figura 02 contém os dados
espectroscópicas e de atividade antioxidante dos compostos.
Conclusões
Pode-se observar que a metodologia empregada para a síntese dos compostos foi eficiente,
pois foram confirmados com as caracterizações espectroscópicas de FT-IR e RMN, sinais
característicos para a formação de chalconas, como por exemplo, os dois dupletos com
mesma constante de acoplamento 3JHH, o que está de acordo com a literatura para essa
classe de compostos. Com relação a atividade antioxidante de inibição do radical DPPH a
CHAL02 se apresentou como um promissor agente antioxidante, sendo necessários estudos
de outras metodologias de atividade antioxidante para comprovar seu potencial.
Agradecimentos
Ao Laboratório de Espectroscopia, Caracterização e Modelagem pela estrutura e discussões
cientificas, a CAPES pelo fomento à pesquisa, ao C-LABMU, pelas análises e a UEPG por
toda a estrutura.
Referências
CIUPA, A. et al. Simple pyrazoline and pyrazole “turn on” fluorescent sensors selective for Cd2+ and Zn2+ in MeCN. Organic & Biomolecular Chemistry, v. 10, n. 44, p. 8753, 2012.
HAMLAOUI, I. et al. Experimental and theoretical study on DPPH radical scavenging mechanism of some chalcone quinoline derivatives. Journal of Molecular Structure, v. 1156, p. 385–389, mar. 2018.
HERNÁNDEZ-RODRÍGUEZ, P.; BAQUERO, L. P.; LARROTA, H. R. Flavonoids. In: Bioactive Compounds. [s.l.] Elsevier, 2019. p. 265–288.
RADHAKRISHNAN, S. K. et al. Azachalcones: A new class of potent polyphenol oxidase inhibitors. Bioorganic & Medicinal Chemistry Letters, v. 25, n. 8, p. 1753–1756, abr. 2015.
ROZMER, Z.; PERJÉSI, P. Naturally occurring chalcones and their biological activities. Phytochemistry Reviews, v. 15, n. 1, p. 87–120, 12 fev. 2016.
SALEEM, F. et al. Synthesis of azachalcones, their α-amylase, α-glucosidase inhibitory activities, kinetics, and molecular docking studies. Bioorganic Chemistry, v. 106, n. May 2020, p. 104489, jan. 2021.
ZHUANG, C. et al. Chalcone: A Privileged Structure in Medicinal Chemistry. Chemical Reviews, v. 117, n. 12, p. 7762–7810, 28 jun. 2017.
















