Autores
Lessa, R.C.S. (UNIVERSIDADE FEDERAL FLUMINENSE) ; de Abreu, M.F.S. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Madriaga, V.G.C. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Lima, T.M. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Moraes, M.C. (UNIVERSIDADE FEDERAL FLUMINENSE)
Resumo
A imobilização de enzimas em suportes sólidos tem se apresentado como uma
poderosa ferramenta para viabilizar a reutilização das mesmas em ensaios
biológicos. Além disso, confere elevada estabilidade frente a variações na
temperatura, pH e presença de solventes orgânicos. Neste trabalho é relatado o
estudo da imobilização da enzima 5’-deoxi-5’-metiltioadenosina fosforilase de
Schistosoma mansoni (SmMTAP) em sílica mesoporosa amino funcionalizada através do
uso do glutaraldeído como espaçador. Os resultados obtidos evidenciam que a
enzima SmMTAP foi imobilizada com retenção da sua atividade catalítica e
demonstrou estabilidade durante seis dias. A otimização das condições reacionais
permitiu observar a importância do tempo reacional e da quantidade do suporte
contendo a enzima imobilizada na formação do produto.
Palavras chaves
imobilização de enzimas; ensaio de atividade; suporte sólido
Introdução
A imobilização de enzimas em suportes sólidos apresenta-se como uma estratégia
viável para o desenvolvimento de métodos para a triagem de novos inibidores. Esta
abordagem fornece aumento da estabilidade e possibilidade de reutilização das
enzimas em diferentes ensaios. Para isto, diferentes suportes sólidos são
estudados, dado que fatores como elevada área superficial, presença de grupos
funcionais compatíveis com reações de imobilização e boa relação custo-benefício
são desejáveis. (DE MORAES et al, 2019).
De modo a tornar possível a fixação das enzimas nos suportes, a principal
estratégia explorada por nosso grupo de pesquisa é a formação de ligação
covalente entre enzima e suporte utilizando-se de um espaçador, pois evita o
processo de dessorção da proteína (DE OLIVEIRA et al, 2022). Neste projeto,
optou-se pelo uso do glutaraldeído como espaçador para a imobilização da enzima
alvo no desenvolvimento de um ensaio enzimático off-line. Nesta abordagem, a
reação enzimática e a análise da formação do produto ocorrem duas etapas
distintas: as reações ocorrem em microtubos contendo a enzima imobilizada e o
substrato; o suporte sólido é separado do meio reacional, e o sobrenadante é
analisado em um sistema de cromatografia líquida de alta eficiência (CLAE) para a
quantificação do produto formado.
A enzima 5’-deoxi-5’-metiltioadenosina fosforilase de Schistosoma mansoni
(SmMTAP), selecionada como alvo neste trabalho, atua na via de salvação de
purinas do parasita que não realiza a síntese de novo, sendo, portanto,
consideradas alvos para a busca por novas terapias no tratamento da
esquistossomose. Neste trabalho, a enzima SmMTAP foi imobilizada covalentemente
em sílica mesoporosa e sua atividade foi monitorada através da quantificação da
adenina formada por CLAE.
Material e métodos
O material mesoporoso foi produzido e fornecido pelo grupo de pesquisa do Professor Dr. Thiago de Melo Lima. A enzima SmMTAP
foi expressa e purificada de acordo com a metodologia descrita na literatura (TORINI et al., 2012). A adenina formada foi
separada da adenosina em um sistema de CLAE-DAD, utilizando uma coluna analítica ZORBAX Eclipse XDB C-18 Agilent (4,6 x 15
mm, 5μm) como fase estacionária, e como fase móvel uma mistura contendo acetonitrila e acetato de amônio 20mM pH 6,0 (5:95,
v/v) a 0,8 mL.min-1, 260nm (KIEBLING et al, 2004). Sua quantificação foi conduzida pela construção de uma curva analítica
através da injeção de concentrações crescentes de adenina (1; 2,5; 5; 10; 25; 50; 100μM) em triplicata.
Adicionou-se 2,5mg do material mesoporoso em um microtubo e lavou-se com 1 mL de tampão fosfato 100mM pH 7,4 duas vezes.
Adicionou-se 1mL de uma solução aquosa de glutaraldeído (GA) 5% (v/v) e deixou-se sob agitação em agitador orbitalar por 3 h.
Em seguida, centrifugou-se o microtubo, retirou-se a solução de GA e repetiu-se o procedimento de lavagem. Adicionou-se a
enzima (681μg) em um volume final de 1mL em tampão fosfato 100mM pH 7,4. Deixou-se sob agitação em agitador orbitalar por 4 h
à 4oC. Então, o microtubo foi centrifugado e recolheu-se o sobrenadante para posterior quantificação de enzima residual. Por
fim, adicionou-se 1mL de glicina 1M e deixou-se sob agitação orbitalar por 15 minutos para então fazer mais duas lavagens
(XIMENES et al., 2021).
As reações enzimáticas foram otimizadas avaliando-se diferentes quantidade do suporte contendo a enzima imobilizada (1, 5, 10
e 20μg) em diferentes tempos reacionais (5, 10, 20 e 30 min), utilizando-se o substrato adenosina a 40μM. Ao final,
centrifugou-se e recolheu-se o sobrenadante para injetar no CLAE-DAD.
Resultado e discussão
A linearidade do método cromatográfico para quantificação da adenina foi avaliada pela construção de uma curva analítica
(y=17824x+1066,75, R2=0,9999), enquanto a precisão (0,99-14,37%) e exatidão (92,3-119,3%) foram avaliadas pela análise de
soluções de controle de qualidade do método.
O procedimento de imobilização da enzima SmMTAP em sílica mesoporosa por ligação covalente apresentou rendimento de 27,5%,
estimado através da quantificação da enzima SmMTAP em solução antes e após o procedimento de imobilização.
As reações realizadas em duplicata com diferentes massas de material mesoporoso e em diferentes tempos reacionais
permitiram observar que um maior período sob agitação orbitalar fornece melhores resultados catalíticos. Foi possível
quantificar a adenina formada apenas com 20 e 30 minutos como tempos reacionais. A Tabela 1 apresenta os resultados
obtidos.
Tabela 1. Otimização das condições reacionais com a enzima SmMTAP imobilizada em sílica mesoporosa avaliando-se
quantidade do suporte e tempo reacional.
Procedeu-se um estudo de estabilidade (Tabela 2) em 24, 48, 96 e 120 horas utilizando-se 100μg do material mesoporoso
contendo enzima imobilizada.
Tabela 2. Potencial catalítico das enzimas imobilizadas no material mesoporoso ao longo de um período de 120 horas.
Evidenciou-se que 10 minutos de tempo reacional foi possível obter significativa melhora no desempenho catalítico e
reprodutibilidade.
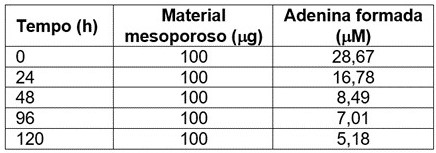
Potencial catalítico das enzimas imobilizadas no material mesoporoso ao longo de um período de 120 horas.
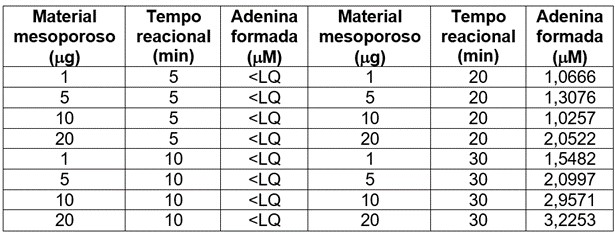
Otimização das condições reacionais com a enzima SmMTAP imobilizada em sílica mesoporosa avaliando-se quantidade do suporte e tempo reacional.
Conclusões
A enzima SmMTAP foi imobilizada com sucesso em sílica mesoporosa com retenção de
sua atividade catalítica, significativo rendimento e estabilidade. A atividade da
enzima imobilizada foi monitorada através da quantificação da adenina formada,
utilizando-se um método desenvolvido e validado neste trabalho, de acordo com a
RDC
166/2017. O estudo das condições reacionais evidenciou que a enzima alvo possui
catálise lenta, como relatado na literatura. As próximas etapas deste trabalho
incluem o estudo da reusabilidade deste suporte em ensaios sucessivos e o emprego
da metodologia em ensaios de triagem de novos inibidores enzimáticos.
Agradecimentos
O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de
Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001, FAPERJ
e
CNPq.
Referências
DE MORAES, M. C. M.; CARDOSO, C.L.; CASS, Q. B. Solid-Supported Proteins in the Liquid Chromatography Domain to Probe Ligand-Target Interactions. Frontiers in Chemistry, vol 7, 1-16, 2018.
DE OLIVEIRA, P. C. O.; LESSA, R. C.; CEROULO, M. S.; WEGERMANN, C. A.; DE MORAES, M. C. On-flow enzymatic inhibitor screening: the emerging success of liquid chromatography-based assays. Frontiers in Analytical Science, accepted article, 2022.
KIEBLING, P.; SCRIBA, G. K. E.; SUB, F.; WERNER, G.; KNOTH, H.; HARTMANN, M. Journal of Pharmaceutical and Biomedical Analysis, vol 36, p. 535-539, 2004.
TORINI, J. R.; NETO, J. B.; DE MARCO, R.; PEREIRA, H. D. Crystal Structure of Schistosoma mansoni Adenosine Phosphorylase/5’-Methylthioad- enosine Phosphorylase and Its Importance on Adenosine Salvage Pathway. PLoS Neglected Tropical Diseases, vol 10, e0005178, 2016.
XIMENES, I. A. T.; ALBINO, M.; SANGREGORIO, C.; CASS, B. C.; DE MORAES, M. C. On-flow magnetic particle activity assay for the screening of human purine nucleoside phosphorylase inhibitors. Journal of Chromatography A, vol 1663, p. 462740-462766, 2022.
















