Autores
Costa, G.N.S. (INT) ; Galdeano, M.C. (EMBRAPA) ; Tonon, R.V. (EMBRAPA) ; Figueiredo, N.G. (INT) ; Mellinger-silva, C. (EMBRAPA) ; Freitas, S.P. (EQ/UFRJ) ; Almeida, E.L. (EQ/UFRJ)
Resumo
As sementes são um subproduto do processamento da uva para obtenção do suco, de
vinhos e, também da extração do óleo. Os efeitos benéficos à saúde atribuídos aos
extratos de sementes são bastante divulgados. Os modelos de digestão in vitro
permitem simular as condições do trato gastrointestinal, a influência do processo
sobre os compostos presentes na matriz e avaliar a sua bioacessibilidade. Este
trabalho teve como objetivo avaliar a bioacessibilidade dos compostos fenólicos
totais (TPC) e a capacidade antioxidante remanescente de um extrato de sementes de
uva após a simulação da digestão gastrointestinal in vitro. A bioacessibilidade
dos TPC variou entre 2 e 10% e, todas as fases apresentaram capacidade
antioxidante remanescente (148-1533 μmol TE/g).
Palavras chaves
Subprodutos; Compostos fenólicos; Sustentabilidade
Introdução
Embora os compostos fenólicos isolados sejam prontamente disponíveis para
absorção, exercendo assim efeitos benéficos ao organismo humano, isso pode não
ser de fato real para compostos fenólicos contidos em matrizes sólidas, como por
exemplo, a farinha de sementes de uva integral. Desta forma, extrair e
concentrar estes compostos pode ser um interessante passo para torná-los
bioacessíveis durante a digestão. Estudos relativos à avaliação dos efeitos da
digestão sobre os compostos bioativos presentes nos alimentos têm contribuído
para a interpretação dos resultados de pesquisas tecnológicas associadas à
nutrição humana e ao desenvolvimento de diversos produtos alimentícios, pois
possibilitam o estudo do destino metabólico de compostos potencialmente
bioativos presentes na matriz alimentícia (ALMINGER et al., 2014; GIL-SÁNCHEZ et
al., 2017; LAZARO et al., 2018). A bioacessibilidade é uma das respostas obtidas
pela simulação da digestão gastrointestinal in vitro, e é definida como a
quantidade de cada composto ingerido que é liberado da matriz alimentícia e fica
disponível para absorção e metabolização após a digestão. Assim, por meio de
testes in vitro, é possível uma maior compreensão dos efeitos dos compostos
bioativos no organismo humano (PALAFOX-CARLOS et al., 2011).
Os modelos de digestão in vitro têm sido utilizados com o objetivo de estudar
alterações estruturais, a digestibilidade, liberação e bioacessibilidade de
diversos compostos. De modo geral, estes modelos consistem da simulação das
condições gastrointestinais utilizando enzimas digestivas (MINEKUS et al., 2014;
ALMINGER et al., 2014). Além disto, os modelos in vitro são mais rápidos,
baratos e permitem simular os principais efeitos da digestão em uma matriz
alimentícia sem envolver as questões éticas necessárias para realização de
testes in vivo (McCLEMENTIS; LI, 2010; MINEKUS et al., 2014).
Na literatura científica atual, não existem estudos relacionados à digestão in
vitro e bioacessibilidade de extratos ricos em fibras antioxidantes obtidos a
partir de sementes de uva. Desta forma, este trabalho teve como objetivo
realizar a simulação da digestão gastrointestinal in vitro e a fermentação
colônica do extrato rico em fibras antioxidantes (AFE) obtido a partir de
sementes de uva provenientes da indústria vitivinícola, assim como avaliar a
bioacessibilidade dos compostos fenólicos totais (TPC) e a o seu potencial
antioxidante.
Material e métodos
O extrato rico em fibras antioxidantes (351,4 ± 10,3 g/kg) foi obtido conforme
metodologia proposta em trabalho anterior (COSTA et al., 2019). Um modelo in
vitro estático foi utilizado para simular as fases da digestão gastrointestinal
humana (MINEKUS et al., 2014). A fermentação colônica foi realizada após a
finalização da simulação das fases oral, gástrica e intestinal da digestão in
vitro (Guergoletto et al., 2016). O teor CFT foi determinado de acordo com a
metodologia descrita por Singleton e Rossi (1965), sendo os resultados expressos
em miligramas equivalentes de ácido gálico (GAE) por g de amostra (mg GAE/g).
A capacidade antioxidante foi determinada por três diferentes métodos, como
descrito a seguir: Capacidade de absorção de radicais oxigênio (ORAC) (ZULUETA,
ESTEVE, FRÍGOLA, 2009). Para isto, utilizou-se um leitor de fluorescência (TECAN
Infinite®, Männedorf, Suíça). A capacidade de eliminação de radicais ABTS
foi conduzida conforme descrito por Re et al. (1999). A análise de capacidade
antioxidante pelo método de captura de radicais DPPH foi realizada conforme
metodologia proposta por Brand-Williams, Cuvelier e Berset (1995). Os resultados
foram expressos em micromols equivalentes de Trolox (TE) por grama de AFE (μmol
TE/g).
A bioacessibilidade foi avaliada por meio da análise dos CFT na amostra não
digerida e das fases oral, gástrica, intestino delgado e após a fermentação
colônica. Os resultados foram expressos em percentual, levando em consideração a
concentração dos compostos presentes na amostra após a simulação da digestão
gastrointestinal in vitro e a concentração dos compostos na amostra íntegra. Da
mesma forma foi determinada a capacidade antioxidante remanescente. Os dados
foram coletados a partir de três experimentos independentes e apresentados como
a média ± desvio padrão. Os dados foram tratados estatisticamente utilizando o
software Statistica 7.0 (StatSoft, Inc., Tulsa, OK, EUA), por meio de análise de
variância (ANOVA), considerando o teste de Tukey para a verificação da
existência de diferenças significativas entre as médias, com um nível de
confiança de 95%.
Resultado e discussão
Após a simulação da digestão in vitro, a bioacessibilidade dos TPC variou entre
2 e 10% (Figura 1), sendo observados maiores valores nas fases gástrica e
intestinal, o que pode ter ocorrido devido a liberação de compostos fenólicos
bioacessíveis da matriz em consequência do ambiente químico alterado
(TAGLIAZUCCHI, 2010). Os altos valores de TPC após a simulação da fermentação
colônica (T24) podem ser explicados pela transformação de uma parte dos
compostos fenólicos em novas estruturas, com diferentes propriedades químicas,
devido à exposição da matriz alimentar às condições do meio (BERMÚDEZ-SOTO;
TOMÁS-BARBERÁN; GARCÍA-CONESA, 2007).
O processo de digestão in vitro afetou significativamente a bioacessibilidade
dos compostos fenólicos presentes no AFE. Além disto, os resultados obtidos
indicam que apenas uma pequena fração destes compostos estaria disponível para
absorção após a digestão. Isto sugere que os compostos fenólicos do AFE podem
estar fortemente ligados a compostos macromoleculares e/ou formando complexos
com minerais e proteínas da matriz, o que reduz a sua solubilidade e,
consequentemente a sua bioacessibilidade, tornando-os indisponíveis para
absorção (XU; DIOSADY, 2000).
Há uma grande diversidade de ensaios in vitro para a determinação do potencial
antioxidante de produtos alimentícios e/ou compostos isolados. Cada uma destas
técnicas é baseada em diferentes mecanismos e, por isto, se torna interessante
que seja utilizada a combinação de diferentes métodos para a obtenção de
informações mais detalhadas e completas em relação às propriedades antioxidantes
(ALAM et al., 2013).
A capacidade antioxidante remanescente (Figura 1) expressa
em porcentagem o quanto a amostra ainda é capaz de inibir radicais livres após
ser submetida a cada etapa do processo de digestão. Observou-se que todas as
fases geradas após a simulação da digestão in vitro apresentaram uma capacidade
antioxidante remanescente. Os resultados obtidos corroboram com resultados da
literatura que, indicam uma redução da capacidade antioxidante passando da fase
gástrica para a fase intestinal (GULLON et al., 2015). Deve-se levar em
consideração que após a simulação da fermentação colônica (T24), os valores de
capacidade antioxidante remanescente foram bastante elevados, o que pode ter
ocorrido devido à formação de compostos de elevada capacidade antioxidante,
assim como por interferência de compostos do meio de fermentação no método
analítico.
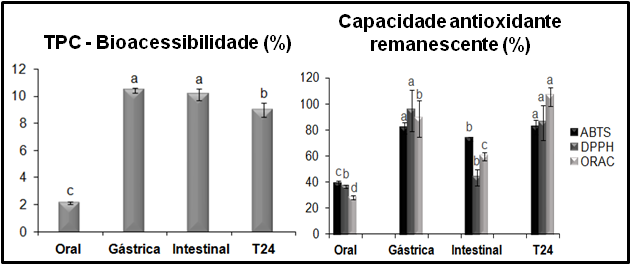
Bioacessibilidade dos TPC e capacidade antioxidante remanescente (B) após a digestão in vitro e fermentação colônica (T24) do AFE.
Conclusões
Este estudo fornece informações relacionadas à bioacessibilidade dos compostos
fenólicos de um extrato rico em fibras antioxidantes obtido de sementes geradas
pela indústria de processamento de uvas. O modelo de digestão in vitro utilizado,
apesar de apresentar limitações, mostrou-se apropriado para estudo dos compostos
fenólicos presentes no AFE, uma vez que foi viável a quantificação destes
compostos nas frações geradas após a digestão. Os resultados obtidos sugerem que o
AFE pode ser usado como um potencial ingrediente funcional, uma vez que, após a
simulação da digestão gastrointestinal in vitro observou-se ainda a presença de
compostos com capacidade antioxidante nas diferentes fases.
Agradecimentos
Os autores gostariam de agradecer a Vinícola RioSol, grupo ViniBrasil (Lagoa
Grande, Pernambuco, Brasil) pela disponibilização bagaço de uva da variedade
Alicante Bouschet para realização do estudo.
Referências
ALAM, M. N.; BRISTI, N. J.; RAFIQUZZAMAN, M. Review on in vivo and in vitro methods evaluation of antioxidant activity. Saudi Pharmaceutical Journal, v. 21, n. 2, p. 143-152, 2013.
ALMINGER, M. et al. In vitro models for studying secondary plant metabolite digestion and bioaccessibility. Comprehensive Reviews in Food Science and Food Safety, v. 13, n.4; p. 413-436, 2014.
BERES, C.; et al. Towards integral utilization of grape pomace from winemaking process: A review. In press, Waste Management, v. 68, 581-594, 2017.
BERMÚDEZ-SOTO, M. J.; TOMÁS-BARBERÁN, F. A.; GARCÍA-CONESA, M. T. Stability of polyphenols in chokeberry (Aronia melanocarpa) subjected to in vitro gastric and pancreatic digestion. Food Chemistry, v. 102, p. 865-874, 2007.
BRAND-WILLIAN, W.; CUVELIER, M. E.; BERSET, C. Use of a free radical method to evaluate antioxidant activity. LWT-Food Science and Technology. v. 28, n. 1, p. 25-30, 1995.
COSTA, G. N. S. et al. Grape seed pomace as a valuable source of antioxidant fibers. Journal of the Science of Food and Agriculture, v. 99, p. 4593-4601, 2019.
GIL-SÁNCHEZ, I. et al. Dynamic gastrointestinal digestion of grape pomace extracts. Bioacessible phenolic metabolites and impacto on human gut microbiota. Journal of Food Composition and Analysis, v. 68, p. 41-52, 2018.
GUERGOLETTO, K. B. et al. In vitro fermentation of juçara pulp (Euterpe edulis) by human colonic microbiota. Food Chemistry, v. 196, p. 251-258, 2016.
GULLON, B. et al. Structural features and assessment of prebiotic activity of refined arabinoxylooligosaccharides from wheat bran. Journal of Functional Foods, v. 6, p. 438-449, 2014.
McCLEMENTS, D. J.; LI, Y. Review of in vitro digestion models for rapid screening of emulsion-based systems. Food & Function., v. 1, n.1, p. 32-59, 2010.
MINEKUS, M. et al. A standardised static in vitro digestion method suitable for food – an international consensus. Food & Function, v. 5, n. 6, p. 1113-1124, 2014.
PALAFOX-CARLOS, H.; AYALA-ZAVALA, J. F.; GONZÁLEZ-AGUILAR, G. A. The role of dietary fiber in the bioaccessibility and bioavailability of fruit and vegetable antioxidants. Journal of Food Science, v, 76, n. 1, p. R6–R15, 2011.
RE, R. et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine, v. 26, n. 9, p. 1231-1237, 1999.
SINGLETON, V. L.; ROSSI J. A. Colorimetry of total phenolics with phosphomolybdic- phosphotungstic-acid reagents. American Journal of Enology and Viticulture, v. 16, n. 3, p. 144-158, 1965.
TAGLIAZUCCHI, D. et al. In vitro bio-accessibility and antioxidant activity of grape polyphenols. Food Chemistry, v. 120, n. 2, p. 599-606, 2010.
XU, L.; DIOSADY, L. L. Interactions between canola proteins and phenolic compounds in aqueous media. Food Research International, v. 33, p. 725-731, 2000.
ZULETA, A.; ESTEVE, M. J.; FRÍGOLA, A. ORAC and TEAC assays comparison to measure the antioxidant capacity for food products. Food Chemistry, v. 114, n. 1, p. 310-316, 2009.
















