Autores
Freitas, B.P. (INSTITUTO NACIONAL DE TECNOLOGIA) ; Oliveira, A.H. (EMBRAPA AGROINDÚSTRIA DE ALIMENTOS) ; Kunigami, C.N. (INSTITUTO NACIONAL DE TECNOLOGIA) ; Novo, A.A. (INSTITUTO NACIONAL DE TECNOLOGIA) ; Matta, V.M. (EMBRAPA AGROINDÚSTRIA DE ALIMENTOS) ; Jung, E.P. (INSTITUTO NACIONAL DE TECNOLOGIA) ; Ribeiro, L.O. (INSTITUTO NACIONAL DE TECNOLOGIA)
Resumo
Este trabalho teve como objetivo avaliar o efeito do solvente na
recuperação dos compostos bioativos do resíduo do despolpamento de umbu (casca,
caroço e torta do refino da polpa). Etanol e acetona em diferentes concentrações
foram empregados na extração. Os resultados mostraram que o uso de acetona
promoveu maior recuperação dos compostos fenólicos, resultando em extratos mais
antioxidantes (p<0,05). A capacidade antioxidante dos extratos cetônicos não
variou com aumento do percentual de acetona no solvente (30% - 70%) (p>0,05). A
casca apresentou-se como a fração mais rica em compostos bioativos. Conclui-se que
o resíduo de umbu pode ser usado como matéria-prima para obtenção de compostos de
maior valor agregado, empregando acetona 30% como solvente.
Palavras chaves
Spondias tuberosa; resíduos agroindustriais; compostos bioativos
Introdução
O umbuzeiro, da família Anacardiaceae, é uma árvore frutífera nativa encontrada
na região semiárida do Brasil. Segundo o IBGE, em 2020, foram produzidas cerca
de 9,5 toneladas de umbu (Spondias tuberosa), principalmente, no estado da Bahia
e no norte de Minas Gerais, os quais foram responsáveis por 78% da produção
total no país. O umbu possui um tempo de vida útil pós-colheita curto, o que
acarreta em perdas quando comercializado in natura. Entretanto, por ser uma
fruta com rendimento de polpa entre 55 a 65%, o principal produto comercial da
sua cadeia produtiva é a polpa congelada. (Lima et al., 2002).
O processo de despolpamento é conhecido pela geração de resíduos, representados,
principalmente, por cascas e sementes. A fim de reduzir o impacto do setor
agroindustrial no meio ambiente, tais biomassas têm sido aproveitadas por
conterem compostos bioativos que apresentam diferentes atividades biológicas,
representando, desta forma, uma alternativa para agregação de valor à cadeia
produtiva das frutas. De acordo com Ribeiro et al. (2019), a casca de umbu
apresentou relevante teor de compostos fenólicos e carotenoides. Já os caroços,
caracterizados por Dias et al. (2019), além dos compostos fenólicos, foram ricos
em ácidos graxos insaturados.
Os compostos bioativos presentes em matrizes vegetais, de forma geral, atuam
como agentes biológicos que podem trazer benefícios à saúde, por exemplo, a
redução na incidência de doenças crônicas. As propriedades funcionais desses
compostos são associadas ao seu potencial antioxidante no organismo, uma vez que
atuam sobre os radicais livres (Verena et al., 2012). Entretanto, esses
compostos precisam ser recuperados da matriz por meio de técnicas de extração.
Dentre os parâmetros de extração, o tipo de solvente exerce grande influência na
eficiência do processo. Dessa forma, o objetivo deste trabalho foi avaliar o
efeito do solvente na recuperação dos compostos bioativos presentes no resíduo
do despolpamento de umbu (casca, caroço e a torta do refino da polpa).
Material e métodos
Para o desenvolvimento deste trabalho, as frutas, obtidas no comércio local da
cidade do Rio de Janeiro, foram despolpadas em uma despolpadeira horizontal. O
resíduo obtido, constituído por casca, caroço e torta do refino da polpa foram
secos em estufa com circulação de ar forçada a 50 °C por aproximadamente 72
horas. As amostras secas (casca e torta) foram desintegradas em um processador
doméstico para a obtenção de um material homogêneo. O caroço, após a secagem,
foi triturado em moinho de facas.
As amostras foram submetidas à extração sólido-líquido na razão 1:10 (m/v) sob
agitação constante de 150 rpm a temperatura ambiente. Foram avaliados como
solvente as misturas etanol:água e acetona:água nas concentrações de 30 e 70%
(E30, E70, A30 e A70), a fim de determinar o melhor solvente para a extração dos
compostos de interesse. Após uma hora de extração, os extratos foram filtrados
em papel de filtro e armazenados sob congelamento até a realização dos ensaios
de conteúdo de fenólicos totais (CFT) e capacidade antioxidante.
Para a determinação de CFT (Singleton; Rossi, 1965), 250 µL do extrato filtrado
e diluído foram reagidos com 1,25 mL do reagente Folin-Ciocalteu 10% e
adicionados de 1,0 mL de carbonato de sódio 7,5% (m/v). As amostras foram
aquecidas a 50 ºC por 15 minutos e resfriadas a temperatura ambiente. A
absorbância foi medida em 760 nm. Os resultados foram expressos em mg de ácido
gálico equivalente por 100 g (mg AGE/100 g).
A capacidade antioxidante, mensurada a partir da reação dos extratos com o
radical ABTS•+, foi realizada conforme Gião et al. (2007). 30 μL dos extratos
foram reagidos com 3 mL da solução de radical ABTS•+ a temperatura ambiente por
6 minutos. Ao final, as absorbâncias foram lidas em 734 nm. Os resultados foram
obtidos a partir da elaboração de uma curva padrão de Trolox, sendo expressos em
μmol de Trolox/g.
Os dados foram analisados estatisticamente por meio do software Statistica
versão 13 (Dell Inc., Tulsa, OK, USA). Análise de variância (ANOVA) e teste de
Tukey foram empregados para verificar a diferença entre os resultados (p<0,05).
Os experimentos foram realizados em triplicata e os resultados apresentados como
média ± desvio padrão.
Resultado e discussão
Com base na Figura 1, é possível observar que todas as amostras, independente do
tipo de solvente, apresentaram potencial antioxidante, o que está relacionado
com CFT extraído de cada matriz. A casca de umbu foi a amostra com maior
disponibilidade de compostos bioativos, fornecendo extratos mais antioxidantes
(p<0,05). Entretanto, como resíduos agroindustriais, os resultados
mostram que todas as frações do despolpamento de umbu podem ser aproveitadas
para obtenção de compostos bioativos, em função do seu uso como antioxidantes
naturais em formulações alimentícias.
A eficiência de recuperação dos compostos bioativos foi influenciada pela
polaridade do solvente empregado no processo de extração, sendo destacado o uso
de acetona 30%. De acordo com Oreopoulou et al. (2019), a eficiência de um
solvente depende principalmente da sua capacidade de solubilizar os compostos de
interesse, sendo os solventes de polaridade intermediária, como aqueles
resultantes de sistemas binários (acetona+água), os mais eficientes para
extração de compostos fenólicos, uma vez que eles podem influenciar a
permeabilidade da célula vegetal, afetando a bicamada fosfolipídica da membrana.
Embora o etanol seja o solvente tradicionalmente preferido em processos de
extração, em função da sua baixa toxicidade, neste trabalho os resultados
obtidos tanto a 30% quanto a 70% de etanol na solução extratora foram inferiores
àqueles observados para o sistema acetona/água (p<0,05).
Resumidamente, o incremento de acetona na solução extratora não favoreceu de
forma significativa a recuperação dos compostos fenólicos na casca e na torta de
umbu, exceto para o caroço. Além disso, o potencial antioxidante das amostras
não foi influenciado pelo incremento de acetona no solvente. Assim, o uso de
acetona 30% é destacado entre os solventes avaliados.
Quanto aos extratos obtidos empregando acetona como solvente, os CFT a
partir da casca, do caroço e da torta de umbu foram 3334; 947 e 1903 mg AGE
100/g, respectivamente. Para o potencial antioxidante, os valores foram 149; 44;
95 μmol de Trolox/g, respectivamente. Valores estes que corroboram o uso desse
resíduo para obtenção de compostos de maior valor agregado.
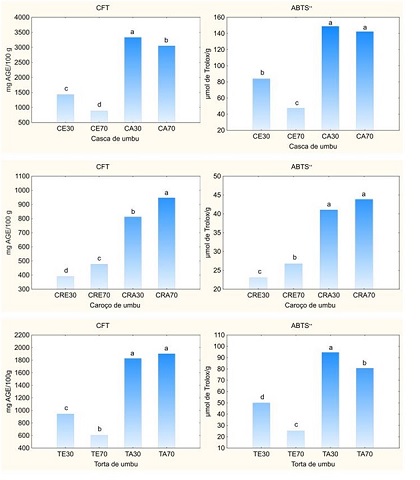
Conteúdo de fenólicos totais (CFT) e capacidade antioxidante (ABTS•+) dos extratos da casca (C), caroço (CR) e torta (T) de umbu.
Conclusões
Conclui-se que a acetona 30% foi o melhor solvente para obtenção de extratos
antioxidantes a partir do resíduo do despolpamento de umbu, sendo uma estratégia
para agregação de valor à cadeia agroindustrial desta fruta nativa de importância
socioeconômica para a Caatinga.
Agradecimentos
Os autores agradecem ao CNPq, ao Instituto Nacional de Tecnologia e a Embrapa
Agroindústria de Alimentos.
Referências
DIAS, J.L.; MAZZUTTI, S.; DE SOUZA, J.A.L. FERREIRA, S.R.S. SOARES, L.A.L.; STRAGEVITCH, L. DANIELSKI, L. Extraction of umbu (Spondias tuberosa) seed oil using CO2, ultrasound and conventional methods: Evaluations of composition profiles and antioxidant activities. J. Supercrit. Fluids 2019, 145, 10–18.
GIÃO MS, GONZÁLEZ-SANJOSÉ ML, RIVERO-PÉREZ MD, PEREIRA CI, PINTADO ME, MALCATA FX, Infusions of Portuguese medicinal plants: Dependence of final antioxidant capacity and phenol content on extraction features. J. Sci. Food Agric., v. 87, p. 2638–2647, 2007.
IBGE. Produção da extração vegetal e da silvicultura – PEVS 2020: quantidade produzida na extração vegetal. Rio de Janeiro: IBGE, 2020. Disponível em: https://https://cidades.ibge.gov.br/brasil/pesquisa/16/12705. Acesso em: 31 de agosto de 2022.
LIMA, E. D. P. A.; LIMA, C. A. A; ALDRIGUE, M. L.; GONDIM, P. S. Caracterização física e química dos frutos da umbu-cajazeira (Spondias spp.) em cinco estádios de maturação da polpa e néctar. Revista Brasileira de Fruticultura. Jaboticabal, v. 24, n. 2, p. 338-343, 2002.
OREOPOULOU, A., TSIMOGIANNIS, D., OREOPOULOU, V.. Extraction of polyphenols from aromatic and medicinal plants: an overview of the methods and the effect of extraction parameters. In: Watson, R.R. (Ed.), Polyphenols in Plants. Academic Press, pp. 243–259, 2019.
RIBEIRO, L. DE O., VIANA, E. DE S., GODOY, R.L. DE O., FREITAS, S.C. DE, FREITAS, S.P., MATTA, V.M. DA, Nutrients and bioactive compounds of pulp, peel and seed from umbu fruit. Cienc. Rural, v. 49, e20180806, 2019.
SINGLETON, V.L., ROSSI, J.A.. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. American Journal of Enology and Viticulture 16, 144–158, 1965
VERENA B. OLIVEIRA, LETÍCIA T. YAMADA, CHRISTOPHER W. FAGG, MARIA G.L. BRANDÃO. Native foods from Brazilian biodiversity as a source of bioactive compounds. Food Research International, v.48,170-179, 2012.
















