Autores
Barragán-cárdenas, A.C. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Insuasty-cepeda, D.S. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; López-meza, J.E. (UNIVERSIDAD MICHOACANA DE SAN NICOLÁS DE HIDALGO) ; García-castañeda, J.E. (UNIVERSIDAD NACIONAL DE COLOMBIA) ; Rivera-monroy, Z.J. (UNIVERSIDAD NACIONAL DE COLOMBIA)
Resumo
El cáncer de mama es la principal causa de muerte prematura en mujeres
latinoamericanas, los tratamientos actuales presentan una baja selectividad
generando fuertes secuelas. El péptido palindrómico LfcinB (21-25)Pal presenta
actividad citotóxica frente a diferentes líneas celulares derivadas de cáncer y
selectividad frente a células no cancerosas. Para determinar si cambios en la
carga/longitud de este péptido incrementan su actividad; mediante SPPS se obtuvo
6 péptidos con adición o deleción de Arg en el N, C-terminal o ambos. La
actividad citotóxica y selectiva fue evaluada frente a MCF-7, MDA-MB-231, MCF-12
y fibroblastos; evidenciando que la inclusión de Arg en el extremo N-terminal
mantuvo la selectividad aumentando su citotoxicidad, la cual está relacionada
con eventos apoptóticos.
Palavras chaves
Lactoferricina; Péptidos; Cáncer de mama
Introdução
En Latinoamérica la principal causa de muerte prematura en mujeres es el cáncer;
siendo el cáncer de mama el que presenta la mayor incidencia, prevalencia y
mortalidad (BRAY et al.,2021)(GLOBOCAN,2020). Los tratamientos actuales carecen
de la efectividad necesaria para combatir esta enfermedad y opciones
terapéuticas como los péptidos anticancerígenos (PACs) han cobrado relevancia
debido a su rápida interacción, toxicidad reducida, alta solubilidad y facilidad
de modificación (ADESSI et al., 2005).
La Lactoferricina Bovina (LfcinB) es un PAC que ejerce efecto citotóxico
dependiente de la concentración, contra varios tipos de cáncer, su mecanismo de
acción se basa en la unión a la membrana mediante interacciones electrostáticas
y posterior inducción de apoptosis o necrosis (SADIQ et al.,2018). La secuencia
RRWQWR es el motivo mínimo que ha presentado efecto citotóxico frente a células
cancerosas (RICHARDSON et al.,2009).
A partir de este motivo, secuencias peptídicas se han evaluado; dentro de ellas
el palíndromo RWQWRWQWR ha presentado efecto citotóxico dependiente de la
concentración frente a células de cáncer de mama MDA-MB-468, MDA-MB-231 y MCF-7
con IC50 de 72, 135 y 66 µM, respectivamente. Su selectividad se ha evaluado en
células no cancerosas como: fibroblastos, células MCF-12 y BMEC, en las cuales
la reducción de la viabilidad ha sido mínima (BARRAGÁN, URREA et al.,2020).
Utilizando la síntesis química de péptidos en fase sólida se obtuvo péptidos
modificados con el fin de lograr mayor efecto citotóxico contra las células
cancerosas. En este trabajo se estableció que algunas modificaciones en la carga
y longitud del palíndromo RWQWRWQWR, dadas por la inserción o deleción de Arg en
los extremos incrementaron el efecto citotóxico frente a células MCF-7.
Material e métodos
Los péptidos fueron sintetizados, caracterizados y evaluados en ensayos
celulares de acuerdo con los protocolos dispuestos por (RODRÍGUEZ et al.,2020).
Brevemente, se usó resina Rink amida con 0,46 mEq/g de sustitución como soporte
sólido. La elongación de las secuencias peptídicas se realizó mediante pasos
sucesivos de desprotección del grupo alfa-amino, activación del aminoácido Fmoc
y acoplamiento del aminoácido a la cadena en crecimiento unida al soporte sólido
en agitación durante 2h. Los péptidos se escindieron de la resina añadiendo
TFA/agua/TIS/EDT (92,5/2,5/2,5/2,5 % v/v) con agitación por 8h. Los péptidos se
precipitaron utilizando éter dietílico a 20 °C, se centrifugaron a 2500 rpm
durante 5 min y el remanente de éter dietílico se eliminó por evaporación a
temperatura ambiente. Luego los péptidos fueron purificados vía RP-SPE y
caracterizados mediante RP-HPLC y ESI-QTOF.
Las células MCF-7, MDA-MB-231, MCF-12 y fibroblastos fueron cultivadas en medio
RPMI-1640 suplementado al 10% son suero fetal bovino (SFB), con penicilina y
estreptomicina 1%. El cultivo se mantuvo en incubación a 37 °C con 5% de CO2. La
viabilidad celular se determinó mediante ensayo MTT (BARRAGÁN et al., 2022), en
placas de 96 pozos a razón de 1x104 células/pozo tratadas con péptido
reconstituido en medio a concentraciones de 200, 100, 50, 25, 12.5 y 6,25 µg/mL
por 2h. Como blanco se utilizó DMSO, control negativo células sin péptido y
control positivo células con H2O2. Se determinó tipo de muerte celular mediante
ensayo de citometría de Anexina V y 7AAD, se corroboró la inducción de necrosis
por medición de calcio intracelular, y la inducción de apoptosis fue evaluada
mediante la activación de Caspasa 8 y 9, para todos los casos se evaluaron
células tratadas con el IC50 del péptido por 2h
Resultado e discussão
A partir del péptido palindrómico LfcinB(21-25)Pal se diseñaron, sintetizaron,
purificaron, caracterizaron y evaluaron 6 péptidos (Tabla 1). Los péptidos
propuestos y el palíndromo fueron viables sintéticamente presentando todos
purezas superiores al 88% y siendo su relación m/z acorde al peso teórico.
El palíndromo presentó actividad semejante a la previamente reportada lo que
indica que el proceso de producción y evaluación de péptidos es reproducible.
Las adiciones de Arg en el extremo N-terminal incrementaron la actividad
citotóxica, reduciendo los IC50 frente a las líneas cancerosas, mientras que su
adición en C-terminal disminuyó la selectividad. Esto permite refutar la
hipótesis de que aumentar la longitud a más de 10 residuos y la carga neta
cercana a +7 aumenta la actividad (CAMILIO,2013)(YANG et al.,2002), ya que la
ubicación del residuo en la secuencia es de mayor importancia. La disminución de
la carga sólo tuvo mayor efecto sobre la línea MCF-7 cuando se eliminaron las
Arg de ambos extremos y a su vez disminuyó la selectividad, lo cual fortalece la
idea de que son las cargas positivas las que generan la interacción con la
membrana cargada negativamente de la célula cancerosa (HOSKIN et al.,2008).
El péptido promisorio LfcinB(20-25)Pal-TN no produce necrosis en gran medida
puesto que no se incrementó el calcio intracelular en las células tratadas; el
ensayo Anexinav-7AAD mostró que el 70% de la población está en apoptosis y menos
del 5% en necrosis (Figura 1), a su vez se vió activación de apoptosis por vía
intrínseca y extrínseca. Esto nos permite inferir que la adición de la Arg
indujo un cambio en el efecto citotóxico comparado con el péptido palindrómico,
ya que la activación de caspasas no se da en igual manera.
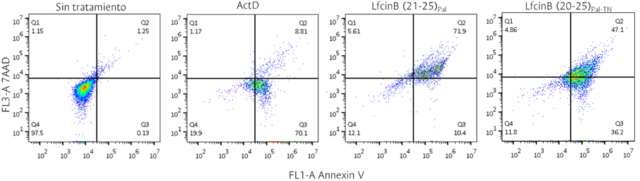
Determinación de apoptosis/necrosis en células MCF-7 tratadas por 2h con el IC50 de los péptidos LfcinB (21-25)Pal y LfcinB (20-25)Pal-TN
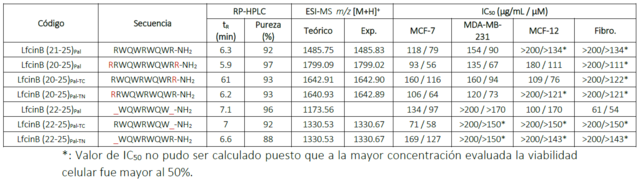
Caracterización y evaluación de actividad citotóxica de péptidos derivados del palíndromo LfcinB(21- 25)Pal
Conclusões
Este trabajo permitió dilucidar que la disminución de longitud y carga del péptido
palindrómico LfcinB (21-25)Pal disminuye la selectividad, sugiriendo que generar
péptidos catiónicos es clave para la diferenciación entre células cancerosas y no
cancerosas. También se evidenció que la ubicación de la carga en la secuencia es
relevante para potenciar el efecto citotóxico. La inclusión de Arg en el extremo
N-terminal de la secuencia mantuvo la selectividad del palíndromo aumentando
ligeramente su citotoxicidad, la cual está relacionada con eventos apoptóticos.
Agradecimentos
Esta investigación se realizó con el apoyo financiero de COLCIENCIAS 807–2018,
Proyecto código 110180762973, contrato RC No. 706–2018.
Referências
ADESSI, C., & SOTO, C. (2005). Converting a Peptide into a Drug: Strategies to Improve Stability and Bioavailability. Current Medicinal Chemistry, 9(9), 963–978. https://doi.org/10.2174/0929867024606731
BARRAGÁN-CÁRDENAS, A. C., INSUASTY-CEPEDA, D. S., CÁRDENAS-MARTÍNEZ, K. J., LÓPEZ-MEZA, J., OCHOA-ZARZOSA, A., UMAÑA-PÉREZ, A., RIVERA-MONROY, Z. J., & GARCÍA-CASTAÑEDA, J. E. (2022). LfcinB-Derived Peptides: Specific and punctual change of an amino acid in monomeric and dimeric sequences increase selective cytotoxicity in colon cancer cell lines. Arabian Journal of Chemistry, 15(8), 103998. https://doi.org/10.1016/j.arabjc.2022.103998
BARRAGÁN-CÁRDENAS, A. C., URREA-PELAYO, M., NIÑO-RAMÍREZ, V. A., UMAÑA-PÉREZ, A., VERNOT, J. P., PARRA-GIRALDO, C. M., FIERRO-MEDINA, R., RIVERA-MONROY, Z., & GARCÍA-CASTAÑEDA, J. (2020). Selective cytotoxic effect against the MDA-MB-468 breast cancer cell line of the antibacterial palindromic peptide derived from bovine lactoferricin. RSC Advances, 10(30), 17593–17601. https://doi.org/10.1039/d0ra02688c
BRAY, F., LAVERSANNE, M., WEIDERPASS, E., & SOERJOMATARAM, I. (2021). The ever-increasing importance of cancer as a leading cause of premature death worldwide. Cancer, 127(16), 3029–3030. https://doi.org/10.1002/cncr.33587
CAMILIO, K. A. (2013). Short Lytic Anticancer Peptides as a Novel Therapy against Cancer. 68. https://munin.uit.no/bitstream/handle/10037/5489/thesis.pdf?sequence=6&isAllowed=y
GLOBOCAN. (2020). Latin America and the Caribbean. 522, 1–2.
HOSKIN, D. W., & RAMAMOORTHY, A. (2008). Studies on anticancer activities of antimicrobial peptides. Biochimica et Biophysica Acta - Biomembranes, 1778(2), 357–375. https://doi.org/10.1016/j.bbamem.2007.11.008
RICHARDSON, A., DE ANTUENO, R., DUNCAN, R., & HOSKIN, D. W. (2009). Intracellular delivery of bovine lactoferricin’s antimicrobial core (RRWQWR) kills T-leukemia cells. Biochemical and Biophysical Research Communications, 388(4), 736–741. https://doi.org/10.1016/j.bbrc.2009.08.083
RODRÍGUEZ, V., PINEDA, H., ARDILA, N., INSUASTY, D., CÁRDENAS, K., ROMÁN, J., URREA, M., RAMÍREZ, D., FIERRO, R., RIVERA, Z., & GARCÍA, J. (2020). Efficient Fmoc Group Removal Using Diluted 4-Methylpiperidine: An Alternative for a Less-Polluting SPPS-Fmoc/tBu Protocol. International Journal of Peptide Research and Therapeutics, 26(1), 585–587. https://doi.org/10.1007/s10989-019-09865-9
SADIQ, I. Z., BABAGANA, K., DANLAMI, D., ABDULLAHI, L. I., & KHAN, A. R. (2018). Molecular Therapeutic Cancer Peptides: A Closer Look at Bovine Lactoferricin. Asian Journal of Biochemistry, Genetics and Molecular Biology, 1(2), 1–9. https://doi.org/10.9734/ajbgmb/2018/v1i2471
YANG, N., REKDAL, STENSEN, W., & SVENDSEN, J. S. (2002). Enhanced antitumor activity and selectivity of lactoferrin-derived peptides. Journal of Peptide Research, 60(4), 187–197. https://doi.org/10.1034/j.1399-3011.2002.21008.x
















