Autores
Saez, G. (UNIVERSIDAD ANDRES BELLO, SEDE CONCEPCION) ; Jara, G. (UNIVERSIDAD ANDRES BELLO, SEDE CONCEPCION) ; Ybarra, D.E. (UNQ- DCYT- LBN (GBEYB- IMBICE- CONICET)) ; Del Valle Alonso, S. (UNQ- DCYT- LBN (GBEYB- IMBICE- CONICET)) ; Alvira, F.C. (UNQ- DCYT- LBN (GBEYB- IMBICE- CONICET)) ; Montanari, J. (UNAHUR- LANSAB) ; Barraza, L.F. (UNIVERSIDAD ANDRES BELLO, SEDE CONCEPCION)
Resumo
En éste trabajo se muestra el desarrollo de una nueva familia de nanopartículas
fotosensibilizadoras (NP-PSs), y su aplicación como agente antibacteriano. Las NP-
PSs se obtuvieron por autoensamblaje molecular entre un dendrímero PAMAM de cuarta
generación (DG4) y Floxina B (PHL). Las NP-PSs obtenidas fueron caracterizadas y
optimizadas por Dynamic Light Scattering, encontrando una relación molar óptima
DG4:PHL de 1:15. En estas condiciones, se obtienen partículas de tamaño
nanométrico (260,6±14,83 nm), monodispersas (PdI=0,264±0,025), biocompatibles y
con propiedades bactericidas de amplio espectro. Finalmente, las NP-PSs
presentaron propiedades fotoquímicas superiores respecto a PHL libre, por lo que
presentan un gran potencial para ser aplicadas en la terapia fotodinámica
antibacteriana.
Palavras chaves
Nanopartículas PSs; Terapia Fotodinámica; Tratamiento antibacterian
Introdução
La resistencia antimicrobiana (RAM) se ha convertido en uno de los problemas de
salud pública más serios a nivel mundial, provocando más de 700 mil muertes por
año debido a infecciones causadas por bacterias y otros microorganismos patógenos
resistente. Según datos de la organización mundial de la salud (OMS), se estima
que la RAM podría causar más de 10 millones de muertes en los próximos 25 años y
ocasionar pérdidas económicas que superarían los 100 billones de dólares para
2050.
Aunque se trata de un fenómeno que se produce de forma natural, la RAM ha
experimentado un crecimiento acelerado en las últimas décadas debido a factores
como el uso indiscriminado de los antibióticos, la transferencia de bacterias
resistentes desde animales a humanos, y la contaminación de fuentes de agua con
medicamentos antimicrobianos, entre otras.
Por este motivo, la OMS solicitó a la comunidad científica poner énfasis en el
desarrollo de tratamientos alternativos para enfrentar las enfermedades
infecciosas. Un ejemplo de tratamiento antimicrobiano libre de antibiótiocos es la
terapia fotodinámica (TFD). La TFD utiliza moléculas conocidas como
fotosensibilizadores (PS) junto con la aplicación de luz de longitud de onda
específica para producir especies reactivas de oxígeno (ROS) que ejercen efectos
citotóxicos irreversibles sobre estos microorganismos patógenos, los que no tienen
la posibilidad de desarrollar resistencia al tratamiento.
Sin embargo, la aplicación de la TDF está limitada por las propiedades del PS, los
que suelen presentar cortos tiempos de vida media, baja capacidad de penetrar la
membrana celular, etc. Para superar estas limitaciones, en este trabajo se
presenta la obtención de nanopartículas fotosensibizadoras con propiedades
fotoquímicas y bactericidas mejoradas.
Material e métodos
Las nanopartículas fotosensibilizadoras (NP-PSs) se obtuvieron en PBS a pH=7,4 por
el método de auntoensambaje molecular. Los bloques de construcción de las NP-PSs
fueron un dendrímero poliamidoamina (PAMAM-NH2) de cuarta generación (DG4) y
Foxina B (PHL). La obtención de las NPs se optimizó mediante experimentos de
titulación por Dynamic Light Scattering (DLS) en un equipo Zetasizer Advance Lab.
(Malver, Inglaterra). Las NPs obtenidas fueron caracterizadas por DLS y medidas
de potencial-Z. El ensayo de inhibición bacteriana fue realizado con cepas de E.
coli y S. aureus; y los estudios de biocompatibilidad con la línea celular 3T3; a
24 h y 4 h de exposición, respectivamente. Los sistemas biológicos se trataron con
distintas diluciones de PHL, DG4, DG4:PHL, EDTA y EDTA:PHL. Se determinó el
crecimiento bacteriano mediante medición de DO a 600 nm. Mientras que la
viabilidad celular fue determinada por reducción de MTT, captura de rojo neutro y
tinción con cristal violeta. Se determinó la producción de especies reactivas de
oxigeno (ROS) de los sistemas PHL, DG4 y DG4-PHL. La generación de oxígeno
singlete se detectó utilizando el reactivo Singlet Oxygen Sensor Green® (SOSG),
mientras que la generación de radicales hidroxilo se detectó utilizando el
reactivo de hidroxifenilfluoresceína(HPF), ambos disponibles comercialmente
(Thermo Fisher Scientific). Para ello, se añadieron 5 µL de una solución de SOSG o
HPF en metanol de 2 mmol L−1 a 100 µL de disoluciones de PHL, DG4 y DG4-PHL en una
placa de 96 pocillos. Los sistemas se irradiaron con una fuente de luz LED verde
(520 nm, 100 W m−2) durante 30 min en intervalos de tiempo de 1 a 5 min. Todos los
experimentos se llevaron a cabo por triplicado utilizando un lector de placas
múltiples POLARstar OMEGA (BMG Labtech).
Resultado e discussão
Los estudios de agregación por DLS sugieren que la relación molar óptima DG4:PHL
es de 1:15. En estas condiciones, se obtienen partículas de simetría esférica,
tamaño nanométrico (260,6±14,83nm), monodispersas (PdI=0,264±0,025) y con una
carga superficial positiva (8,71±2,88), levemente inferior a la del DG4 comercial
(17,3±0,8)[Fig 1]. Por otro lado, hemos evaluado la citotoxicidad de los sistemas-
tratamiento (PHL, DG4, DG4:PHL, EDTA y EDTA:PHL) en la línea celular 3T3
(fibroblastos emb. murinos) y determinado efectos biológicos mediante tres ensayos
bioquímicos. Nuestros resultados sugieren que, en ausencia de luz, los sistemas-
tratamiento no presentan efectos citotóxicos, con excepción de DG4 4μM. Por otra
parte, los ensayos de actividad antibacteriana sobre inóculos de S. Aureus y E.
coli en ausencia de luz concuerdan con lo reportado en bibliografía [RASOOLY et
al,2002], es decir: PHL mostró actividad antibacteriana frente a S. aureus, pero
no mostró inhibición cuando se la expuso frente a E. coli. Sin embargo, el
complejo DG4:PHL mostró un 50% de inhibición en ambas cepas a una concentración de
2.7:40 μM. Este resultado es comparable con el tratamiento con EDTA 15 mM y
EDTA:PHL, pero empleando concentraciones de DG4 ~5000 veces menores que de EDTA.
En cuanto al DG4, este no mostró inhibición significativa, por lo que podríamos
inferir que la actividad bactericida del complejo DG4:PHL se debe a un efecto
sinérgico entre ambos sistemas [Fig 2]. Finalmente, se observó que DG4:PHL
presentó propiedades fotoquímicas superiores respecto a PHL libre, es decir
presentó un aumento en la producción de ROS (1O2 y OH rad) luego de la excitación
con luz verde por un período de 30 min, lo que se atribuye a un efecto
fotoprotector ejercido por DG4 sobre PHL al formar las NP-PSs.
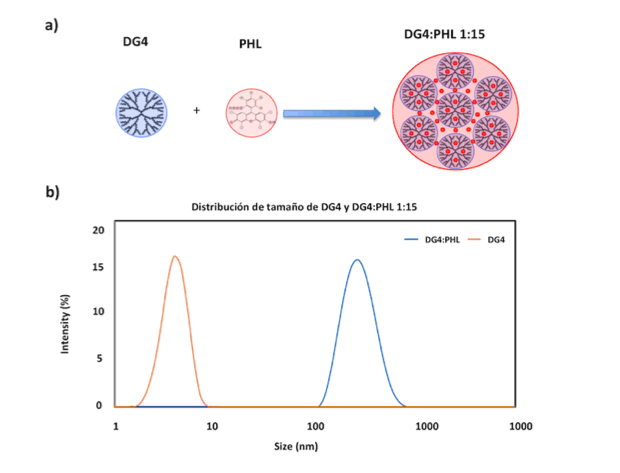
a) Esquema de la obtención de NP-PSs por autoensamblaje molecular entre DG4 y PHL. b) Distribución de tamaño de DG4 y las NP-PSs optimizadas.
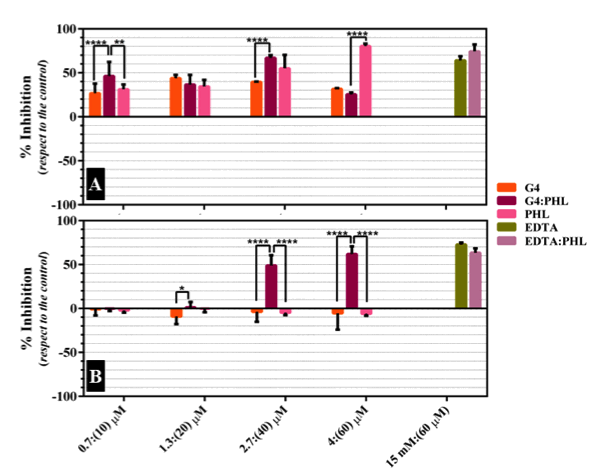
Porcentajes de inhibición de cultivos (A) S. aureus y (B) E. coli con G4 (naranja), G4:PHL (magenta), PHL (rosa), EDTA (verde) y EDTA:PHL (violeta)
Conclusões
El método de ensamblaje molecular es una técnica rápida y eficiente para obtener
NP-PSs entre dendrímeros PAMAM y colorantes de xanteno como PHL. La estructura, y
propiedades de estas NP-PSs dependen fuertemente de la relación molar DG4:PHL. En
condiciones óptimas, se obtienen NPs monodispersas, estables en disolución acuosa,
inocuas, con propiedades bactericidas de amplio espectro (aún en ausencia de luz)
y con propiedades fotoquímicas mejoradas. Por lo tanto, las NP-PSs obtenidas
representan un potencial candidato para su aplicación en la terapia fotodinámica
antibacteriana.
Agradecimentos
Los autores agradecen el financiamiento otorgado por el proyecto FONDECYT-ANID
11200611, Universidad Nacional de Quilmes PUNQ 1311/19.
Referências
RASOOLY, A; WEISZ, A. In vitro antibacterial activities of phloxine B and other halogenated fluoresceins against methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemother. 46(11), 3650-3, 2002.
















