Autores
Torres-sauret, Q. (UNIVERSIDAD JUÁREZ AUTÓNOMA DE TABASCO) ; Romero Ceronio, N. (UNIVERSIDAD JUÁREZ AUTÓNOMA DE TABASCO) ; Roa de La Fuente, L.F. (UNIVERSIDAD JUÁREZ AUTÓNOMA DE TABASCO) ; Gómez Rivera, A. (UNIVERSIDAD JUÁREZ AUTÓNOMA DE TABASCO) ; Vilchis Reyes, M. (UNIVERSIDAD JUÁREZ AUTÓNOMA DE TABASCO) ; Lobato García, C.E. (UNIVERSIDAD JUÁREZ AUTÓNOMA DE TABASCO)
Resumo
El sistema estructural de la chalcona (trans-1,3-difenil-2-propen-1-ona) así como sus análogos estructurales como las tiochalconas, son estructuras privilegiadas, debido a la gran variedad de actividades biológicas que han presentado, las cuales se han relacionado con la presencia de sustituyentes en los anillos aromáticos del sistema. En este trabajo, se presenta la síntesis de ocho compuestos de tipo tiochalcona mediante la reacción de Claisen-Schmidt con rendimientos por arriba del 80%. Los datos de RMN-protón y carbono-13 son consistentes con las estructuras esperadas. Se evaluó la propiedad antimicótica frente a Candida albicans. Tres de los compuestos mostraron actividad antimicótica moderada y el análisis de su estructura brinda orientación para la síntesis de derivados convenientem
Palavras chaves
antimicótico; tiofenilchalcona; Claisen-Schmidt
Introdução
Las trans-1,3-difenil-2-propen-1-onas (chalconas) así como sus análogos estructurales, representan una familia de compuestos la cual ha mostrado múltiples actividades biológicas, dependiendo de su composición estructural, tales como: antiviral, (JANKOVIC et al., 2020) anti-inflamatoria, anti-microbiana, anti-cancerígena, entre otras. Dichas propiedades han sido atribuidas principalmente al sistema de enona α,β-insaturada, aunque también están involucrados los anillos aromáticos y los sustituyentes presentes en los mismos, que al modificar la densidad de la nube electrónica favorece la interacción con las dianas celulares (ZHU et al., 2017). Estos compuestos, se pueden obtener mediante el aislamiento de extractos vegetales o por diversas rutas sintéticas, siendo la condensación de Claisen-Schmidt el proceso más utilizado (GUIDA et al., 1997). En nuestro laboratorio se han explorado procesos metodológicos, obteniendo buenos resultados en la síntesis de chalconas y análogos estructurales. Derivado de lo anterior, en este trabajo reportamos el proceso metodológico para la obtención de ocho tiofenilchalconas L1-8, así como su evaluación frente a C.albicans.
Material e métodos
REACCIÓN DE CONDENSACIÓN (compuestos L1-L7): a 1 mmol de benzaldehído en 2 mL de etanol se le adicionó 2-acetiltiofeno 1 (1 mmol) a 0 °C y agitó por 5 minutos. Posteriormente, se le adicionó por goteo una solución de NaOH 1 M (1 mmol, 1 mL). Al finalizar la adición, la mezcla se mantuvo en agitación vigorosa por 4 h (JANKOVIC et al., 2020 y CHANDRAPPA et al., 2010). REDUCCIÓN DE L7 PARA OBTENER L8: a 5 mmol del compuesto L7 en 6 mL de etanol se agregó Fe (15 mmol) y se agito a 60 °C por 5 minutos. Después, se agregó CaCl2 (5 mmol), seguido de 3 mL de agua. La mezcla se calentó a reflujo por 4 h (CHANDRAPPA et al., 2010). EVALUACIÓN DE LA ACTIVIDAD ANTIMICOTICA: La actividad antimicótica se desarrolla mediante siembra por estría simple como lo marca la CLSI (2012). Los ensayos siguieron el método de difusión en disco usando fluconazol (25 μg) como fármaco de referencia. Se utilizó dimetilsulfóxido (DMSO) como disolvente y diferentes concentraciones (25, 50, 100, 200 y 400 μg/sensidisco) de los compuestos L1-8. En cada placa previamente sembrada por triple estría con el inóculo, fueron colocados 8 sensidiscos (6 mm de diámetro). Todas las placas fueron incubadas durante 48 h, en una estufa de cultivo a 36 ºC Los resultados de los antibiogramas fueron registrados como inhibición del crecimiento (mm) (DOFE et al., 2017).
Resultado e discussão
SÍNTESIS Y CARACTERIZACIÓN DE LOS COMPUESTOS L1-L8: Durante el proceso de síntesis se obtuvieron ocho compuestos de tipo tiochalconas (L1-L8, Figura 1) producto de la reacción de condensación entre benzaldehídos sustituidos con 2-acetiltiofeno 1. En todos los casos, se obtuvieron sólidos de colores característicos para cada compuesto y los rendimientos de reacción fueron satisfactorios ya que oscilaron entre 81 y 87 %. Los espectros obtenidos por el análisis de RMN, son consistentes con las estructuras esperadas. ACTIVIDAD FRENTE A C. ALBICANS: De los compuestos analizados, solamente se encontró que L1-L3 presentaron una moderada inhibición del crecimiento de C. albicans (Figura 2A). La cuantificación del efecto antimicótico se resume en la figura 2, inciso B. Como puede observarse, la inhibición en el crecimiento de C. albicans por parte de los compuestos L1-L3 no es comparable al fluconazol empleado como antimicótico de referencia. Los resultados obtenidos para la moderada actividad antimicótica de los compuestos L1-L3, permiten establecer algunas consideraciones preliminares en cuanto a las posibles relaciones entre la estructura de las tiochalconas probadas y esta actividad biológica, ya que mientras L1, que corresponde a la tiochalcona sin sustituyentes presenta esta actividad, ésta se pierde con la presencia de grupos tanto electrodonadores como electroatractores en la posición para del anillo de benceno del sistema (compuestos L4-L8), mientras que la presencia de un grupo electroatractor (como lo es flúor) en las posiciones orto y meta del mismo anillo, conserva el efecto antimicótico aunque disminuye su intensidad.
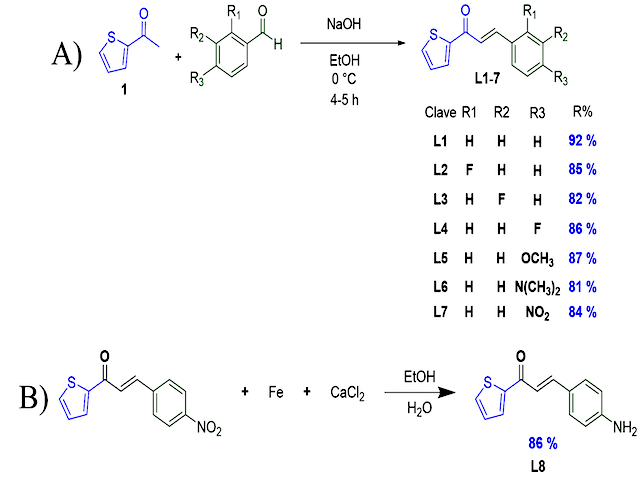
A) Síntesis para la obtención de L1-L7. B) Reducción del grupo nitro en L7.
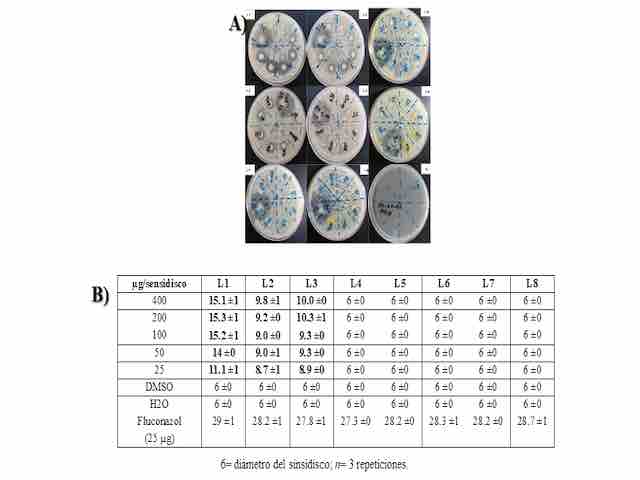
A) Evaluación antimicótica por el método de disco. B) tabla de cuantificación del efecto antimicótico.
Conclusões
Se obtuvieron ocho compuestos de tipo tiochalcona con rendimientos que oscilan entre 81-87%. La caracterización estructural se corroboró mediante RMN de protón y carbono-13, observándose en todos los productos una isomería trans en el sistema de la enona α,β-insaturada. Los compuestos L1-L3 mostraron una actividad moderada en la inhibición del crecimiento de C.albicans. Los resultados crean un precedente a seguir, en la búsqueda de chalconas convenientemente sustituidas para potenciar actividades biológicas específicas.
Agradecimentos
Referências
CHANDRAPPA, S.; VINAYA, K.; RAMAKRISHNAPPA T.; RANGAPPA, K. An efficient method for aryl nitro reduction and cleavage of azo compounds using iron powder/calcium chloride. Synlett, n. 20, 3019-3022, 2010.
CLSI, Clinical and Laboratory Standards Intitute. Performance standards for antimicrobial disk susceptibility tests. 2012.
DOFE, V. S.; SARKATE, A. P.; KATHWATE, S. H.; GILL, C. H. Synthesis, antimicrobial activity and antibiofilm activity of novel tetrazole derivatives. Heterocyl. Commun., n. 23(4), 325-330, 2017.
GUIDA, A.; HASSANE LHOUTY, M.; TICHIT, D.; FIGUERAS, F.; GENESTE, P. Hydrotalcites as bases catalysts kinetics of Claisen-Schmidt condensation, intramolecular condensation of acetonylacetona and synthesis of chalcone. Applied Catalysis A: General, n. 164(1-2), 251-264, 1997.
JANKOVIC, T.; TURKOVIC, N.; KOTUR-STEVULJEVIC, J.; VUJIC Z.; IVKOVIC, B. Differences in antioxidant potential of chalcones in human serum: in vitro study. Chem. Biol. Interact, n. 324, 109084, 2020.
JESUS, A. R.; MARQUES, A.P.; RAUTER, A.P. An Easy Approach to dihydrochalcones via chalcone in situ hydrogenation. Pure Appl. Chem., n. 88(4), 349-361, 2016.
ZHU, C.; WANG, R.; ZHENG, W.; CHEN, D.; YUE, X.; CAO, Y.; QIN, W.; SUN, H.; WANG, Y.; LIU, Z.; LI, B.; DU, J.; BU, X.; ZHOU, B. (2017). Synthesis and evaluation of anticancer activity of BOC26P, an ortho-aryl chalcone sodium phosphate as water-soluble prodrugs in vitro and in vivo. Biomedicine & Pharmacotherapy, n. 96, 551-562, 2017.
















