Autores
Giraldo Lorza, J.M. (UNIVERSIDAD DE ANTIOQUIA) ; Klaiss Luna, M.C. (UNIVERSIDAD DE ANTIOQUIA) ; Gallego Londoño, V. (UNIVERSIDAD DE ANTIOQUIA) ; Santa González, G.A. (INSTITUTO TECNOLÓGICO METROPOLITANO) ; Manrique Moreno, M. (UNIVERSIDAD DE ANTIOQUIA)
Resumo
La fluidez es una de las principales propiedades de las membranas celulares.
Numerosos estudios han relacionado los cambios en la fluidez con diferentes
condiciones médicas como el cáncer, por ello su relevancia y necesidad de estudio.
El objetivo de este trabajo consistió en caracterizar la fluidez de las membranas
de las líneas celulares de cáncer de seno MDA-MB-231, MCF-7 y de queratinocitos
humanos HaCaT por espectroscopia infrarroja. Además, se estudió las transiciones
de fase de células intactas y extractos lipídicos obtenidos de células cancerosas.
Los resultados mostraron similitud en el comportamiento termotrópico entre las
transiciones de las células y los extractos. Asimismo mostraron diferencias en la
fluidez entre las células MCF-7 y MDA-MB-231, que presentaron mayor fluidez
Palavras chaves
Células cancerígenas; Espectroscopia Infrarroja; Modelos de Membrana
Introdução
Todas las células están rodeadas por una membrana delgada, fluida y flexible que
cumple con diversas funciones fundamentales para la célula. Una de las
principales características de la membrana es la fluidez y se describe en
general como la facilidad de movimiento en el entorno de la membrana (ROBERTS,
p.1440, 2013). Numerosos estudios han relacionado cambios en la fluidez de
membrana con diferentes enfermedades, incluso cáncer y procesos de metástasis
(CHANG et al, 2016)(NICOLSON, 2015), por lo que resulta relevante desarrollar
estudios sobre esta temática.
Dado que las membranas son estructuras dinámicas constituidas mayormente por
lípidos, el seguimiento del comportamiento termotrópico de estos contiene
información respecto a la fluidez del sistema, donde influyen factores como
estructura y composición (KLAISS-LUNA y MANRIQUE-MORENO, 2022). Diversas
técnicas biofísicas han sido desarrolladas para llevar a cabo este tipo de
análisis en sistemas biológicos, entre las cuales se destaca la Espectroscopia
Infrarroja. Esta técnica registra las vibraciones de los principales grupos
funcionales presentes en las moléculas y proporciona información acerca de su
estructura molecular, interacción y comportamiento. Entre las grandes ventajas
se encuentra la aplicación por reflexión total atenuada (ATR), el cual
proporciona un control rápido y sensible en mediciones de fluidez de membrana
(ROBERTS, p.1440, 2013).
Este estudio tuvo como objetivo evaluar la fluidez de membrana de las líneas
celulares de cáncer de seno MDA-MB-231 y MCF-7, de origen metastásico y no
metastásico; como control no tumoral se emplearon las células HaCaT, derivadas
de queratinocitos humanos. Luego se realizó una comparación de esta propiedad
entre las células intactas y los extractos lipídicos.
Material e métodos
Cultivos celulares:Las líneas celulares de cáncer de seno MCF-7, MDA-MB-231 y de
queratinocitos humanos HaCaT se cultivaron en medio DMEM con suero bovino fetal
5%,100µg/ml penicilina y estreptomicina a 37°C con 5% CO2/95% aire. Para extraer
los lípidos, las células se sometieron a tripsinización, se lavaron con 2ml H2O,
se centrifugaron 6000rpm 15min 4°C y se liofilizó el sedimento.
Extracción lípidos:Se empleó el método Bligh y Dyer(CSEKE et al, 2011). Se
resuspendieron las células liofilizadas en 5ml H2O. La suspensión se transfirió
a un embudo de separación con un volumen final de 96ml de CHCl3:CH3OH:H2O
1:2:0.8. La extracción tuvo una duración de 18h, agitación cada 2h. En la etapa
final se adicionó CHCl3 para obtener una relación 1:1:0.4. Se recuperó la fase
orgánica y se concentró, se lavó 3 veces con NaCl 0.9%. Se recuperó la fase
orgánica con el extracto y se concentró por evaporación del solvente con N2.
Caracterización con Espectroscopia Infrarroja:Se utilizó el aditamento BioATRII
acoplado a un Tensor II(Bruker Optics, Alemania), resolución espectral 4cm−1,
120scans por espectro. 20µl de células en suspensión, 20µl de solución proteica
y 20µl de extracto se depositaron sobre el cristal, se evaporó el solvente y se
midió a 37°C. Luego se evaluó el comportamiento termotrópico de las células a
través de la extensión simétrica de CH2. Se adicionaron 20µl de buffer Hepes
10mM pH 7.4 al cristal,se registró el background en una rampa de temperatura
programada de 5-40°C, 1°C/min. Luego 0.3mg células en 20µl de buffer se
depositaron en el cristal, se evaporó el solvente con N2, se hidrató la muestra
con 20µl de buffer 10min a 37°C y se analizaron bajo las mismas condiciones. Los
espectros se analizaron entre 2970–2820cm−1 a través de OPUS y se graficó el
resultado.
Resultado e discussão
Los espectros de la Figura 1 corresponden a las fases de la extracción. Se
aprecian los modos vibracionales característicos de proteínas, lípidos,
carbohidratos(ROBERTS, p.1440, 2013). Cabe resaltar que los espectros soportan
la eficiencia del método Bligh y Dyer para la obtención de lípidos(BREIL et al,
2017). El extracto exhibe las bandas 2920cm-1 ʋasCH2, 2870cm-1 ʋsCH2 de ácidos
grasos,1740cm-1 ʋC=O, carbonilo éster y ʋPO2- 1300-1000cm-1(ROBERTS, p.1440,
2013), evidenciando ausencia de proteínas y presencia de fosfolípidos y
colesterol. Se observa diferencia de intensidad de absorción de las bandas en
cada muestra, proporcional a la concentración de las moléculas presentes.
Para evaluar el comportamiento termotrópico de las células se hizo seguimiento a
la posición del número de onda de ʋsCH2, parámetro fisicoquímico inherente al
empaquetamiento de los lípidos en las membranas. Dependiendo de la temperatura,
la bicapa lipídica tiene diferentes estados, a temperaturas bajas la fase de
gel, y a temperaturas altas, la líquido-cristalino. La función que representa
este comportamiento es de tipo sigmoidal para lípidos puros, sin embargo, para
sistemas multicomponentes se tiene un comportamiento lineal. La figura 2a)
muestra el comportamiento termotrópico lineal de las células por la variedad de
especies lipídicas que las conforman. Se puede apreciar que MDA-MB-231 presentó
mayor fluidez, se ha reportado que las células cancerosas metastásicas son más
fluidas ya que lo requieren para el transporte e invasión hacia otros
tejidos(CHANG et al, 2016)(NICOLSON, 2015). HaCaT mostró mayor fluidez que MCF-7
por el alto contenido de colesterol en queratinocitos(KLEIN et al, 2012). Por
último, la figura 2b) ilustra la similitud en comportamiento de las células MCF-
7 y su extracto.
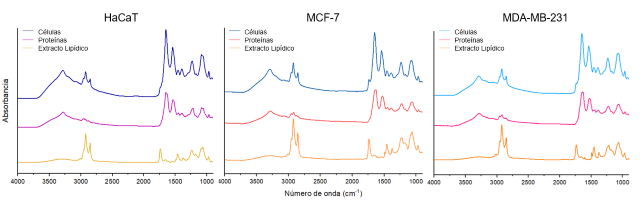
Caracterización por espectroscopia infrarroja de cada fase involucrada en la extracción, correspondiente a células, proteínas y lípidos a 37°C
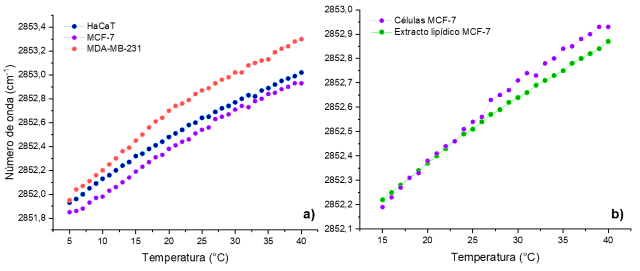
Dependencia de los números de onda de ʋCH2 en función de la temperatura de los lípidos en a)las células y b)extracto y células MCF-7 Hepes 10mM pH 7.4
Conclusões
Los resultados de este estudio permitieron demostrar la eficiencia del método de
extracción Bligh y Dyer para la obtención de lípidos totales, asimismo permitieron
identificar diferencias de fluidez entre las líneas celulares evaluadas, siendo
MDA-MB-231 la que mostró tener mayor fluidez. Lo anterior concuerda con lo
reportado en la literatura sobre la relevancia y necesidad de fluidez para las
células cancerosas metastásicas. Este estudio demuestra que los extractos
lipídicos pueden ser utilizados como modelos para el seguimiento y evaluación de
las propiedades de membrana.
Agradecimentos
Este trabajo fue financiado por el Ministerio de Ciencia Tecnología e innovación-
MinCiencias (Proyecto Cód. 111584467189, RC 946-2019).
Referências
BREIL, C.; ABERT-VIAN, M.; ZEMB, T.; KUNZ, W.; CHEMAT, F. "Bligh and Dyer" and Folch Methods for Solid–Liquid–Liquid Extraction of Lipids from Microorganisms. Comprehension of Solvatation Mechanisms and towards Substitution with Alternative Solvents. International Journal of Molecular Sciences, 18(4), 708, 2017.
CHANG J.T.; ZHAO, W.; PRIJIC, S.; URBAN, B.C.; TISZA, M.J.; ZUO, Y.; LI, L.; TAN, Z.; CHEN, X.; MANI, S.A. Candidate Antimetastasis Drugs Suppress the Metastatic Capacity of Breast Cancer Cells by Reducing Membrane Fluidity. Cancer Research, 76(7), 2037–2049, 2016.
CSEKE, L. J.; KIRAKOSYAN, A.; KAUFMAN, P.B.; WESTFALL, M.V. Handbook of Molecular and Cellular Methods in Biology and Medicine. CRC Press: Boca Raton, FL, USA, 2011.
KLAISS-LUNA, M.C.; MANRIQUE-MORENO, M. Infrared Spectroscopic Study of Multi-Component Lipid Systems: A Closer Approximation to Biological Membrane Fluidity. Membranes, 12, 2022.
KLEIN, A.S.; SCHAEFER M.; KORTE, T.; HERRMANN, A.; TANNERT, A. HaCaT keratinocytes exhibit a cholesterol and plasma membrane viscosity gradient during directed migration. Experimental Cell Research, 318(7), 809-818, 2012.
NICOLSON, G. L. Cell Membrane Fluid–Mosaic Structure and Cancer Metastasis. Cancer Research, 75(7), 1169–1176, 2015.
ROBERTS, G. Encyclopedia of Biophysics. Springer Berlin, Heidelberg, p. 1440, 2013.
















