Autores
Cunha, L.R.C. (UFSJ) ; Magalhães, L.F. (UFSJ) ; Munk, M. (UFJF) ; Fayer, L. (UFJF) ; Campos-júnior, P.H.A. (UFSJ) ; Schiavon, M.A. (UFSJ)
Resumo
Os nanomateriais (NM) livres de metais tóxicos têm ganhado maior atenção, em
especial, os pontos quânticos (PQs) CuInZnS (CIZS) revestidos com uma camada de
ZnS. Neste trabalho sintetizou-se PQs CZIS/ZnS estabilizados com
dodecanotiol (DDT), visando sua aplicação em meio biológico a superficie dos PQs
foi modificada com os seguintes ligantes: ácido 3-mercaptopropiônico (MPA), ácido
tioglicólico (TGA) e glutationa (GSH). Para o estudo de marcação biológica foram
utilizados fibroblastos extraídos da cauda de camundongos e células da região do
pescoço e da cabeça. Utilizando o microscópio de fluorescência foi possível
observar a marcação das células utilizando MPA e TGA. Os testes de citotoxicidade
demonstraram que os NM não induziram a morte das células.
Palavras chaves
Ponto quântico; CZIS/ZnS; Marcação biológica
Introdução
Por definição, Pontos Quânticos (PQs) são materiais semicondutores
nanocristalinos coloidais que possuem diâmetro variando entre 2 e 15 nm, (PARK
et al, p. 704, 2021) podendo ser divididos de acordo com os diferentes grupos da
tabela periódica que seus elementos constituintes pertencem, como: (sulfeto de
chumbo, telureto de cádmio e fosforeto de gálio) (XIANG et al, p. 437, 2015).
Uma das características mais interessantes dos PQs é a mudança nas propriedades
ópticas em função do tamanho. Esse processo ocorre quando o tamanho do
semicondutor é reduzido abaixo do Raio de Bohr do éxciton, que é a distância
média entre os portadores de carga (buraco e elétron), durante o movimento
destes portadores na rede cristalina. Desta forma, o éxciton fica dependente do
tamanho do nanomaterial. (JIA et al, p. 942, 2018)
Uma forma de controlar o tamanho das partículas, visto a influência deste nas
propriedades ópticas dos PQs, é utilizar ligantes de superfície. A função do
ligante é passivar eletronicamente a superfície do PQ, evitar aglomerações e
possibilitar processos Redox que envolvem acoplamento com outras estruturas. É
possível também realizar a troca de ligante depois de sintetizar o material,
substituindo um ligante de cadeia longa para um de cadeia curta, essa mudança
possibilita a dispersão das nanopartículas em meio aquoso, aumentando
consideravelmente suas aplicações. (VALE et al, p. 22, 2015)
Em geral, a maioria dos processos para síntese desses nanomateriais, utilizam
como precursores metais como Cd, Hg e Pb. A toxicidade destes materiais limita
as suas aplicações, especialmente na bioimagem e bioanálise, portanto o
desenvolvimento e uso de nanomateriais menos tóxicos tem atraído considerável
atenção. Assim, PQs baseados em cobre tem sido estudado recentemente devido à
sua baixa toxicidade, incluindo os binários (Cu2S, Cu2Se), ternários (CuInS2
(CIS), CuInSe2 (CISe) e AgInS2) e quaternários (CuInZnS (CIZS) e CuInZnSe).
(SANTOS et al, p. 814, 2020).
Os PQs quaternários apresentam propriedades ópticas interessantes, no entanto, o
seu rendimento quântico é, frequentemente, inferior a 20% devido à presença de
defeitos superficiais e estados de armadilha. Para melhorar as propriedades dos
nanomateriais, a engenharia de superfície tem sido utilizada otimizando a
passivação da superfície pela adição de uma casca, formando a estrutura
caroço/casca. Como resultado, buracos e elétrons ficam fortemente confinados na
região do núcleo, elevando o rendimento quântico (ɸf), a estabilidade e a
intensidade de luminescência desses materiais. Consequentemente, estes passam a
ser aplicáveis em diversas áreas, como em células solares, sensores para
identificação de metais, fotocatálise, LEDs e biomarcadores. (SHIM et al, p.
9968, 2021).
Em bioimagem os PQs são utilizados como uma alternativa atraente para as sondas
orgânicas em medições de fluorescência analíticas e biológicas. Estes
nanomateriais possuem diversas vantagens para análises biológicas, como: maior
absortividade molar, grande deslocamento Stokes, excelente fotoestabilidade e
possibilidade de acompanhar experimentos em tempo real por longos períodos. Uma
outra vantagem é a utilização em células vivas pela modificação da superfície
com diferentes ligantes, tais como anticorpos, peptídeos ou aminoácidos,
possibilitando obter nanodispositivos específicos para determinados alvos.
(ZHENG et al, p. 525, 2018)
(Niu et al, p. 136977, 2020) utilizaram uma sonda fluorescente baseada em PQs
CuInS2/ZnS para detecção de câncer colorretal. Nesse tipo de neoplasia, o cólon
começa produzir quantidades significativas do transportador de peptídeo
intestinal 1 (PepT1). Utilizando o tripeptídeo lisina-prolina-valina (KPV), que
possui alta afinidade com o PepT1 e atividade anti-inflamatória é possível
conjugar o PQs CIS/ZnS ao KPV e transportá-lo para as células do cólon,
funcionando como um agente terapêutico. Os estudos de citotoxicidade revelam que
as células permanecem em um nível de 90% de viabilidade, demonstrando a baixa
toxidade dos materiais.(Lian et al, p. 100943, 2020) sintetizaram PQs
CuInSe2/ZnS como biossonda devido a sua emissão no NIR-II, pequeno intervalo de
banda direto e grande raio de Bohr do éxciton. Nanossondas com emissão no
infravermelho próximo (NIR-II) tem atraído bastante atenção na última década,
podendo reduzir a dispersão de luz e profundidade de penetração, adequadas para
biodetecção sem autofluorescência. Nesse trabalho, utilizou-se a bioconjugação
do PQ com o anticorpo anti-epitelial de adesão celular (EpCAM) que pode detectar
especificamente células MCF-7 de câncer de mama humano.Com isso, esse trabalho
tem como objetivo a preparação e caracterização de PQs CZIS/ZnS e analisar a
eficiência e citocompatibilidade destes nanomateriais como potenciais candidatos
para criação de nanossondas fluorescentes, avaliando como diferentes ligantes de
superfície podem influenciar nesse processo.
Material e métodos
Os PQs CZIS foram preparados adicionando InCl3.4H2O, ZnCl2, CuCl, ácido oleico,
n-dodecanotiol (DDT) e octadeceno em um balão de três bocas. A solução foi
aquecida à 90 °C sob vácuo por 30 minutos. Posteriormente, ocorreu a purga com
argônio, elevando a temperatura para 180 °C por 5 minutos. Foi adicionado ao
meio reacional uma solução contendo enxofre e oleilamina, a qual foi resfriada
para 160 °C por 10 minutos. Para realizar a preparação da casca de ZnS, foi
utilizado uma solução estoque de ZnS, dissolvendo-se ZnCl2, oleilamina e
octadeceno em um balão de três bocas, aquecido à 90 °C por 30 min em atmosfera
inerte sob agitação. Após esse período, a temperatura foi elevada para 150 °C
por 10 min. O revestimento de ZnS para o PQ foi realizado injetando a solução de
Zn estoque na solução do caroço CZIS, à 200 °C por 30 minutos. Os PQs CZIS
previamente estabilizados com DDT tiveram sua superfície modificada pelos
seguintes ligantes: MPA, TGA e GSH. Primeiramente, colocou-se em um béquer 5 mL
de metanol, 5 mL de clorofórmio e 1 mL do novo ligante MPA. Ajustou-se o pH para
≅12 e adicionou-se 1 mL do PQ. Em seguida, a mistura foi agitada, durante 30
minutos e acrescido de 10 mL de água ultrapura Tipo I (Milli-Q®), agitando-se
por mais 20 minutos. Posteriormente, a solução foi centrifugada com 5 mL de
acetona por 10 minutos em uma rotação de 7000 rpm e redisperso em tampão
fosfato. O mesmo procedimento foi realizado com os ligantes TGA e GSH.Os
nanocristais obtidos foram caracterizados por um conjunto de técnicas físicas
descritas a seguir: Espectroscopia UV/Vis, Espectroscopia de Fotoluminescência,
Difratometria de Raios X (DRX), Rendimento quântico de Fotoluminescência (Φf),
Espectroscopia, Infravermelho com Transformada de Fourier (IVTF), Tempo de Vida
do Estado Excitado.
Para avaliar a potencial utilização dos PQs como nanossondas, os mesmos ficarão
em contato com células e as imagens de fluorescência foram obtidas em um
microscópio de fluorescência invertido, utilizando o filtro de Rodamina. O
ensaio de Trypan Blue foi realizado colocando 4 x 104 células do epitélio do
ovário de hamster chinês (CHO) por poço em placas de 24 poços. Após 24 h, as
células foram expostas aos nanomateriais na concentração de 20 μg/mL; 80μg/mL e
150 μg/mL durante 24-h para a realização dos ensaios Trypan Blue e MTT. Após
esse período, o Trypan Blue à 0,4% foi adicionado e as células foram
contabilizadas. Para a realização do MTT, as células ficaram incubadas com meio
de cultivo contendo MTT à 10% (v/v), durante 4 h. Após esse tempo, foi realizado
a leitura no espectrofotômetro à 570 nm. A morfologia celular foi observada
utilizando um microscópio de luz invertido acoplado com câmera AxionCam Erc5
para visualizar e registrar as células expostas aos diferentes tratamentos.
Resultado e discussão
A síntese dos PQs CZIS foi facilmente obtida conforme a metodologia descrita
acima. A Figura 1a apresenta os espectros de fotoluminescência, no qual é
possível observar um deslocamento na emissão passando de 670 nm para 606 nm após
a formação da camada shell nos PQs. Uma das possíveis explicações para esse
comportamento é devido a troca catiônica. Nesse processo os íons Zn2+ substituem
os íons Cu+ e In3+ na superfície dos PQs e começam a contribuir para a banda de
condução e a desloca para maiores potenciais. Os espectros de absorção
exemplificados na Figura 1a demonstram que as bandas de absorção dos PQs estão
situadas na mesma região do espectro, sofrendo pequenas alterações. Para
conseguir obter esses valores de máximo de absorção com mais precisão, foi
calculado a segunda derivada da curva. Chegando aos valores de 527 nm para o
CZIS e 514 nm para o CZIS/ZnS. Estudos de Rendimento Quântico foram realizados a
fim de conhecer melhor a luminescência do material. O padrão utilizado nesse
estudo foi a Rodamina 6G que possui uma eficiência quântica próxima de, 92%.
Assim o rendimento quântico obtido foi de 12% para o CZIS e 54% após a formação
da camada de ZnS. Esse aumento significativo no Φf pode ser explicado pela
redução de defeitos superficiais do material em consequência do shell,
favorecendo uma melhor eficiência. Foi utilizada ainda a espectroscopia de
fluorescência resolvida no tempo, empregada para avaliar o tempo de decaimento
radiativo dos nanomateriais, obtendo 139 ns como tempo de vida médio para CZIS e
172 ns para o tempo de vida médio do CZIS/ZnS. A técnica de difração de Raios X
foi utilizada para obter informações sobre a estrutura dos PQs sintetizados.
Foram observados picos alargados em torno de 28º, 47º e 55º, relativos aos
planos (112), (204/220) e (116/312), apresentados pela JCPDS card 85-1575
referentes à fase tetragonal da calcopirita CuInS2. A partir do CZIS/ZnS, foi
realizado um processo de troca do ligante de superfície. Os ligantes escolhidos
para este trabalho são o ácido tioglicólico (TGA), o ácido mercaptopropiônico
(MPA) e a glutationa reduzida (GSH). As análises dos espectros de emissão e
absorção para os diferentes ligantes estão demonstradas nas Figuras 1b, sendo
possível observar um deslocamento no espectro, ocasionado devido às diferentes
constantes dielétricas e as interações entre o solvente e os ligantes de
superfície. Por meio dos dados apresentados na Tabela 2 (Figura 2) é possível
verificar que a melhor troca ocorreu utilizando o MPA como ligante de
superfície, apresentando um valor de 18%. Acredita-se que o GSH tem valores
inferiores
devido ao impedimento estérico, pois sua molécula contém grupos volumosos e
apresenta muitas extremidades polarizadas. Já o TGA, é estruturalmente similar
ao MPA, apresenta valores inferiores pois, como descrito na literatura, pode
reagir com a hidroxila, degradando o material e prejudicando a troca do ligante.
Após comparar os infravermelhos do ligante e do PQ-ligante apresentados na
Figura 1c-e, é possível verificar que a extremidade contendo enxofre sempre está
ligada ao PQ, pois a banda referente ao estiramento S-H não aparece no PQ-
ligante. Isso é possível de se explicar através da teoria de ácidos e bases
duros e moles de Pearson. Nessa teoria quando uma molécula ou íon é colocado
entre cargas opostas, a nuvem eletrônica desta espécie pode se polarizar, de
acordo com a sua maior ou menor polarizabilidade. Ralph Person definiu uma
espécie mais polarizável como mole e menos polarizável como dura (ácido ou
base). Dessa forma nesse sistema PQ-ligante, o grupo -SH é a base mole.
Após a troca do ligante os PQs foram utilizados como marcadores celulares. As
células de pescoço e cabeça ressuspensas com o PQ CZIS/ZnS – MPA em campo claro
estão apresentadas na Figura 2a. Utilizando o filtro de rodamina é possível
observar que o nanomaterial conseguiu interagir com as células, atravessando a
membrana plasmática e marcando-as. A figura 2b apresenta as células fibroblastos
ressuspensas com o PQ CZIS/ZnS – TGA, utilizando o filtro de rodamina é possível
visualizar que a marcação ocorreu de forma menos eficiente, possivelmente
relacionada a diminuição das propriedades de luminescência ocorridas durante a
troca do ligante. Os testes utilizando o GSH como ligante de superfície
indicaram que não ocorreu interação com as células, como pode ser observado nas
Figura 2c. Esse fato pode ter relação com as características do ligante em
contato com o meio biológico. A glutationa tem funções importantes no organismo,
como síntese de proteínas, metabolismo e proteção celular. Os PQs estabilizados
com GSH podem ter sido internalizadas e digeridos com maior facilidade pelas
células, perdendo suas propriedades luminescentes.
Com relação aos testes de citocompatibilidade in vitro, o ensaio MTT
representado na Figura 2d não revelou diferenças significativa entre os
tratamentos, exceto no grupo CZIS-GSH de 150 μg/mL, o qual apresentou valores de
absorbância menor que do grupo controle indicando uma redução na atividade
mitocondrial. No ensaio de Trypan Blue, apenas o CZIS-GSH de 20 e 80 μg/mL não
apresentou diferença quando comparado com o grupo controle. Os demais grupos
tiveram a porcentagem de células viáveis maiores que o grupo controle (98%). A
partir da morfometria das células observada na Figura 2f, observou-se redução da
área em todas as concentrações testada de CZIS-MPA e CZIS-TGA, além das
concentrações de 80 e 150 μg/mL de CZIS-GSH.
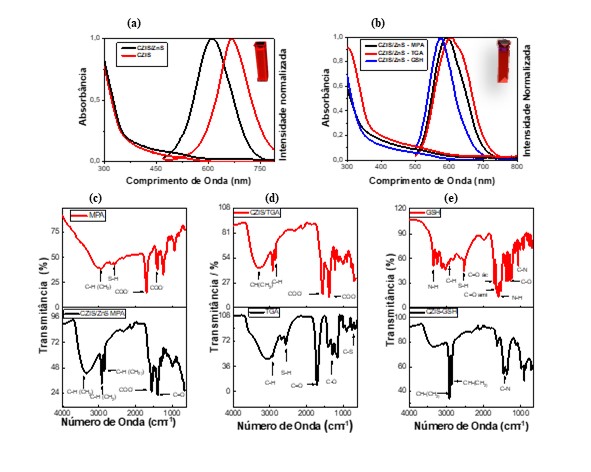
UV/Vis e PL CZIS e CZIS/ZnS(a) e CZIS/ZnS com os ligantes MPA, TGA e GSH(b) IV MPA e CZIS/ZnS- MPA(c)IV TGA e CZIS/ZnS-TGA(d)IV GSH e CZIS/ZnS- GSH(e)
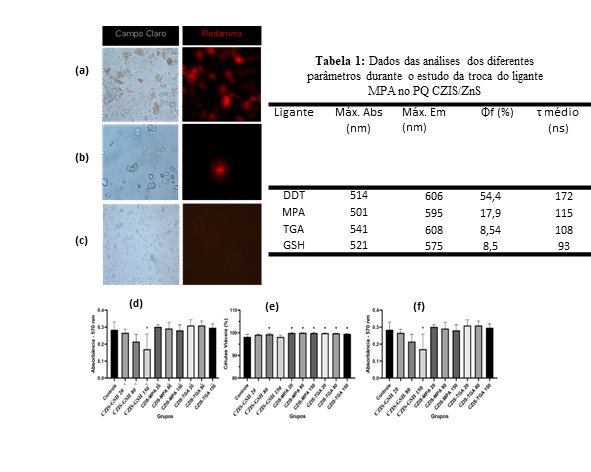
(a)Células com o CZIS/ZnS-MPA(b)Células com o CZIS/ZnS-TGA (c)Células com o CZIS/ZnS-GSH(d)Ensaio MTT(e)Ensaio Trypan Blue(f)Análise da área celular
Conclusões
Neste trabalho, PQs CZIS/ZnS quaternários foram sintetizados, obtendo um
rendimento quântico de 54% e tempo de vida de 172 ns após a formação da casca de
ZnS, fato esse explicado devido à diminuição de defeitos e armadilhas na
superfície do PQs. Após a troca do ligante, determinou-se que o PQ estabilizado
com o ligante MPA apresentou rendimento quântico de 17,9% e tempo de vida de 115
ns, sendo este considerado o melhor ligante comparando o conjunto estudado. Devido
ao apelo ambiental das últimas décadas por materiais com baixa toxidade, é de
grande interesse tecnológico PQs solúveis em água com excelentes propriedades
ópticas. No estudo de marcação biológica foi possível constatar que os ligantes de
superfície podem influenciar na interação dos PQs com as células, visto a melhor
interação destas com os PQs CZIS/ZnS – MPA, corroborando com os dados da
caracterização óptica. Os testes de citotoxicidade demonstraram que os
nanomateriais não induziram a morte das células, mostrando que o PQ CZIS/ZnS é um
promissor candidato para sonda fluorescente, sendo de extrema relevância o estudo
da interação de ligantes de superfície com as células, gerando nanodispositivos
capazes de escapar dos filtros biológicos e marcar células especificas, como
tumores.
Agradecimentos
Os autores agradecem ao CNPq, à CAPES e à FAPEMIG pelo apoio recebido
Referências
Jia, Y., Wang, H., Xiang, L., Liu, X., Wei, W., Ma, N., Sun, D. Tunable emission properties of core-shell ZnCuInS-ZnS quantum dots with enhanced fluorescence intensity. Journal of Materials Science & Technology, no 34, 942-948, 2018.
Lian, W., Tu, D., Hu, P., Song, X., Gong, Z., Chen, T., Song, J., Chen, Z., Chen, X. Broadband excitable NIR-II luminescent nano-bioprobes based on CuInSe2 quantum dots
for the detection of circulating tumor cells. Nanotoday, no 35, 100943, 2020.
Niu, Q., Yu, X., Yuan, Q., Hu, W., Yu, D., Zhang, Q. Quantum dots based near-infrared fluorescent probe for the detection of PepT1 expression in colorectal cancer. Chemical Physics Letters, no 739, 2020.
Park, H. J., Shin, D. J., Yu, J. Categorization of Quantum Dots, Clusters, Nanoclusters, and Nanodots. Journal of Chemical Education, no 98, 703–709, 2021.
Santos, C. I. L., Ferreira, J. C. A., Cunha, L. R. C., Vaz, R., Schiavon, M. A. Síntese e caracterização de pontos quânticos ambientalmente amigáveis, um meio simples de exemplificar e explorar aspectos da nanociência. Química Nova, no 43, 813–822, 2020.
Shim, H. S. S., Ko, M., Jeong, S., Shin, S. Y., Park, S. M., Do, Y. R., Song, J. K. Enhancement Mechanism of Quantum Yield in Alloyed-Core/Shell Structure of ZnS−CuInS2/ZnS Quantum Dots. The Journal of Physical Chemistry C, no 125, 9965-9972, 2021.
Vale, B. R. C., Vieira, K. O., Sousa, J. C. L., Ferrari, J. L. & Schiavon, M. A. Efeito da estrutura molecular de ligantes de superfície em pontos quânticos de CdTe dispersos em água. Quimica Nova no 38, 22–29, 2015
Xiang, W., Ma, X., Luo, l., Cai, W., Xie, C., Liang, X. Facile synthesis and characterization of core/shell Cu-In-Zn-S/ZnS nanocrystals with high luminescence. Materials Chemistry and Physics, no 149-150, 437-444, 2015.
Zheng, Y., Sadeghimakki, B., Brunning, J. A. L., Piano, E. M., Sivoththanman, S. Emission and Decay Lifetime Tunability in Less-Toxic Quaternary ZnCuInS Quantum Dots, no 20, 525-533, 2021.
















