Autores
Bitencourt, G.F. (UNIVERSIDADE FEDERAL DO ABC) ; Amorim, W.L.N. (UNIVERSIDADE FEDERAL DO ABC) ; Lima, H.H.L.B. (UNIVERSIDADE FEDERAL DO ABC) ; Andrade, L.S. (UNIVERSIDADE FEDERAL DO ABC) ; Carvalho, W.A. (UNIVERSIDADE FEDERAL DO ABC) ; Mandelli, D. (UNIVERSIDADE FEDERAL DO ABC)
Resumo
A química moderna vêm buscando diferentes abordagens para encontrar um processo
simples e eficaz para a conversão direta de metano em metanol, fato que é
dificultado devido à inércia da ligação C-H. Nesse contexto, este é o primeiro
trabalho que aplica as redes metalorgânicas Fe-MIL-88B e Fe-MIL88B-NH2 à
oxidação catalítica do CH4. Esses materiais tiveram suas rotas avaliadas e foram
sintetizados a partir de métodos solvotérmicos. As reações para Fe-MIL-88B e Fe-
MIL-88B-NH2 mostraram, respectivamente, uma produção de 5,73 e 5,19 mmol de
metanol/gcat. Apesar da produtividade menor, a Fe-MIL-88B-NH2 mostrou-se
totalmente seletiva para metanol. Entretanto, dificuldades acerca da
estabilidade dos materiais após a reação foram notadas e novas condições
reacionais estão sendo avaliadas
Palavras chaves
Metano; MOF; Catálise
Introdução
Com o crescente desenvolvimento populacional ao redor do mundo, as necessidades
de produção em diversos setores da economia estão se tornando cada vez maiores e
esta demanda acaba sendo satisfeita de maneira irresponsável por diversas
indústrias e empresas, prejudicando significativamente a saúde climática global
(HE, 2019). Diante disso, decisões mundiais para retardar o consumo dos recursos
naturais do nosso planeta e reduzir as emissões de gases do efeito estufa, como
o Acordo de Paris em 2015, atitudes para racionalização do consumo energia na
sociedade e estímulos para o aumento da produção energética mais sustentável na
indústria acabaram se transformando em prioridades para diversos órgãos
governamentais. A fim de mitigar os impactos ambientais causados pela exploração
exacerbada dos recursos, como ocorre na extração do petróleo, óleo diesel e
outros combustíveis fósseis, o aproveitamento do gás natural, que é uma fonte de
energia mais limpa dentre estas, passou a crescer gradativamente (GASSER;
LUDERER, 2018). Por exemplo, em 2020, o Brasil obteve uma produção de gás
natural aproximadamente 59,3% maior, em relação ao ano de 2010, atingindo a
marca de 23,9 bilhões de metros cúbicos. Além disso, de acordo com estimativas,
o país também possui reservas de cerca de 12,3 trilhões de metros cúbicos. Isso
confere ao Brasil o título de 3° maior produtor e de reservas de gás natural na
América Central e do Sul (LOONEY, 2021). Sabe-se que a composição química do
gás natural costuma variar de acordo com o local de extração, porém, seu
constituinte principal continua sendo o metano, além de possuir outros
componentes em menor quantidade, como dióxido de carbono, nitrogênio, sulfeto de
hidrogênio, água e também hidrocarbonetos alifáticos. Apesar de ser um processo
bastante automatizado, ainda existem problemas no aproveitamento do gás natural
que precisam de maior desenvolvimento tecnológico, como o caso da viabilização,
em escala real, da conversão direta do metano em produtos de maior valor
agregado (FARAMAWY; ZAKI; SAKR, 2016). Nas últimas décadas, a conversão
catalítica direta do metano em metanol tem recebido bastante atenção pela
academia e indústrias visto que o metanol é uma matéria-prima essencial para
diversos ramos de insumos químicos. Todavia, nenhum procedimento efetivo e
material apropriado com alta conversão, seletividade de produto e custo
acessível, em escala industrial, foi assegurado (RAVI; RANOCCHIARI; VAN
BOKHOVEN, 2017). Uma consequência prática relativa a falta de desenvolvimento
desses catalisadores e processos adequados para a catálise direta de metano em
metanol é a queima anual de 140 bilhões m³ de gás natural em poços de perfuração
de petróleo, o que equivale por 1% das emissões globais de CO2 sem ganhos de
energia associados e que poderiam ser utilizados para suprir a produção do
próprio metanol (LATIMER et al., 2018). Ao explorar o desenvolvimento de novo
catalisadores para oxidação direta do CH4, encontra-se ainda grandes desafios
para que um sistema economicamente e ambientalmente mais amigável seja de fato
criado. Esses obstáculos impõem dificuldades que envolvem a alta estabilidade do
metano (energia de dissociação de ligação C-H = 104 kcal/mol), a clivagem dessas
ligações normalmente necessitam de elevadas temperaturas e pressões, o que
dificulta a manutenção da atividade do catalisador e também pode reduzir a
seletividade e conversão, gerando empecilhos num sistema produtivo industrial
(OLIVOS-SUAREZ et al., 2016). Por exemplo, uma rota atualmente utilizada na
indústria para geração de metanol é um método indireto que consiste na reforma
do metano seguida da síntese de Fischer-Tropsch, que demanda diversos processos
de troca de calor, separação, alto gasto energético, além de um custo
considerável. Neste sentido de buscar novos catalisadores que possam ajudar a
resolver os desafios catalíticos da ativação do CH4, pode-se mencionar uma
classe de materiais chamados de redes metalorgânicas (MOF – Metal-organic
framework). A estrutura das MOFs é constituída por redes com unidades de
construção secundárias inorgânicas (íons metálicos/clusters) conectadas
diretamente a diversos tipos de ligantes orgânicos, realizando ligações de
coordenação. Em função dessa organização molecular, esses materiais possuem
características como elevada área superficial, cristalinidade e forte interação
metal-ligante orgânico, que são propriedades atrativas para a utilização dos
mesmos como catalisadores (BAEK et al., 2018; IKUNO et al., 2017; OSADCHII et
al., 2018). Portanto, este trabalho propõe a síntese de MOFs a base de ferro,
como a Fe-MIL88B e Fe-MIL88B-NH2, visando a conversão catalítica do metano.
Estes tipos de MOFs foram escolhidos preliminarmente devido sua similaridade
estrutural com complexos enzimáticos presentes em certas bactérias
(metanomonooxigenases) que possuem sítios ativos de ferro além de grupos
funcionais oxigenados/nitrogenados, que convertem seletivamente o metano a
metanol.
Material e métodos
Para a primeira batelada de Fe-MIL-88B, adicionou-se, em frascos do tipo Schott,
19,1 mmol de FeCl3 anidro e 12,3 mmol de ácido tereftálico contendo
dimetilformamida (DMF). As soluções foram homogeneizadas com auxílio de banho
ultrassom durante 10 minutos. Em seguida, gotejou-se uma solução de
polivinilpirrolidona 0,01M na solução de ligante orgânico sob agitação magnética
durante 5 minutos. Dessa mesma forma, a mistura foi introduzida a solução de
FeCl3. Esse sistema foi introduzido em um banho de óleo a 145 °C durante 1,5
horas sob agitação magnética. Após o resfriamento do sistema em temperatura
ambiente, a MOF resultante foi recuperada por centrifugação e posteriormente
lavada 3 vezes com etanol anidro. O produto final foi seco em estufa a 80 ºC por
24 h. Para a Fe-MIL-88B-NH2, o mesmo procedimento foi realizado porém utilizando
o ligante orgânico ácido 2-aminotereftálico. Na segunda batelada para a Fe-MIL-
88B, adicionou-se, em frascos do tipo Schott, 10,9 mmol de FeCl3.6H2O e 5,5 mmol
de ácido tereftálico contendo DMF. As soluções foram homogeneizadas com auxílio
de banho ultrassom durante 20 minutos. Em seguida, misturou-se os reagentes
mantendo uma agitação magnética durante 15 minutos. O sistema foi transferido
para uma autoclave de aço inox com revestimento interno de teflon. A síntese
ocorreu em estufa a 170 °C durante 24 h sem agitação magnética. Após esse tempo,
o sistema ficou em repouso a temperatura ambiente por 3 h. A MOF resultante foi
recuperada por centrifugação e posteriormente lavada 3 vezes com DMF e etanol
anidro. O produto final foi seco em estufa a 80 ºC por 24 h. Para a Fe-MIL-88B-
NH2, o mesmo procedimento foi realizado porém alterando o ligante orgânico pelo
ácido 2-aminotereftálico. Enquanto isso, para a terceira batelada, todo o
procedimento anterior foi repetido porém alterando a temperatura de síntese e
presença de agitação. Dessa forma, a síntese ocorreu em banho de óleo a 130 °C
durante 24 h com agitação magnética. A reação de oxidação do metano foi
realizada em um reator de batelada. Nesta autoclave foram inseridos diferentes
quantidades de MOF juntamente com 2 mL de acetonitrila (MeCN) e 5,22 mmol de
H2O2. A autoclave foi fechada e o gás metano inserido até atingir a pressão de
34,5 bar. A solução contida na autoclave foi mantida sob agitação a 60 ºC por
períodos de até 120 min. Ao final desse período, uma alíquota de 100 µL da
reação foi diluída em um vial contendo MeCN e nitrometano, adicionando
posteriormente trifenilfosfina. Em seguida, analisou-se a aliquota por
cromatografia gasosa acoplada ao espectrômetro de massas (CG-EM). Além disso, a
concentração de H2O2 remanescente no sistema reacional foi quantificada por
iodometria. As caracterizações realizadas foram difração de raio-X,
espectroscopia de infravermelho com transformada de Fourier, microscopia
eletrônica de varredura acoplada ao detector de energia dispersiva de raios-X,
análise textural por adsorção de N2 e análise termogravimétrica.
Resultado e discussão
Síntese e caracterizações das MOF Fe-MIL-88B e Fe-MIL-88B-NH2 - A partir
das micrografias (Figura 1A), analisou-se comparativamente o aspecto de cada
catalisador e se era o que a literatura previa para cada material, notando as
diferenças e semelhanças morfológicas entre as MOFs obtidas por rotas de síntese
distintas. Nota-se que a 1ª metodologia de síntese, que utiliza PVP, formou os
cristais mais próximos e homogêneos em relação a literatura (CAI; LIN; PANG,
2016). No entanto, o mesmo não se aplica para a 1ª Fe-MIL-88B-NH2, a qual não
possível observar uma estrutura bem definida. Ainda acerca das Fe-MIL88B-NH2, a
MOF que apresentou morfologia e características mais próximas da literatura foi
a da 3ª metodologia, a qual expõe cristais com formato similares a finos
bastonetes (WEI et al., 2019). Quanto a 3ª Fe-MIL-88B, é possível observar
cristais similares aos obtidos na 1ª síntese porém com diferentes pontos de
nucleação, como se os cristais estivessem crescendo agregados uns aos outros.
Quanto a 2ª metodologia de síntese, não foi obtido resultados de micrografia que
mostrassem uma boa reprodutibilidade com o artigo base (SUN et al., 2021). Para
a análise semiquantitativa obtida por MEV-EDS, obteve-se MOFs com teor de ferro,
em %mol, de 5,3, 4,9 e 2,6 para as Fe-MIL-88B (1ª, 2ª e 3ª) e de 4,4, 3,0 e 2,5
para as Fe-MIL-88B-NH2 (1ª, 2ª e 3ª), que servirão posteriormente como sítio
ativo para as reações de catálise. Quanto aos elementos C, O, N, não foi
observado uma mudança tão drástica nos teores, o que indica que a mudança de
metodologia resultou em materiais com a mesma estrutura química. Os
difratogramas apresentados na figura 1B demonstram que todas as MOFs são
cristalinas. Contudo, os diferentes métodos de sintese produzem mudanças de
intensidade de picos e alguns desvios de angulação. Com a alteração do ligante
ácido tereftálico pelo ligante 2-aminotereftálico também é notada uma alteração
no padrão de difração entre Fe-MIL88B e Fe-MIL88B-NH2. Essas mudanças podem
estar associadas justamente ao tamanho da molécula, que gera uma estrutura
cristalina com faces de tamanhos diferentes. Quando comparado com a literatura,
todos os difratogramas mostraram um padrão similar ao de outras Fe-MIL-88B e Fe-
MIL-88B-NH2, indicando exatidão no processo de obtenção de um material
cristalino pelas metodologias utilizadas. Na análise de FT-IR não foi observada
mudanças significativas nos grupamentos funcionais superficiais dos
catalisadores ao realizar alteração nas metodologias de síntese tanto para as
Fe-MIL-88B como para as Fe-MIL-88B-NH2. Em termos comparativos, as MOFs se
diferem quanto a presença de um estiramento forte relativo a ligação C-N, que
pode ser notado em todas as Fe-MIL-88B-NH2 em 1219 cm-1, além de dois
estiramentos fracos em 3520 e 3385 cm-1 relativos a ligação N-H. Os estiramentos
da ligação O-H (3100 e 3068 cm-1) são apenas vistos nos ligantes orgânicos,
indicando a desidrogenação da hidroxila quando na forma de MOF.A partir das
análises termogravimétricas, observou-se que todas as MOFs sintetizadas são
estáveis nas temperaturas que serão aplicadas para catálise (abaixo de 100 ºC).
A pequena perda de massa (2-7 %) na faixa 30-160 ºC está relativa a umidade e
volatilização de moléculas de solvente no interior da MOF. Além disso, todas os
materiais também apresentaram uma grande degradação térmica antes de 425 ºC,
indicando o colapso da estrutura cristalina pela quebra dos ligantes orgânicos.
Dessa forma, a partir de 425 ºC, a massa remanescente (24-38%) é característica
do centro metálico de ferro e/ou suas formas oxidadas. Na caracterização de
análise textural, as Fe-MIL-88B apresentaram valores de 4 a 39 m²/g de área
superficial enquanto as Fe-MIL-88B-NH2 variaram de 15 a 17 m²/g. Em relação ao
volume de poros e diâmetro médio dos poros os valores foram compreendem de
0,011-0,037 cm³/g e 30-32 A° para todas os materiais. Apesar das MOFs
normalmente serem reportadas com elevada área superficial, no caso das MIL-88B
isso se torna um pouco diferente. De acordo com simulações, a estrutura 3D da
estrutura MIL-88B em sua expansão máxima deve exibir uma elevada área
superficial de 3040 m²/g (DHAKSHINAMOORTHY; ASIRI; GARCIA, 2016). No entanto,
devido ao alto caráter de flexão de sua estrutura e sua baixa afinidade para a
adsorção do gás N2, uma baixa área superficial é obtida (RAHMANI; RAHMANI, 2017;
ZORAINY et al., 2022). Aplicação das MOFs Fe-MIL-88B e Fe-MIL-
88B-NH2 na oxidação do metano - Todos os catalisadores sintetizados foram
avaliados quanto ao seu perfil cinético da reação oxidativa do metano para
obtenção de metanol (Figura 2A). Em relação as Fe-MIL-88B, todas tiveram um
comportamento similar de apresentar um pico de produtividade (1ª – 11462
μmol/gcat em 30 min; 2ª - 4892 μmol/gcat em 30 min; e 3ª – 5727 μmol/gcat em 15
min) e depois uma redução da quantidade de metanol produzida ao decorrer da
reação, fato que pode estar associado com a sobreoxidação do metanol. Apesar da
3ª Fe-MIL-88B não mostrar a maior produtividade, ela obteve a maior seletividade
(100%) em 15 min de reação, definindo assim o tempo e MOF ideal. Ao analisar as
Fe-MIL-88B-NH2, percebeu-se o mesmo tipo de comportamento de produtividade (1ª –
4670 μmol/gcat em 60 min; 2ª - 5719 μmol/gcat em 15 min; e 3ª – 5193 μmol/gcat
em 30 min) porém todas elas se mostraram 100% seletivas para a produção de
metanol. Em 30 min, a 3ª Fe-MIL-88B-NH2 mostrou a melhor produtividade de
metanol e, diante disso, optou-se por seguir os estudos comparativos com a 3ª
metodologia de síntese das MOFs de ferro. Diante da escolha da 3ª MOF, realizou-
se um estudo de quantidade de massa do catalisador Fe-MIL-88B na cinética da
reação (Figura 2B). Observou-se que na reação com maior massa de catalisador (10
mg) havia um aumento drastico na quantidade de produtos oxigenados indesejados
com o passar do tempo, gerando ácido fórmico (11333 a 20437 μmol gcat-1) e ácido
acético (1360 a 1624 μmol gcat-1) ao passo que diminuia a quantidade de metanol
formado (947 a 3059 μmol gcat-1). Enquanto isso, a reação numa menor quantidade
de catalisador (3 mg) fornecia uma seletividade de 100% para metanol e com maior
produtividade (1967 a 5727 μmol gcat-1). Apesar disso, por questões logísticas
de reciclo e acúmulo de catalisador para novos testes optou-se por manter a
massa ideal da reação em 10 mg. Além disso, foi realizada uma titulação da
quantidade remanescente de H2O2 no meio reacional, ajudando a descobrir o
percurso de consumo do substrato e formação de produtos (Figura 2C). Dessa
forma, pode-se ver que o consumo de H2O2 está associado diretamente com a
formação de produtos porém não na mesma intensidade. Isto indica que pode estar
ocorrendo a geração de produtos gasosos como CO2 e H2O, que não são
quantificados por CG-EM. Estudo de estabilidade das MOFs no meio
reacional - Apesar das MOFs terem apresentado um resultado promissor em
relação a produção de metanol, as questões de estabilidade do catalisador ainda
mostram-se ineficientes frente ao atual sistema reacional, uma vez que que a Fe-
MIL-88B e a Fe-MIL88B-NH2 acabam degradando durante a reação. Isso pode ser
notado tanto pela mudança de cor do material (cor original para um laranja mais
opaco) como também pelas análises de DRX e FT-IR. No DRX se observa a perda de
estrutura cristalina e no espectro de FT-IR uma grande mudança do da superfície
do catalisador, indicando que a estrutura foi desfeita ao ponto que os grupos
funcionais dos ligantes orgânicos acabaram tendo maior destaque. Além disso, as
MOFs também não apresentaram atividade catalítica após o 1º ciclo de uso.
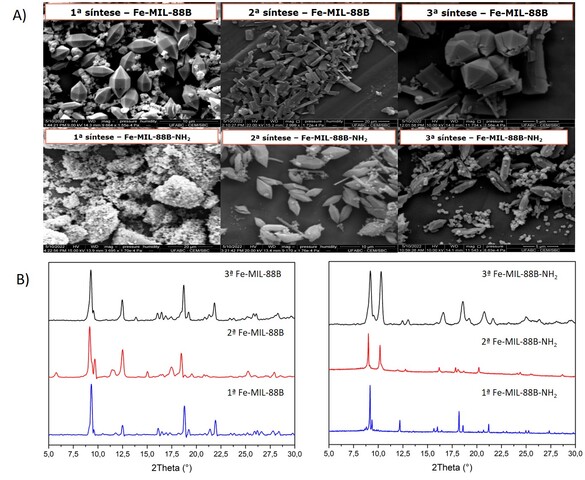
A) Micrografias eletrônicas e B) Difratogramas dos catalisadores sintetizados.
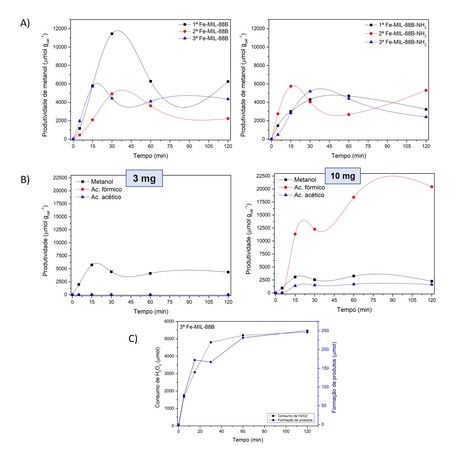
A) Gráficos de cinética da reação de oxidação do metano; B) Variação da massa de catalisador para a reação; C) Resultado da titulação iodométrica.
Conclusões
A partir do exposto, tem-se que as MOFs Fe-MIL88B e Fe-MIL-88B-NH2 sintetizadas
por três rotas diferentes possuem propriedades catalíticas promissoras para a
produção de metanol a partir da oxidação do metano. Em específico, a 3ª
metodologia de síntese mostrou ser a mais apropriada de acordo com as
caracterizações realizadas e, sendo assim, escolhida para avançar nos testes
catalíticos. A produtividade de metanol da 3ª Fe-MIL88B (5727 μmol/gcat em 15 min)
e Fe-MIL-88B-NH2 (5193 μmol/gcat em 30 min) mostraram ser muito superiores quando
comparadas com outras MOFs abordadas na literatura, que produzem desde 10 até 250
μmol/gcat em condições reacionais variadas. Apesar disso, desafios acerca da
estabilidade dos materiais após reação e os possíveis mecanismos de funcionamento
ainda estão sendo investigados com o decorrer do projeto.
Agradecimentos
Os autores gostariam de agradecer à UFABC pelo espaço de pesquisa, às instituições
de fomento FAPESP (Proc. 2021/10885-6), CNPq, CAPES, PRH/ANP nº 49 e ao LAMEP-UFU
(FINEP - 01.13.0371.00) pelas análises termogravimétricas.
Referências
BAEK, J.; RUNGTAWEEVORANIT, B.; PEI, X.; PARK, M.; FAKRA, S. C.; LIU, Y. S.; MATHEU, R.; ALSHMIMRI, S. A.; ALSHEHRI, S.; TRICKETT, C. A.; SOMORJAI, G. A.; YAGHI, O. M. Bioinspired Metal-Organic Framework Catalysts for Selective Methane Oxidation to Methanol. Journal of the American Chemical Society, v. 140, n. 51, p. 18208–18216, 2018. CAI, X.; LIN, J.; PANG, M. Facile Synthesis of Highly Uniform Fe-MIL-88B Particles. Crystal Growth and Design, v. 16, n. 7, p. 3565–3568, 2016. DHAKSHINAMOORTHY, A.; ASIRI, A. M.; GARCIA, H. Metal-Organic Frameworks as Catalysts for Oxidation Reactions. Chemistry - A European Journal, v. 22, n. 24, p. 8012–8024, 2016. FARAMAWY, S.; ZAKI, T.; SAKR, A. A. E. Natural gas origin, composition, and processing: A review. Journal of Natural Gas Science and Engineering, v. 34, p. 34–54, 2016. GASSER, T.; LUDERER, G. Special Report on Global Warming of 1.5°C. Chapter 2: Mitigation Pathways Compatible with 1.5°C in the Context of Sustainable Development. p. 82, 2018. Disponível em: <https://www.ipcc.ch/site/assets/uploads/sites/2/2019/02/SR15_Chapter2_Low_Res.pdf>. HE, Y. How population growth impacts energy consumption in Guangdong in China. Behavioural Sciences ︱, p. 1–2, 2019. Disponível em: <https://researchfeatures.com/population-growth-energy-consumption-guangdong-china/>. IKUNO, T.; ZHENG, J.; VJUNOV, A.; SANCHEZ-SANCHEZ, M.; ORTUÑO, M. A.; PAHLS, D. R.; FULTON, J. L.; CAMAIONI, D. M.; LI, Z.; RAY, D.; MEHDI, B. L.; BROWNING, N. D.; FARHA, O. K.; HUPP, J. T.; CRAMER, C. J.; GAGLIARDI, L.; LERCHER, J. A. Methane Oxidation to Methanol Catalyzed by Cu-Oxo Clusters Stabilized in NU-1000 Metal-Organic Framework. Journal of the American Chemical Society, v. 139, n. 30, p. 10294–10301, 2017. LATIMER, A. A.; KAKEKHANI, A.; KULKARNI, A. R.; NØRSKOV, J. K. Direct Methane to Methanol: The Selectivity-Conversion Limit and Design Strategies. ACS Catalysis, v. 8, n. 8, p. 6894–6907, 2018. LOONEY, B. Statistical Review of World Energy globally consistent data on world energy markets and authoritative publications in the field of energy. Review World Energy data, v. 70, p. 8–20, 2021. OLIVOS-SUAREZ, A. I.; SZÉCSÉNYI, À.; HENSEN, E. J. M.; RUIZ-MARTINEZ, J.; PIDKO, E. A.; GASCON, J. Strategies for the Direct Catalytic Valorization of Methane Using Heterogeneous Catalysis: Challenges and Opportunities. ACS Catalysis, v. 6, n. 5, p. 2965–2981, 2016. OSADCHII, D. Y.; OLIVOS-SUAREZ, A. I.; SZÉCSÉNYI, Á.; LI, G.; NASALEVICH, M. A.; DUGULAN, I. A.; CRESPO, P. S.; HENSEN, E. J. M.; VEBER, S. L.; FEDIN, M. V.; SANKAR, G.; PIDKO, E. A.; GASCON, J. Isolated fe sites in metal organic frameworks catalyze the direct conversion of methane to methanol. ACS Catalysis, v. 8, n. 6, p. 5542–5548, 2018. RAHMANI, E.; RAHMANI, M. Alkylation of benzene over Fe-based metal organic frameworks (MOFs) at low temperature condition. Microporous and Mesoporous Materials, v. 249, p. 118–127, 2017. RAVI, M.; RANOCCHIARI, M.; VAN BOKHOVEN, J. A. The Direct Catalytic Oxidation of Methane to Methanol—A Critical Assessment. Angewandte Chemie - International Edition, v. 56, n. 52, p. 16464–16483, 2017. SUN, Y.; LIN, T.; ZENG, C.; JIANG, G.; ZHANG, X.; YE, F.; ZHAO, S. A self-correcting fluorescent assay of tyrosinase based on Fe-MIL-88B-NH2 nanozyme. Microchimica Acta, v. 188, n. 5, 2021. WEI, Y. S.; ZHANG, M.; KITTA, M.; LIU, Z.; HORIKE, S.; XU, Q. A Single-Crystal Open-Capsule Metal-Organic Framework. Journal of the American Chemical Society, v. 141, n. 19, p. 7906–7916, 2019. ZORAINY, M. Y.; KALIAGUINE, S.; GOBARA, M.; ELBASUNEY, S.; BOFFITO, D. C. Microwave-Assisted Synthesis of the Flexible Iron-based MIL-88B Metal–Organic Framework for Advanced Energetic Systems. Journal of Inorganic and Organometallic Polymers and Materials, 2022.
















