Autores
Garcia, M. (CONACYT-UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN, FCQ) ; Herrera, A. (UNIVERSIDAD AUTÓNOMA DEL ESTADO DE QUINTANA ROO) ; Estupiñan, R. (UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN) ; González, V. (UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN) ; Cáceres, D. (UNIVERSIDAD AUTÓNOMA DE YUCATÁN) ; Bojorquéz, E. (, EL COLEGIO DE MICHOACÁN) ; Jiménez, R. (CENTRO DE INVESTIGACIÓN EN QUÍMICA APLICADA) ; Chan, R. (UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN)
Resumo
Dos nuevos ésteres orgánicos de boro nitro-sustituidos derivados del damnacantal
fueron sintetizados mediante una reacción de condensación vía multicomponentes con
rendimientos cuantitativos en sólo 20 minutos. Las moléculas resultantes se
caracterizaron mediante RMN, análisis vibracional, espectroscopia de absorción,
fluorescencia molecular y masas de alta resolución. El desplazamiento químico de
la señal de 11B de los compuestos 4a y 4b evidenció la formación el enlace de
coordinación N-B y el análisis de masas corroboró la presencia del átomo de boro
en las estructuras propuestas. El compuesto 4b demostró ser 1.5 veces más potente
contra las celulas MDA-MB-231 (IC50 =13 µM) comparado con el damnacantal 1 (IC50
=23 µM) con un bajo índice de selectividad (1.075)
Palavras chaves
Boro; Damnacantal; citotoxicidad
Introdução
El damnacantal, un derivado de antraquinona, presente en las raíces de diversas
especies pertenecientes al género Morinda es un metabolito secundario inhibidor
y selectivo de la tirosina quinasa p56Ick con una CI50=17 nm (FALTYNEK et al.
p.12404, 1995). Además, esta antraquinona ha mostrado actividad específica
contra tumores malignos de células T y enfermedades autoinmunes. No obstante,
estos importantes hallazgos de actividad antitumoral, la resistencia de las
células cancerosas hacia los fármacos evidencia la necesidad de desarrollar
agentes anticancerígenos alternativos a los fármacos basados en platino.
Recientemente, los materiales conteniendo átomos de boro se han estudiado
ampliamente en varios campos de la medicina (BOLT et al. p.2719, 2017), incluida
la terapia antimicrobiana (FINK et al. p.213684, 2021) y el diagnóstico y la
terapia del cáncer (TURKEZ et al. p105137, 2021). Asimismo, han sido reportados
derivados de boro con elevada actividad terapéutica para el tratamiento de
onicomicosis (GUPTA et al. p.1145, 2016), mieloma múltiple (RICHARDSON et al.
p.1949, 2018), dermatitis atópica (JARNAGIN et al. p.390, 2016) e infecciones
bacterianas (BURGOS et al. p.1007, 2018). Considerando lo anterior, en este
trabajo describimos el uso de una reacción por multicomponente para la síntesis
de dos nuevos ésteres de organoboro nitro-sustituidos fluorescentes basados en
damnacantal aislado de las raíces de Morinda Panamensis Seem. Ambos compuestos
fueron caracterizados por RMN (1H, 13C y 11B), análisis de absorción
vibracional, espectroscopia de fluorescencia, absorción de UV/Vis, y
espectrometría de masas de alta resolución. Además, estudiamos la viabilidad
celular, así como el índice de selectividad contra las celulas MDA-MB-231.
Material e métodos
Todos los reactivos fueron adquiridos de la casa comercial Aldrich. Los
solventes fueron utilizados sin purificación. Los puntos de fusión fueron
determinados en un equipo Electrothermal MelTemp. Los espectros de infrarrojo se
midieron en un equipo Bruker Tensor 27 FT-IR equipado con un accesorio Pike
Miracle™ ATR. Los espectros de masas de alta resolución se adquirieron en un
sistema LC/MSD TOF- DART–HRMS de Agilent Technologies con ionización en modo
APCI. Los espectros de RMN (1H, 13C y 11B) fueron determinados en cloroformo y
metanol deuterado en un equipo Bruker advance DPX 400 utilizando como referencia
interna (CH3)4Si para 1H y 13C y BF3⋅OEt2 para 11B. Los espectros de absorción
fueron medidos en un equipo Varian Cary 100. Los espectros de excitación y
emisión fueron adquiridos en un espectroflorímetro Perkin-Elmer LS 50B. Los
rendimentos cuánticos fluorescentes en solución (φ) fueron determinados
excitando por debajo del máximo de absorción de acuerdo con un procedimiento
análogo reportado en la literatura (WILLIAM et al. p.1067, 1983) y usando
sulfato de quinina como referencia interna en ácido sulfúrico 0.1 M (φ=0.54 a
310 nm).
Resultado e discussão
Para obtener los ésteres de boro nitro-sustituidos, dos pasos fueron efectuados,
en el primero, la antraquinona 1 fue extraída y aislada de las raíces de Morinda
Panamensis Seem seguido de la reacción de condensación vía multicomponente de 1,
ácido antranílico 2, y ácido 3-nitro fenil borónico o ácido 4-nitro fenil
borónico para obtener las moléculas 4a and 4b (Esquema 1). La formación del
enlace de coordinación NB para 4a y 4b fue evidenciado en primera instancia
mediante RMN de 11B. El espectro de 11B de 4a y 4b muestran señal de 4.65 a 4.84
ppm ppm, indicative de la presencia de un átomo de boro tetracoordinado (LARA-
CERÓN et al. p. 31748, 2020). Los espectro de emisión de ambos compuestos son
imágenes al espejo de la parte visible del espectro de absorción, mostrando un
máximo alrededor de 400 nm en ambos análogos. Los espectros de excitación para
los dos compuestos son idénticos a los espectros de absorción, siendo la
principal diferencia los coeficientes de extinción molar. El 4-nitro sustituido
muestra un valor ligeramente superior comparado con el análogo sustituido en
posición 3, lo cual sugiere que la fuerza del oscilador de la transición
electronica podría ser afectado por la posición del grupo nitro sobre el anillo
de fenilborónico. En estudios de actividad biológica, la molécula 4b y el
damnacantal 1 revelaron un valor de IC50 de 133.3 y 234.5 M,
respectivamente. El éster nitro-sustituido 4b demostró ser 1.5 veces más potente
contra MDA-MB-231 (CI50 =13 M) comparado con el damnacantal 1 (CI50 =23 nM).
Estos resultados sugieren que la formación de los nuevos heterociclos de seis
miembros y la adición de grupos aceptores de electrones en la posición para de
el anillo de fenileno resulta crucial para el reconocimiento molecular del
compuesto (Figura 1).
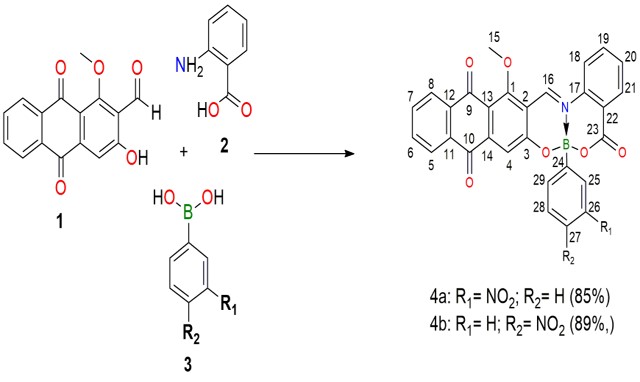
Ruta de síntesis propuesta para la preparación de los ésteres de organoboro 4a y 4b.
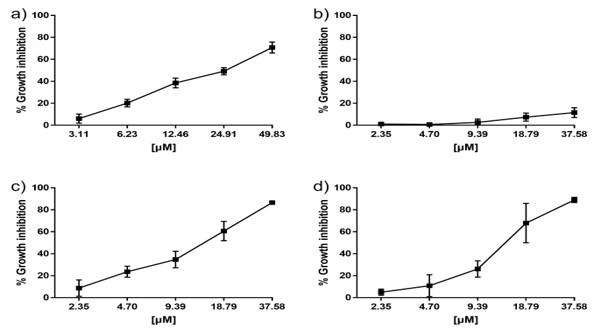
Efecto de inhibición en el crecimiento de damnacantal 1 y los esteres de organoboro 4a y 4b contra las líneas celulares MDA-MB-231 y HEK-293.
Conclusões
En resumen, dos nuevos ésteres de organoboro fluorescentes derivados del
damancantal 1, como bloque de construcción biogénico fueron diseñados y
sintetizados por una reacción por multicomponente Los experimentos de RMN tales
como: NMR 1H,13C,11B, confirmaron la formación de cuatro nuevos enlaces y dos
nuevos heterocíclos de seis miembros conteniendo átomos de nitrogeno, oxígeno, y
átomos de boro.El compuesto 4b mostró el efecto más grande de inhibición en las
celulas (13 M); demostrando que las modificacion structural de esta clase de
moleculas puede mejorar la actividad antitumoral.
Agradecimentos
Los autores agradecen al PAICYT-UANL (600-CE-2022; 267-CE-2022) por el
financiamiento otorgado. Los autores también agradecen al QFB L.R.A del
Laboratorio de Análisis y Diagnóstico del Patrimonio, El Colegio de Michoacán.
Referências
BOLT, H.M.; DUYDU, Y.; BAŞARAN, N.; GOLKA, K. Boron and its compounds: current biological research activities, Arch. Toxicol., 91, 2719-2722. (2017).
BURGOS, R.M.; BIAGI, M.J.;RODVOLD, K.A.; DANZIGER, L.H. Pharmacokinetic/Pharmacodynamic Adequacy of Novel β-Lactam/β-Lactamase Inhibitors against Gram-Negative Bacterial in Critically Ill Patients, Expert Opin. Drug. Metab. Toxicol., 14, 1007-1021. (2018).
FALTYNEK, C.R.; SCHROEDER, J.; MAUVAIS, P.; MILLER, D.; WANG, S.; MURPHY, D.; MAYCOCK, A. Damnacanthal is a highly potent, selective inhibitor of p56lck tyrosine kinase activity. Biochemistry, 34, 12404-12410. (1995).
FINK, K.; UCHMAN, M. Boron cluster compounds as new chemical leads for antimicrobial therapy.
Coord. Chem. Rev. 431, 213684. (2021).
GUPTA, A.K.;VERSTEEG, S.G. Tavaborole – a treatment for onychomycosis of the toenails. Expert. Rev. Clin. Pharmacol., 9, 1145-1152. (2016).
JARNAGIN, K.; CHANDA, S.; CORONADO, D.; CIARAVINO, V.; ZANE, L.T.; GUTTMAN-YASSKY, E.; LEBWOHL, M.G. Crisaborole Topical Ointment, 2%: A Nonsteroidal, Topical, Anti-Inflammatory Phosphodiesterase 4 Inhibitor in Clinical Development for the Treatment of Atopic Dermatitis, J. Drugs. Dermatol., 15, 390-396. (2016).
LARA-CERÓN, J.A.; PÉREZ, V.M.J.; XOCHICALE-SANTANA,L.; OCHOA, M.E.; CHÁVEZ-REYES, A.; MUÑOZ-FLORES, B.M. Boron Schiff bases derived from α-amino acids as nucleoli/cytoplasm cell-staining fluorescent probes: In vitro, RSC. Adv., 53, 31748-31757. (2020).
RICHARDSON, P.G.; ZWEEGMAN,S.; O’DONNELL, E.K.; LAUBACH, J.P.; RAJE, N.; VOORHEES, P. Ixazomib for the treatment of multiple mieloma, Expert. Opin. Pharmacother., 19, 1949-1968. (2018).
TURKEZ, H. M.E. ARSLAN, A. TATAR, A. MARDINOGLU, A. Promising potential of boron compounds against Glioblastoma: In Vitro antioxidant, anti-inflammatory and anticancer studies, Neurochem. Int., 149, 105137. (2021).
WANG, S.; ZHANG, Z.; MIAO, L.; LI, Y. Boron Neutron Capture Therapy: Current Status and Challenges, Front. Oncol., 12, 788770. (2022).
WILLIAM, A.T.R.; WINFIELD,S.A.; MILLER, J.N. Relative fluorescence quantum yields using a computer-controlled luminescence spectrometer, Analyst., 108, 1067-1071. (1983).
















