Autores
Rodrigues, E.M. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Martins, L.F. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Franco, J.V.L. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Alves, O.C. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Silva, J.C.M. (UNIVERSIDADE FEDERAL FLUMINENSE)
Resumo
Nanopartículas de NiCu/C e NiCo/C (razões atômicas 75:25, 50:50 e 25:75) foram
sintetizadas e aplicadas como catalisadores na reação de eletro-oxidação da
ureia (REU) em meio básico. As nanopartículas foram sintetizadas via redução por
borohidreto de sódio e suportadas em carbono Vulcan®. As análises de difração de
raios X indicaram a presença de Ni0, Ni(OH)2, Cu0 e fases oxidadas de Cu e Co.
As curvas de magnetização mostram que a adição de Co e Cu alterou as
propriedades magnéticas e eletrônicas do Ni. O Ni25Cu75/C apresentou a melhor
atividade e estabilidade catalítica para REU. A melhora na atividade e
estabilidade eletrocatalítica pode ser devido a uma mudança na configuração
eletrônica do Ni, que pode diminuir a energia de adsorção de espécies causadoras
de envenenamento do material.
Palavras chaves
Nanopartículas; Eletrocatálise; Ureia
Introdução
A poluição de meios aquáticos tem se tornado um assunto de grande debate nas
últimas duas décadas devido ao aumento na população mundial e na demanda por
alimentos (QUADRA et al, p. 2, 2019). A ureia é um dos principais componentes da
urina humana, aproximadamente 2 a 2,5% em peso, e, portanto, apresenta
concentrações consideráveis em efluentes municipais (KAKATI et al, p. 1, 2017).
Outras fontes que apresentam altos teores de ureia são águas residuais do
processo de síntese da mesma para utilização na produção de fertilizantes, e
corpos d’agua presentes em regiões de intensa atividade agrícola (GOPI et al, p.
2, 2021). Enquanto em meio aquoso a ureia pode ser degradada naturalmente a
amônia, que por sua vez pode ser oxidada a nitrato e nitrito (KAKATI et al, p.
2, 2017), íons que podem causar diversos problemas de saúde quando ingeridos em
concentrações acima das recomendadas pela Organização Mundial da Saúde (JOHNSON
et al, p. 2, 2019). A lixiviação de ureia, até corpos hídricos como lagos e rios
leva a vários problemas, pois a sua conversão em nitrato além de causar os
problemas já citados é também um indicador da eutrofização, um processo de
proliferação descontrolada de algas e cianobactérias que diminui a concentração
de oxigênio presente na água, levando a hipóxia e morte de peixes (SATAYEVA et
al, p. 2, 2018). Desta forma fica evidente que altas concentrações de ureia em
corpos d’agua podem causar problemas ao meio ambiente e à saúde humana, nesse
sentido, buscar formas de degradá-la é algo de extrema relevância. A ureia pode
ser degradada por inúmeros métodos como hidrólise, decomposição enzimática e
tratamento biológico, porém estes métodos apresentam dificuldades pois
necessitam de altas temperaturas/pressões, meios reacionais extremamente rígidos
e equipamentos sofisticados (URBANCZYK et al, p. 6, 2016). Uma alternativa a
estes métodos é a oxidação eletroquímica, um método simples, de fácil execução,
e que produz apenas produtos gasosos não prejudiciais ao ambiente (N2 e H2), ou
prejudiciais (CO2) que podem ser captados e utilizados posteriormente em outros
processos (URBANCZYK et al, p. 6, 2016). As reações de envolvidas no processo de
eletro-oxidação da ureia podem ser vistas nas Equações 1 (reação anódica), 2
(reação catódica) e 3 (reação global) (ZHU et al, p. 3, 2020):
CO(NH2)2(aq) + 6OH-(aq) → N2(g) + CO2(g) + 5H2O(l) + 6e- E0 =+0,46 V (1)
6H2O(l) + 6e- → 3H2(g) + 6OH-(aq) E0=-0,83 V (2)
CO(NH2)2(aq) + H2O(l) → N2(g) + CO2(g) + 3H2(g) E0=-0,37 V (3)
A utilização do método de eletrolise da ureia apresenta então, além de um apelo
ecológico, também um viés energético, porque seria uma alternativa tanto para o
tratamento de efluentes urbanos e corpos hídricos contaminados, quanto para
produção de hidrogênio, que posteriormente poderia ser utilizado como
combustível (URBANCZYK et al, p. 6, 2016). Para o processo de eletro-oxidação da
ureia em meio básico, há a necessidade do uso de catalisadores para diminuição
da barreira energética limitadora da reação, acelerando a velocidade da reação
(ZHU et al, p. 2, 2020). Catalisadores baseados em metais nobres são utilizados
no processo de REU, como Pt e Ir, seus óxidos e ligas metálicas entre os mesmos
(KAKATI et al, p. 2, 2017). Porém metais nobres apresentam alto valor agregado
encarecendo o processo, uma alternativa que apresentou ótima atividade para
eletro-oxidação da ureia em meio básico é o níquel, metal de transição não
nobre, que possibilita obtenção de maiores densidades de corrente do processo de
eletro-oxidação de ureia em menores potenciais em comparação à reação utilizando
de metais nobres (HAMEED et al, p. 2, 2018). Mesmo apresentando uma elevada
atividade catalítica para a reação de eletro-oxidação da ureia, a melhora da
atividade do níquel utilizando de funcionalizações e catalisadores bimetálicos é
comumente almejada (MA et al, p. 3, 2022). Partindo do princípio da obtenção de
catalisadores bimetálicos entre o níquel e um segundo metal, a síntese de
materiais binários NiCo tem sido estudada, já que materiais bimetálicos como
PtCo e PdCo proporcionam uma melhora na atividade eletrocatalítica do Ni para a
REU devido a propriedades eletrônicas particulares da interação entre os dois
metais (XU et al, p. 1, 2014). O mesmo ocorre para materiais binários NiCu, pois
já foi demonstrado que esta composição apresenta uma atividade eletrocatalítica
superior ao Ni metálico, pois o Cu preenche as vacâncias de elétrons da banda d
do Ni, limitando a expansão de volume da fase Ni2+ durante a oxidação da ureia
(ABUTALEB, p. 6, 2019). O objetivo deste trabalho foi avaliar a influência da
inserção de Cu e de Co em três diferentes proporções (razões atômicas 75:25,
50:50 e 25:75) frente a REU em meio alcalino. Desta forma, buscou-se determinar
dentre o Cu e Co, qual seria o melhor elemento para inserção junto ao Ni, assim
como, qual a melhor proporção de cada um, visando melhor atividade
eletrocatalítica na REU.
Material e métodos
As nanopartículas foram sintetizadas pelo método de redução por NaBH4 (BARBOSA
et al, p. 2, 2020). Neste processo para os materiais da série NiCo, Ni100-A e
Co100, e combinação binária NiCo (razão atômica 75:25, 50:50 e 25:75) foram
utilizados Ni(NO3)2.6H2O (Sigma Aldrich) e CoCl2.6H2O (QUIMSAR) como precursores
metálicos, os mesmos foram solubilizados em etanol absoluto P.A. (Labsynth) e
adicionados a bureta. A reação durou em torno de 40 minutos e foi realizada a 5
ºC e sob constante agitação. As nanopartículas da série NiCu, Ni100-B, Cu100 e
binária NiCu (razões atômicas 75:25, 50:50 e 25:75) foram sintetizadas
utilizando o mesmo precursor de níquel utilizados anteriormente e CuSO4.6H2O
(VETEC) como precursores metálicos, e seguiu-se exatamente o mesmo protocolo das
anteriores, substituindo-se apenas o etanol por metanol (QUIMSAR). As dispersões
contendo as nanopartículas foram então centrifugadas e redispersas em etanol
99,3 % (Labsynth) e centrifugadas novamente para retirada de impurezas, este
processo foi repetido 2 vezes e por fim o material foi seco a 70 ºC por 18
horas. As nanopartículas foram então suportadas em Carbono Vulcan X72R (Cabot
Corporation). Todos os materiais suportados presentes neste trabalho apresentam
20% de carga metálica (BARBOSA et al, p. 3, 2020). As análises de difração de
raios X foram realizadas utilizando de um difratômetro Panalytical X’Pert Pro-
PW3042/10, usando uma fonte de radiação de Cu com λ=0,154 nm, no intervalo de 2θ
de 30° a 70° com uma taxa de varredura de 0,025 °/s. As propriedades magnéticas
dos materiais foram medidas a temperatura ambiente utilizando de um magnetômetro
de amostra vibrante (VSM) Versalab PPMS Quantum Design. Os ensaios
eletroquímicos foram realizados em temperatura ambiente utilizando de um
bipotenciostato μStat400 (Metrohm DropSens) e uma célula eletroquímica de 3
eletrodos feita de teflon. Os eletrodos de referência, contra-eletrodo e
eletrodo de trabalho utilizados foram Hg|HgO, uma folha de platina e um eletrodo
de carbono vítreo, respectivamente. A dispersão catalítica contendo os materiais
foi preparada utilizando de 10 mg de catalisador, 1166 μL de água Milli-Q
(Millipore®), 500 μL de álcool isopropílico (PROQUIMIOS) e 33 μL de uma solução
5% de Nafion®. Esta mistura foi então dispersa em um ultrassom por 5 minutos e
subsequentemente foram adicionadas 8 μL da dispersão na superfície do eletrodo
de carbono vítreo, de forma que a mesma foi seca a 60 °C por 10 minutos. As
voltametrias cíclicas (VC) foram realizadas em NaOH 1 mol L-1 a uma velocidade
de varredura de 10 mV s-1 em um intervalo de 0 a 0,7 V vs Hg|HgO (NTAIS et al,
p. 3, 2016). Foram realizados 10 ciclos na ausência de ureia, e 5 ciclos na
presença de 0,33 mol L-1 de ureia e apenas os últimos ciclos são reportados. Os
experimentos de cronoamperometria foram realizados por 60 minutos sob um
potencial de 0,55 V vs Hg|HgO. Todos os resultados reportados foram normalizados
pela massa de Ni (BARBOSA et al, p. 3, 2020).
Resultado e discussão
Os difratogramas obtidos referente aos materiais Ni100-A e Ni100-B, apresentaram
picos característicos para o Ni0 e Ni(OH)2 em 45,5º e 38,0º, respectivamente
(ZHOU et al, p. 5, 2019). Os materiais contendo cobre e cobalto apresentaram
picos referentes ao Cu0, Co0 e múltiplas fases oxidadas de Cu (PHUL et al, p. 3,
2018) e Co (CHUNG et al, p. 3, 2007). Das curvas de magnetização versus campo
magnético à temperatura ambiente foi possível observar para a série de materiais
NiCu que a magnetização de saturação apresenta um decréscimo com o aumento do
teor de cobre no material, ou seja, maiores magnetizações de saturação são
encontradas para os materiais ricos em Ni, com apenas uma exceção para o
Ni25Cu75, que apresentou uma saturação maior que a observada pra o Ni100-A,
indicando um forte efeito sinérgico entre os metais que compõe o material, onde
o Cu doa elétrons para a banda d vazia do Ni (ABUTALEB, p. 6, 2019). O Ni100-A
apresenta uma curva de histerese com valores de campo coercitivo e de
magnetização remanescente de 60,7 Oe e 0,00035 emu/g, respectivamente, indicando
um comportamento ferromagnético (HE et al, p. 2, 2012). Com a adição de Cu, a
curva de histerese desaparece e os valores de magnetização remanescente e campo
coercitivo se tornam muito próximos de 0, indicando um comportamento
superparamagnético, que corrobora as dimensões dos materiais, em escala
nanométrica, e a hipótese de que a adição de Cu ao Ni leva a uma alteração das
propriedades eletrônicas e, portanto, magnéticas do Ni, de forma que pode haver
uma melhora na atividade eletrocatalítica (MENESES et al, p. 6, 2011). Os
materiais da série NiCo apresentaram um comportamento esperado onde o Co100
apresenta maior magnetização de saturação por apresentar forte comportamento
ferromagnético, enquanto que este parâmetro decai com o aumento da porcentagem
de Ni no material (e subsequente diminuição da porcentagem de Co), tendo como
menor valor o Ni100-B (OTA, p. 4, 2014). Os voltamogramas cíclicos na ausência
de ureia estão representados na Figura 1, e é observável que tanto para o Ni100-
A/C quanto para o Ni100-B/C há a ocorrência dos picos de oxidação do Ni(OH)2
para o NiOOH em 0,48 V, e da redução do NiOOH para o Ni(OH)2 em 0,31 V, valores
semelhantes aos reportados na literatura (BARBOSA et al, p. 6, 2020). Com a
adição de Cu os picos de oxidação do Ni se tornam cada vez mais largos e são
deslocados para um maior potencial, aproximadamente 0,51 V, enquanto que os
picos de redução acabam por também serem deslocados para maiores potenciais,
porém, mudando para 0,36, 0,4 e 0,41 V para os materiais Ni75Cu25/C, Ni50Cu50/C
e Ni25Cu75/C, respectivamente. Assim, fica evidente que a inserção de cobre leva
a uma alteração nos intervalos de potenciais dos processos do Ni. Há também o
aparecimento de um segundo pico demonstrando a presença de um processo
envolvendo o Cu. Os materiais da série contendo Co apresentam um deslocamento
dos picos de oxidação do Ni para potenciais cada vez menores, na medida que o
conteúdo de cobalto no material aumenta, sendo observado em 0,41, 0,33 e 0,25 V
para o Ni75Co25/C, Ni50Co50/C e Ni25Co75/C, respectivamente. Os picos de redução
do Ni também sofrem deslocamento para potenciais cada vez menores de 0,28, 0,23
e 0,20 V para o Ni75Co25/C, Ni50Co50/C e Ni25Co75/C, respectivamente. Assim,
fica evidente que a inserção de cobalto leva a uma alteração nos intervalos de
potenciais dos processos do Ni. A partir de maiores porcentagens de Co, como o
Ni25Co75/C e Co100/C, é possível observar o aparecimento de dois pares de picos,
indicando processos de oxirredução de duas fases distintas de Co. Vale ressaltar
os comportamentos antagônicos das duas séries de materiais, já que o aumento da
porcentagem de Cu na série NiCu leva a um deslocamento tanto dos picos de
oxidação do Ni quanto os de redução para maiores potenciais, enquanto que o
aumento da porcentagem de Co na série NiCo leva a um deslocamento dos picos de
oxidação e redução para menores potenciais. Os voltamogramas cíclicos obtidos na
presença de 0,33 mol L-1 de ureia em 1 mol L-1 de NaOH para as duas séries de
materiais estão dispostos na Figura 2. Para os materiais contendo Co é
observável que o Co100/C não apresenta qualquer atividade para a eletro-oxidação
da ureia, e a adição de Co não leva a um aumento na atividade eletrocatalítica
do Ni, já que as densidades de corrente do processo de eletro-oxidação da ureia
utilizando todos os materiais da série apresentam picos de corrente no potencial
aproximado de 0,57 V menores que as obtidas para o Ni100-B/C. Para os materiais
da série contendo Cu é observável que o Cu100/C também não apresenta atividade
catalítica para a eletro-oxidação da ureia. O material Ni25Cu75/C possibilitou a
obtenção de uma densidade de corrente 18% maior do que o obtido utilizando do
Ni100-A/C para a reação de eletro-oxidação da ureia, tendo assim a melhor
atividade eletrocatalítica dos materiais sintetizados. Essa melhora na atividade
eletrocatalítica se deve provavelmente a um forte efeito sinérgico desta
composição, onde a doação de elétrons proveniente do Cu para a banda d vazia do
Ni, possibilita uma diminuição na energia de adsorção de intermediários
proveniente da reação de eletro-oxidação da ureia, levando então a uma
diminuição na taxa de envenenamento deste catalisador (JAFARIAN et al, p. 2,
2006). As análises de cronoamperometria demonstram que os materiais da série
NiCo possibilitaram obter densidades de corrente do processo estudado, ao final
do experimento na mesma ordem das densidades de corrente obtidas pelas
voltametrias cíclicas na presença de ureia demonstrando que a adição de Co não
leva a um aumento da densidade de corrente do processo de eletro-oxidação de
ureia no intervalo de tempo estudado. Os materiais da série NiCu possibilitaram
obter densidades de corrente na mesma ordem das densidades de corrente obtidas
nas voltametrias cíclicas na presença de ureia, onde a densidade de corrente
obtida ao final da cronoamperometria utilizando do Ni25Cu75/C é 221% maior que a
obtida utilizando do Ni100-A/C.
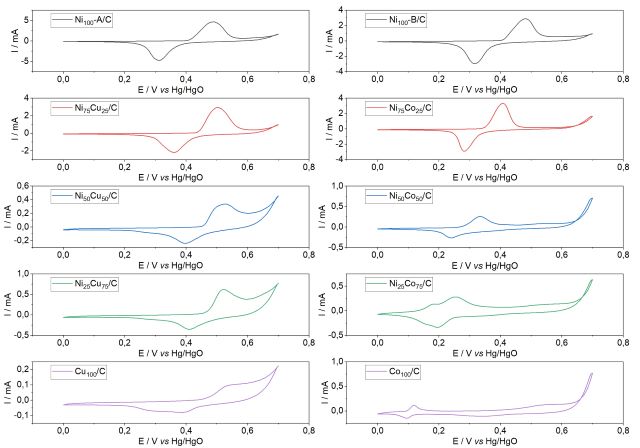
Voltametrias cíclicas em NaOH 1 mol L-1 na ausência de ureia para os materiais NiCu e NiCo v=0,05 V s-1
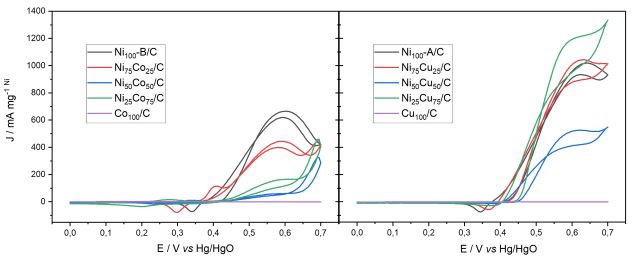
Voltametrias cíclicas em NaOH 1 mol L-1 e ureia 0,33 mol L-1 para os materiais NiCu e NiCo v=0,01 V s-1
Conclusões
Os resultados deste trabalho demonstram que a adição de Co ao Ni não leva a uma
melhora na atividade eletrocatalítica para o processo de eletro-oxidação de ureia,
porém a adição de Cu ao Ni leva a uma melhora na atividade eletrocatalítica frente
a reação estudada. O melhor eletrocatalisador sintetizado foi o Ni25Cu75/C pois
foram obtidas densidades de corrente de pico 18% maiores na voltametria cíclica em
presença de ureia e 221% maiores ao final do experimento de cronoamperometria
quando comparadas com as densidades de corrente obtidas para o Ni100-A/C. Esta
melhora na atividade catalítica se deve provavelmente ao efeito sinérgico entre o
Ni e o Cu, onde o Cu doa elétrons para a banda d vazia do Ni, mudando então a
estrutura eletrônica do Ni, e levando a alterações nas suas propriedades
magnéticas, alterações essas que foram observadas nas curvas de magnetização
versus campo magnético. Esta doação de elétrons para o Ni faz com que
provavelmente a energia de adsorção de intermediários formados durante a reação de
eletro-oxidação da ureia diminua, diminuindo, portanto, a taxa de envenenamento do
catalisador.
Agradecimentos
FAPERJ (E-26/211.371/2019, 26/201.435/2021, E-26/210.793/2021), Capes-PrInt
(88887.310269/2018-00.), CAPES, CNPq e CBPF.
Referências
ABDEL HAMEED, R. M.; MEDANY, S. S. Influence of support material on the electrocatalytic activity of nickel oxide nanoparticles for urea electro-oxidation reaction. Journal of Colloid and Interface Science, no 513, p. 536–548, 2018.
ABUTALEB, A. Electrochemical Oxidation of Urea on NiCu Alloy Nanoparticles Decorated Carbon Nanofibers. Catalysts, no 9, 397-409, 2019.
BARBOSA, J. R.; PARANHOS C. H.; ALVES, O. C.; CHECCA, N. R.; SERNA, J. P.; ROSSI, A. L.; SILVA, J. C. M. Low loading platinum dispersed on Ni/C nanoparticles as high active catalysts for urea electrooxidation reaction. Electrochimica Acta, no 355, 136752-136760, 2020.
CHUNG, S. R.; WANG, K. W.; SHEEN, S. R.; YEH, C. T.; PERNG, T. P.; Electrochemical Reduction and Hydrogenation of Co Oxides. Electrochemical and Solid-State Letters, no. 10, p. 155-158, 2007.
GOPI, S.; RAMU, A. G.; SAKTHIVEL, S.; et al. Cobalt-modified 2D porous organic polymer for highly efficient electrocatalytic removal of toxic urea and nitrophenol. Chemosphere, no 265, p. 129052-129061, 2021.
HE, X.; SHI, H. Size and shape effects on magnetic properties of Ni nanoparticles. Particuology, no. 10, p. 497-502, 2012.
JAFARIAN, M.; MOGHADDAM, R. B.; MAHJANI, M. G.; GOBAL, F. Electro-catalytic oxidation of methanol on a Ni–Cu alloy in alkaline médium. Journal of Applied Electrochemistry, no. 36, p. 913-918, 2006.
JOHNSON, S. F. Methemoglobinemia: Infants at risk. Current Problems in Pediatric and Adolescent Health Care, n. 3, p. 57–67, 2019.
KAKATI, N. et al. Hollow Sodium Nickel Fluoride Nanocubes Deposited MWCNT as An Efficient Electrocatalyst for Urea Oxidation. Electrochimica Acta, no 240, p. 175–185, 2017.
MA, Y.; MA, C.; WANG, Y.; WANG, K. Advanced Nickel-Based Catalysts for Urea Oxidation Reaction: Challenges and Developments. Catalysts, no 12, 337-360, 2022.
NTAIS, S.; SEROV, A.; ANDERSEN, N. I.; ROY, A. J.; COSSAR, E.; ALLAGUI, A.; LU, Z.; CUI, X.; BARANOVA, E. A.; ATANASSOV, P. Promotion of Ammonia Electrooxidation on Pt nanoparticles by Nickel Oxide Support. Electrochimica Acta, no 222, 1455-1463, 2016.
OTA, N. Magnetic Moment and Band Structure Analysis of Fe, Co, Ni-modified Graphene-nano- ribbon. arXiv. Org, no. 1, p. 4504-4510, 2014.
PHUL, R.; KAUR, C.; FAROOQ, U.; AHMAD, T. Ascorbic acid assisted synthesis, characterization and catalytic application of copper nanoparticles. Material Science & Engineering International Journal, no. 4, p. 90-94, 2018.
QUADRA, G. R.; TEIXEIRA, J. R. P. V. A.; BARROS, N. et al. Water pollution: One of the main limnology challenges in the anthropocene. Acta Limnologica Brasiliensia, no 31, p. 203-215, 2019.
RAMÍREZ-MENESES, E. R.; BETANCOURT, I.; MORALES, F.; MONTIEL-PALMA, V.; VILLANUEVA- ALVARADO, C. C.; HERNÁNDEZ-ROJAS, M. E. Superparamagnetic nickel nanoparticles obtained by an organometallic approach. Journal of Nanoparticle Research, no. 13, p. 365-374, 2011.
SATAYEVA, A. R. et al. Investigation of rice husk derived activated carbon for removal of nitrate contamination from water. Science of the Total Environment, no 630, p. 1237–1245, 2018.
URBAŃCZYK, E.; SOWA, M.; SIMKA, W. Urea removal from aqueous solutions—a review. Journal of Applied Electrochemistry, no 46, p. 1011–1029, 2016.
XU, W.; ZHANG, H.; LI, G.; WU, Z. Nickel-cobalt bimetallic anode catalysts for direct urea fuel cell. Scientific Reports, no 4, 5863-5869, 2014.
ZHOU, X. C.; YANG, X. Y.; FU, Z. B.; YANG, Q.; YANG, X.; TANG, Y. J.; WANG, C. Y.; YI, Y. Single-crystalline ultrathin nanofilms of Ni aerogel with Ni(OH)2 hybrid nanoparticles towards enhanced catalytic performance for ethanol electro-oxidation. Applied Surface Science, no. 492, p. 756-764, 2019.
ZHU, B.; LIANG, Z.; ZOU, R. Designing Advanced Catalysts for Energy Conversion Based on Urea Oxidation Reaction. Small, no 1906133, p. 1–19, 2020.
















