Autores
Olate-moya, F. (UNIVERSIDAD DE CHILE-IMPACT) ; Rubí-sans, G. (INSTITUTE FOR BIOENGINEERING OF CATALONIA (IBEC)) ; Mateos-timoneda, M. (BIOENGINEERING INSTITUTE OF TECHNOLOGY, UIC) ; Engel, E. (INSTITUTE FOR BIOENGINEERING OF CATALONIA (IBEC)) ; Palza, H. (UNIVERSIDAD DE CHILE-IMPACT)
Resumo
El uso de células madre mesenquimales humanas (hMSCs) en ingeniería de tejidos y
medicina regenerativa (ITMR) es una atractiva opción de tratamiento de
enfermedades del cartílago. En este trabajo se desarrolla un nuevo biomaterial
basado en alginato (ALG), gelatina (GEL), sulfato de condroitina (CS) y óxido de
grafeno (GO) para aplicaciones en bioimpresión 3D. Los resultados muestran que
el nanocompósito en combinación con hMSCs permiten fabricar constructos mediante
bioimpresión 3D con alta fidelidad de forma y sobresaliente viabilidad celular a
28 días de cultivo in vitro. Además, este nanocompósito es intrínsecamente
condrogénico sin utilizar factores exógenos. Los resultados de esta
investigación muestran este biomaterial como candidato para aplicaciones en ITMR
del cartílago.
Palavras chaves
Hidrogeles; Bioimpresión 3D; Condrogénesis
Introdução
Uno de los campos emergentes de mayor auge en las últimas décadas es la ITMR, en
el cual mediante principios de ingeniería, química de los materiales y ciencias
de la vida, se desarrollan sustitutos biológicos para restaurar, mantener o
mejorar la función de un tejido u órgano entero (SHAFIEE; ATALA, 2016). En
particular, el tejido cartilaginoso está compuesto por células llamadas
condrocitos inmersas en una matriz extracelular (ECM) con pobre vascularización
y carece de capacidad auto-regenerativa ante una lesión o degeneración
(CALIKOGLU KOYUNCU et al., 2017). La ITMR se ha potenciado con el uso
terapéutico de hMSCs, este fenotipo primitivo de células tiene la capacidad de
diferenciarse a múltiples fenotipos celulares como por ejemplo condrocitos del
cartílago (PAREKKADAN; MILWID, 2010). Hidrogeles basados en polímeros naturales
como polisacáridos o polipéptidos poseen grupos funcionales modificables
químicamente que permiten distintas opciones de entrecruzamiento, bioconjugación
e injerto de motivos moleculares; lo que permite controlar las propiedades
mecánicas, tasa de degradación, propiedades químicas y bioactividad del material
(BALAKRISHNAN; BANERJEE, 2011). El propósito de este trabajo es producir una
matriz de hidrogel reforzada con óxido de grafeno (GO) para imitar el ambiente
extracelular del tejido cartilaginoso. Para obtener este nanocompósito hidrogel,
se plantea bioconjugar el polisacárido alginato (ALG) con los polímeros
bioactivos gelatina (GEL) y sulfato de condroitina (SC), para incrementar la
adhesión-proliferación celular e inducir condrogénesis en células madre
mesenquimales humanas (hMSCs), respectivamente. Para llevar a cabo la
bioconjugación se modificó químicamente los biopolímeros con grupos metacriloílo
(ALG-MA, GEL-MA y SC-MA) para obtener cadenas poliméricas foto-entrecruzables
entre sí. A esta matriz de hidrogel se adicionó GO y hMSCs para formular una
biotinta apta para la fabricación de constructos mediante bioimpresión 3D.
Material e métodos
Los tres biopolímeros ALG, SC y GEL fueron funcionalizados con grupos
metacriloilo polimerizables, para obtener respectivamente ALG-MA, SC-MA y GEL-MA
(OLATE-MOYA et al., 2020). Los biopolímeros metacrilados fueron caracterizados
mediante resonancia magnética nuclear de protones (1H RMN). El foto-
entrecruzamiento de los biopolímeros metacrilados, fue llevado a cabo utilizando
el fotoiniciador (PI) Irgacure 2959 al 0.05 % (p/v). La síntesis de GO fue
realizada mediante el método de Hummers modificado, a partir de la oxidación de
grafito en polvo (XIN et al., 2015). El GO sintetizado fue caracterizado a
través de FTIR, microscopía electrónica de transmisión (TEM) y difracción de
rayos X (DRX). La bioimpresión 3D de constructos se realizó empleando una
biotinta compuesta por: ALG 17 mg mL-1, ALG-MA 10 mg mL-1,
CS-MA 10 mg mL-1, GEL-MA 10 mg mL-1, GO 0.1 mg
mL-1, PI 0.5 mg mL-1 y 8.4 · 105 hMSCs
mL-1 en buffer fosfato salino (PBS) con 10 % de suero fetal bovino
(FBS). Los constructos fueron fabricados en una bioimpresora
3DDiscoveryTM Evolution (RegenHu), equipada con una lámpara LED UV.
La viabilidad de las hADMSCs embebidas en los constructos fue estudiada in vitro
mediante un ensayo de doble tinción Live/Dead utilizando calceína-AM y ioduro de
propidio. Para determinar los niveles de expresión de genes condrogénicos, se
llevó a cabo un análisis cuantitativo mediante reacción en cadena de polimerasa
transcriptasa reversa en tiempo real (RT-qPCR). Se estudió la expresión génica
de colágeno tipo I (COLL I), colágeno tipo II (COLL II), agrecano (ACAN) y SOX
9.
Resultado e discussão
El análisis mediante espectroscopía 1H RMN confirmó la
funcionalización de los tres biopolímeros (Figura 1a). Los espectros de ALG-MA y
SC-MA exhiben los dobletes característicos de protones vinílicos a 5.75 y 6.14
ppm, multipletes de protones metilénicos a 3.39 y 3.55 ppm y singletes de
protones metílicos a 1.94 ppm; correspondientes a las funcionalidades de
metacrilato de 2-amidoetilo. El espectro 1H RMN de GEL-MA muestra
picos de protones vinílicos de grupos metacrilamida a 5.44 y 5.67 ppm, un
doblete adicional de protones vinílicos a 5.75 y 6.14 ppm correspondiente a
grupos metacrilato y el singlete de protones metílicos a 1.94 ppm. La síntesis
de GO verificó mediante ATR-FTIR, DRX y TEM (Figura 1b). El espectrograma ATR-
FTIR exhibe las bandas de estiramiento típicas de grupos funcionales oxidados:
banda ancha de enlaces O-H en torno a 3200 cm-1, carbonilos a 1712
cm-1, enlaces dobles C=C del plano basal aromático a 1618
cm-1 y de enlaces C-O a 1040 cm-1. Al comparar los
patrones de DRX de grafito y GO, se demuestra que la oxidación y el proceso de
exfoliación durante la síntesis produce un incremento de la distancia entre
capas (d). Mientras el grafito presenta una intensa reflexión característica a
26.38 ° (2θ, d = 0.34 nm), el difractograma de GO exhibe un pico de baja
intensidad a 12.37 ° (2θ, d= 0.71 nm) correspondiente a las reflexiones del
plano 001 producido por pocas capas de GO. Las imágenes TEM ratifican la
morfología laminar 2D del GO obtenido. La base de la biotinta empleada es
alginato que permite mejor procesabilidad durante la bioimpresión además de
aportar densidad de cargas negativas característico de la ECM del cartílago,
bioconjugado con gelatina (homólogo al colágeno del cartílago) y sulfato de
condroitina (presente naturalmente en la ECM del cartílago), en compósito con
óxido de grafeno (aporta densidad de cargas negativas y mejora la calidad de
impresión). Los ensayos Live/Dead realizados a los constructos 3D bioimpresos
con la biotinta formulada mostraron una elevada viabilidad celular (cerca de un
100 %) hasta el día 21 de cultivo y una distribución celular homogénea, tal como
se muestra en la Figura 2a. El ensanchamiento de las hebras bioimpresas puede
atribuirse a la producción de ECM, así como al hinchamiento del hidrogel. Para
cuantificar las propiedades condroinductivas del biomaterial desarrollado, se
estudió la expresión génica de marcadores condrogénicos mediante RT-qPCR en las
células cultivadas en los constructos utilizando medio no-condrogénico. La
Figura 2b muestra el cambio en la proporción (fold-change) de la expresión
genética de los marcadores indicativos de condrogénesis COLL 2, SOX 9 y ACAN al
día 14, 28 y 45 post bioimpresión (COLL 1 como control negativo). Pasado 14 días
de cultivo de los constructos, ya se expresaron positivamente los tres
marcadores condrogénicos y se tuvo un máximo de expresión relativa en el día 28.
Estos resultados replican el periodo que usualmente tarda el proceso de
diferenciación condrogénica cuando se utilizan medios de cultivos con
suplementos bioquímicos condrogénicos, lo que convierte este nuevo biomaterial
en un medio intrínsecamente condroinductivo.
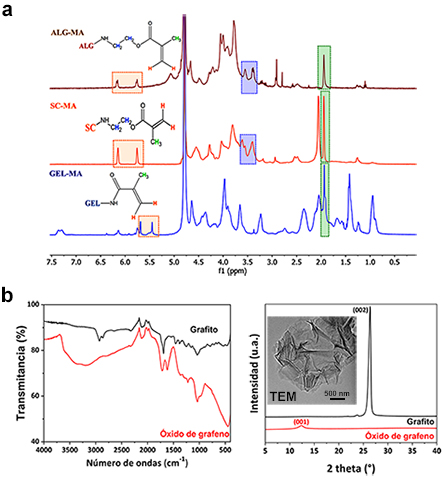
Espectros 1H RMN de los biopolímeros metacrilados (a). GO sintetizado: espectro ATR-FTIR y patrón de DRX con imagen TEM inserta (b).
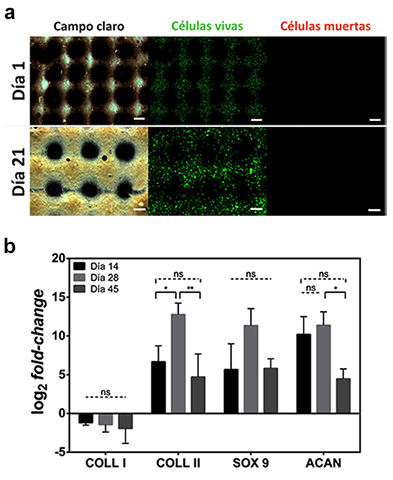
Ensayo Live/Dead en constructos 3D bioimpresos (barra: 600 μm) (a). Expresión génica de marcadores condrogénicos (*: p<0.05, **: p<0.01) (b).
Conclusões
La metacrilación de los polímeros utilizados es una estrategia sencilla de
modificación química que permite la bioconjugación mediante foto-entrecruzamiento,
lo cual fue implementado en un proceso de bioimpresión 3D. La biotinta formulada
es apta para la bioimpresión 3D de constructos con elevada viabilidad celular y
calidad de impresión. La matriz de alginato bioconjugado más GO es intrínsecamente
condroinductiva en hMSCs. Estos resultados son muy relevantes, puesto que el
desarrollo de biomateriales intrínsecamente condroinductivos ha sido muy poco
reportado.
Agradecimentos
Los autores agradecen a CONICYT Beca de Doctorado Nacional N° 21150039, Proyecto
FONDECYT N° 1150130 y Proyecto ANID-Basal Center of Interventional Medicine for
Precision and Advanced Cellular Therapy, IMPACT, # FB210024.
Referências
BALAKRISHNAN, B.; BANERJEE, R. Biopolymer-based hydrogels for cartilage tissue engineering. Chemical reviews, v. 111, n. 8, p. 4453–74, 10 ago. 2011.
CALIKOGLU KOYUNCU, A. C. et al. Cartilage tissue engineering on macroporous scaffolds using human tooth germ stem cells. Journal of Tissue Engineering and Regenerative Medicine, v. 11, n. 3, p. 765–777, 1 mar. 2017.
OLATE-MOYA, F. et al. Chondroinductive Alginate-Based Hydrogels Having Graphene Oxide for 3D Printed Scaffold Fabrication. ACS Applied Materials & Interfaces, v. 12, n. 4, p. 4343–4357, 29 jan. 2020.
PAREKKADAN, B.; MILWID, J. M. Mesenchymal Stem Cells as Therapeutics. Annual Review of Biomedical Engineering, v. 12, n. 1, p. 87–117, 2010.
SHAFIEE, A.; ATALA, A. Tissue Engineering: Toward a New Era of Medicine. Annual Review of Medicine, v. 68, n. 1, p. 29–40, 2016.
XIN, G. et al. Highly thermally conductive and mechanically strong graphene fibers. Science (New York, N.Y.), v. 349, n. 6252, p. 1083–7, 4 set. 2015.
















