Autores
Alves de Holanda, N.N. (UFERSA) ; de Souza Carvalho, L.J. (UFERSA) ; de Lima Leite, R.H. (UFERSA) ; Mendes Aroucha, E.M. (UFERSA) ; Gomes dos Santos, F.K. (UFERSA) ; Gomes de Menezes, F.L. (UFERSA)
Resumo
O ágar pode ser uma matéria prima para bioplásticos mas seu uso esbarra na sua
solubilidade em água. Lipídeos podem alterar a solubilidade em água deste
material. Este trabalho teve como objetivo estabelecer o efeito da adição de
cera de abelha e do surfactante tween80 na solubilidade de filmes de ágar.
Utilizou-se um Planejamento Central Composto (CCD) e Metodologia de Superfícies
de Resposta (SRM). As solubilidades dos filmes de ágar aditivados com 10% de
glicerol (plastificante), cera de abelha e tween80 variaram entre 19,5% e 30,1%
a 25ºC. O modelo obtido descreveu 88,5% da variação da solubilidade como função
das concentrações de cera e tensoativo. Encontrou-se um mínimo na solubilidade
correspondente a 18,9% para filmes de ágar contendo 6,48% de tween80 e 47,74% de
cera de abelha.
Palavras chaves
Ágar-ágar; Bioplásticos; Hidrocoloides
Introdução
A poluição causada pelo descarte excessivo de plásticos convencionais derivados
do petróleo e não biodegradáveis é um problema global que tem alcançado
relevância atualmente e vem sendo pauta de muitos debates e discussões (GARRIDO
et al., 2021). Nessa perspectiva, um caminho que vem obtendo resultados
promissores é a produção de bioplásticos compostos de elementos à base de
matérias primas naturais (LEITE et al., 2020). Normalmente produzidos por meio
do emprego de biopolímeros, como as proteínas e os polissacarídeos, os
bioplásticos apresentam vantagens em relação aos plásticos convencionais: são
biodegradáveis e possuem um ciclo de vida mais curto quando comparados com os
plásticos de origem fóssil; se decompõem em dióxido de carbono, metano e água,
sendo a degradação das macromoléculas contidas nos bioplásticos resultante da
ação de microrganismos de ocorrência natural, como bactérias, fungos e algas, em
ambientes microbiologicamente ativos (TONETTO et al., 2020).
Um biopolímero promissor é o ágar-ágar, ou simplesmente ágar, extraído de
diversos gêneros e espécies de algas marinhas vermelhas, da classe Rodophyta.
Tais algas que contém o ágar são classificadas como agarófitas e o teor de ágar
presente nelas pode variar de acordo com as condições do mar: temperatura da
água, intensidade de radiação solar, tensão de oxigênio e concentração de
dióxido de carbono (MOSTAFAVI & ZAEIM, 2020). O ágar é uma mistura heterogênea
de dois tipos de polissacarídeos: a agarose, um polímero neutro, e a
agaropectina, um polímero com carga sulfatado. A agarose, fração gelificante, é
uma molécula linear neutra, essencialmente livre de sulfatos, formada de cadeias
repetidas de unidades alternadas -1,3 D-galactose e -1,4 3,6-anidro-L-
galactose (MOSTAFAVI & ZAEIM, 2020). A agaropectina, fração não-gelificante, é
um polissacarídeo sulfatado composto de agarose e porcentagens variadas de éster
sulfato, ácido D-glucurônico e pequenas quantidades de ácido pirúvico. A agarose
é o componente principal, representando cerca de 70% do total. Em relação as
suas propriedades, o ágar-ágar é insolúvel em água fria, mas se dissolve
rapidamente em água quente.
O ágar é um material polimérico que absorve uma quantidade de água cerca de até
vinte vezes o seu próprio peso, isso se dá pelo seu alto índice de
hidrofilicidade, característica que proteínas, polissacarídeos e plastificantes
possuem. Essa condição pode afetar diretamente propriedades como a solubilidade
e a sorção de umidade dos filmes produzidos através dessa fonte, que por causa
da sua grande afinidade com a água oferecem fraca barreira ao vapor. Para
contornar essas adversidades, componentes hidrofóbicos naturais como as ceras
podem ser adicionados à matriz biopolimérica (BRANDELERO et al., 2013).
A cera de abelha é um lipídio comercialmente conhecido e que tem sido muito
utilizado em diversos ramos da indústria de cosméticos, farmacêutica e de
alimentos. Devido à sua alta hidrofobicidade e excelente resistência à umidade,
a cera de abelha é um constituinte favorável para a preparação de filmes
comestíveis em combinação com polissacarídeos ou proteínas (OLIVEIRA, 2017). O
processo direto de homogeneização entre materiais hidrofóbicos em uma matriz
hidrofílica não pode ser realizado com bons rendimentos pois estamos lidando com
polaridades diferentes, o que leva à adição de um tensoativo auxiliar na
formação e estabilização dessas misturas (OLIVEIRA, 2017, MINCHENG et al.,
2017).
A solubilidade em água é uma das mais significativas propriedades dos filmes
comestíveis, tanto nas suas aplicações, quanto na proteção dos alimentos com
elevada atividade de água, ou ainda quando os filmes entram em contato com a
água em todo o percurso da comercialização e distribuição dos alimentos, uma vez
que eles já estejam embalados. A solubilidade acaba também influenciando outras
propriedades de barreira, como a permeabilidade ao vapor de água, porque para
obter baixa transferência de vapor dentro de ambientes com faixa de umidade
relativa alta faz-se necessário a utilização de material com baixo índice de
solubilidade, com o propósito de garantir a integridade do produto, boa
propriedade de barreira à umidade e consequentemente maior vida de prateleira
(GOUDARZI & SHAHABI-GHAHFARROKHI, 2018; TONGDEESOONTORN et al. 2011).
Uma questão que surge é como a adição de matérias hidrofóbicos como a cera de
abelha e surfactantes como o tween80 influencia propriedades como a solubilidade
de filmes biopoliméricos. Conhecer a solubilidade em água é importante para a
aplicação deste tipo de filme em embalagens e coberturas em alimentos. Neste
trabalho utilizou-se um planejamento central composto (CCD) e metodologia de
superfícies de respostas (SRM) para estabelecer um modelo empírico capaz de
descrever a solubilidade dos filmes em função das concentrações de cera de
abelha e tween80 utilizadas nas misturas filmogênicas precursoras de filmes de
ágar-cera de abelha-tween80-glicerol.
Material e métodos
Os materiais usados neste estudo são foram o ágar-ágar em pó (grau alimentício),
fabricado por AGARGEL Indústria e Comércio, o surfactante tween 80 P.S
(polissorbato 80), número de hidroxilas 65-80, valor de saponificação 45-55,
glicerol P.A. ACS C3H5(OH)3, e a cera de abelha fornecida pela associação de
apicultores de Mossoró/RN-Brasil.
Os filmes constituídos de ágar, glicerol, tween80, cera de abelha e água foram
preparados usando metodologias adaptadas de estudos anteriores (Menezes et al.,
2021; Oliveira et al., 2018). O percentual de matéria seca (glicerol, ágar, cera
e tween80) foi fixado em 3% da mistura filmogênica, sendo o restante (97%)
constituído do solvente (água). O glicerol foi utilizado como plastificante
constituindo 10% do total de matéria seca em todos os filmes.
A determinação da solubilidade dos filmes de ágar foi realizada segundo
metodologia descrita por Menezes et al. (2021) e Oliveira et al. (2018). Neste
procedimento, pequenos quadrados (4cm x 4cm) dos filmes foram cortados e usados
como amostras. As amostras foram secas a uma temperatura de 105°C, por 1 hora,
em estufa (TE-394/2, Tecnal – Brasil). Em seguida foram dispostas em dessecador
até atingir a temperatura ambiente (25ºC) para então serem pesadas, fornecendo
assim os valores correspondentes à massa inicial. Uma vez determinada a massa
inicial das amostras, foi realizada a imersão destas em 50 mL de água destilada,
sob agitação de 200 rpm, por 24 horas, a 25°C, utilizando uma mesa agitadora
(TE-1401, Tecnal – Brasil), após esse tempo os filmes não solubilizados foram
retirados e secos nas mesmas condições usadas na determinação da massa inicial,
para então serem pesados para a obtenção da massa final não solubilizada.
A solubilidade dos filmes em água foi calculada através da Equação 01.
S = ((m_i-m_f)/m_i )x100 (1)
Onde S é a solubilidade em água em %, mi é a massa inicial do filme em g, e mf é
a massa final do filme em g.
O planejamento das composições dos filmes para este estudo foi feito através de
um planejamento central composto com dois fatores (X1 = % cera e X2 = % tween80)
e uma variável de resposta (Y = solubilidade em água - %). Foram utilizados
quatro pontos em fatorial, quatro pontos axiais (em estrela) e três repetições
no ponto central, perfazendo um total de onze pontos experimentais. As
repetições no ponto central foram utilizadas na estimação da variância e
considerou-se a homoscedasticidade ao longo do domínio experimental. Os
resultados experimentais para a solubilidade dos filmes de ágar produzidos foram
ajustados a um modelo empírico polinomial quadrático do tipo: Y = b0 + b1X1 +
b2X2 + b11X12 + b22X22 + b12X1X2, onde b0 é o intercepto, b1 e b2 são os
coeficientes lineares, b11 e b22 os coeficientes quadráticos e b12 o coeficiente
de interação entre os fatores. O modelo ajustado foi utilizado na obtenção de
uma superfície de isoresposta. A análise estatística foi realizada com auxílio
do programa Statística 13.2 (TIBCO Inc., USA).
Resultado e discussão
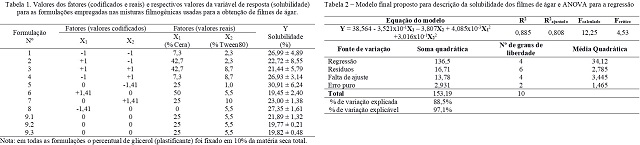
A Tabela 1 mostra os valores codificados e reais assumidos pelos fatores no
planejamento experimental, com os respectivos valores encontrados para a
variável de resposta (solubilidade dos filmes) para cada formulação das misturas
filmogênicas utilizadas na obtenção dos filmes de ágar. Analisando a Tabela 1, é
possível perceber que a solubilidade dos filmes variou entre 19,45% e 30,91%,
tendo-se obtido a menor solubilidade na formulação 6 -contendo 50% de cera e
5,5% de tween80, e a maior solubilidade na formulação 5 – contendo 25% de cera e
1% de tween80.
O ajuste de um modelo quadrático completo com interação entre os fatores
(Y = b0 + b1X1 + b2X2 + b11X12 + b22X22 + b12X1X2) aos dados experimentais
demonstrou que os maiores efeitos são encontrados para o termo linear do fator
X1 (concentração de cera de abelha) e para o termo quadrático do fator X2
(concentração de tween80). O menor efeito foi encontrado para o termo de
interação entre os fatores.
Eliminando-se os termos de baixa contribuição para o ajuste do modelo
aos dados experimentais encontrou-se o modelo que maximiza o valor de
R2ajustado, ou seja, estabeleceu-se o modelo com o menor número de termos que
permite à descrição adequada da variável de resposta em função dos fatores
experimentais. A Tabela 2 apresenta o modelo proposto para a descrição da
solubilidade dos filmes e os dados da ANOVA encontrados para a regressão.
O modelo obtido foi capaz de explicar 88,5% da variação observada para a
solubilidade dos filmes em função dos fatores experimentais. Além disso, o
modelo pode ser considerado descritivo para o fenômeno observado considerando
que o valor de Fcalculado foi superior ao valor de Fcrítico.
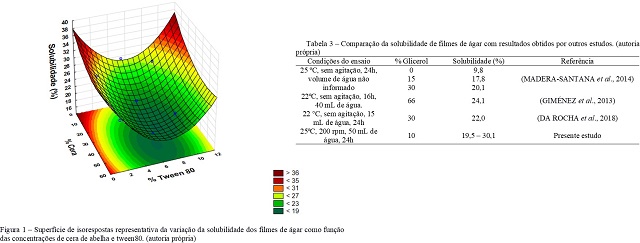
A confirmação da adequação do modelo empírico na descrição da solubilidade dos
filmes de ágar permite a obtenção de uma superfície de isorespostas (Figura 1)
que pode facilitar a compreensão da variação desta propriedade em função das
concentrações de cera de abelha e tween80 utilizadas na mistura filmogênica.
A Figura 1 demonstra que o aumento da concentração de cera de abelha provoca uma
diminuição da solubilidade dos filmes de ágar em água. Essa diminuição está
relacionada com a natureza hidrofóbica da cera, que é adicionada justamente com
a intenção de diminuir a solubilidade dos biofilmes, com o objetivo de tornar os
filmes mais resistentes quando em ambientes úmidos (KHANZADI et al., 2015; CAZON
& VAZQUEZ, 2020; SANTACRUZ et al., 2015). Porém, a adição de cera sem a adição
de um tensoativo pode não ser eficaz devido à desestruturação da matriz
biopolimérica quando da adição de um material hidrofóbico que tende a formar
aglomerados no interior da estrutura (KHANZADI et al., 2015). A Figura 1 mostra
também que a adição do surfactante tween80 até uma quantidade adequada reduz a
solubilidade dos filmes de ágar, porém, quando se adiciona um excesso do
surfactante ocorre um aumento da solubilidade dos filmes. Uma possível
explicação para este comportamento é que em baixas concentrações as moléculas
anfifílicas do tensoativo auxiliam na dispersão da cera hidrofóbica na matriz
hidrofílica do polímero e estabilizam a estrutura, porém, um excesso do
tensoativo tende a facilitar a solubilização da cera quando em contato com a
água. Convém lembrar também que a molécula do tensoativo possui grupos
hidrofílicos que podem também contribuir com o aumento da hidrofilicidade do
material biopolimérico. A superfície de isoresposta apresenta um ponto de mínimo
de solubilidade para concentrações de cera e tween80 iguais a 47,74% e 6,48%,
respectivamente. Neste ponto, a solubilidade do filme atinge um valor mínimo de
18,9%. A Tabela 3 compara os valores obtidos para a solubilidade de filmes de
ágar obtidos neste trabalho com outros filmes descritos na literatura.
Os dados da Tabela 3 mostram que as solubilidades dos filmes obtidos
neste estudo são da mesma ordem de grandeza de outros obtidos na literatura.
Esperava-se que a solubilidade dos filmes contendo cera de abelha estivesse
abaixo dos valores dos filmes de ágar da literatura. Contudo, as condições
utilizadas nos ensaios de solubilização dos filmes no presente estudo foram mais
severas – agitação, temperatura mais elevada e maior volume de solvente
utilizados.
Conclusões
A partir da produção dos filmes, e posteriormente a análise da solubilidade em
água, foi possível perceber a redução dos valores desta propriedade com a
incorporação da cera de abelha/tween80 em filmes de ágar, constatando que o
aumento da % de cera diminuiu significativamente a solubilidade em água dos
filmes.
No entanto, as concentrações de surfactante influenciaram na solubilidade quando
adicionados em concentrações adequadas diminui a solubilidade dos filmes, porém,
altas concentrações podem aumentar a solubilidade dos filmes. Recomenda-se a
utilização de uma concentração de tween80 de 6,48% na mistura filmogênica para a
obtenção de menores valores de solubilidade.
Agradecimentos
Os autores agradecem à Universidade Federal do Semi-Árido por propiciar os meios
para a realização desta pesquisa.
Referências
BRANDELERO, R. P. H.; GROSSMANN, M. V.; YAMASHITA, F. Hidrofilicidade de filmes de amido/poli(butileno adipato co tereftalato) (PBAT) adicionados de tween80 e óleo de soja, Polímeros, vol. 23, n. 2, p. 270-275, 2013.
CAZON, P.; VAZQUEZ, M. Mechanical and barrier properties of chitosan combined with other components as food packaging film. Environmental Chemical Letters, 18 (2) pp. 257–267, 2020.
DA ROCHA, M. et al. Effects of agar films incorporated with fish protein hydrolysate or clove essential oil on flounder (Paralichthys orbignyanus) fillets shelf-life. Food Hydrocolloids, 81, pp. 351-363, 2018.
GARRIDO, M.A. et al., Filmes biodegradáveis de gelatina incorporados com argila bentonita ionicamente modificada. Revista Verde, Pombal, Paraíba, Brasil, v. 16, n.2, abr.-jun, p.182-188, 2021.
GIMÉNEZ, B. et al. Release of active compounds from agar and agar-gelatin films with green tea extract. Food Hydrocolloids, 30, pp. 264-271, 2013.
GOUDARZI, V.; SHAHABI-GHAHFARROKHI, I. Development of photo-modified starch/kefiran/TiO2 bio-nanocomposite as an environmentally-friendly food packaging material. International Journal of Biological Macromolecules, Vol. 116, pp. 1082-1088, 2018.
KHANZADI, M.; JAFARI, S. M.; MIRZAEI, H.; CHEGINI, F. K.; MAGHSOUDLOU, Y.; DEHNAD, D. Physical and mechanical properties in biodegradable films of whey protein concentrate–pullulan by application of beeswax. Carbohydrate Polymers, 118, pp. 24–29, 2015.
LEITE, I.S.; PINTO Jr., W. R.; SILVA L. A. Biofilme a partir de gelatina e glicerol com a adição de íons de prata como agente antimicrobiano. Latin American Journal of Energy Research, 6, 2, pp. 1-11, 2020.
MADERA-SANTANA, T.J.; FREILE-PELEGRÍN, Y.; AZAMAR-BARRIOS, J.A. Physicochemical and morphological properties of plasticized poly(vinyl alcohol) – agar biodegradable films. International Journal of Biological Macromolecules, 69, pp. 176 -184, 2014.
MENEZES, F. L. G. et al., TiO2-enhanced chitosan/cassava starch biofilms for sustainable food packaging. Colloids and Surfaces A: Physicochemical and Engineering Aspects, Vol. 630, 5, e127661, 2021.
MINCHENG, guangming zeng. et al, Advantages and challenges of Tween80 surfactant-enhanced technologies for the remediation of soils contaminated with hydrophobic organic compounds, Chemical Engineering Journal, Vol. 314, 15, pp. 98-113, 2017.
MOSTAFAVI, F. S.; ZAEIM, D. Agar-based edible films for food packaging applications. International Journal of Biological Macromolecules, vol. 159, 15, pp. 1165-1176, 2020.
OLIVEIRA, V. R. R. Avaliação da incorporação de cera de abelha na hidrofobização de filmes biopoliméricos e seu efeito como cobertura na conservação pós-colheita da goiaba. 2017. 109p. Dissertação (Mestrado). pós-graduação em ciência e engenharia de materiais - Universidade Federal Rural do Semi-Árido, Mossoró-RN, 11 maio 2017.
OLIVEIRA, V.R.L. et al. Use of biopolymeric coating hydrophobized with beeswax in post-harvest conservation of guavas. Food Chemistry, 259, pp. 55–64, 2018.
SANTACRUZ, S.; RIVADENEIRA, C.; CASTRO M. Edible films based on starch and chitosan. Effect of starch source and concentration, plasticizer, surfactant’s hydrophobic tail and mechanical treatment, Food Hydrocolloids, 49, pp. 89–94, 2015.
TONETTO, M. L. et al. Desenvolvimento e caracterização de bioplásticos de amido de milho contendo farinha de subproduto de broto. Revista Brasileira de Tecnologia de Alimentos, vol. 23, pp. 1–13, 2020.
TONGDEESOONTORN, W. et al. Effect of carboxymethyl cellulose concentration on physical properties of biodegradable cassava starch-based films. Chemistry Central Journal, 5(6), 2011.
ZHU, Z.; CAI, H.; SUN, D.W. Titanium dioxide (TiO2) photocatalysis technology for nonthermal inactivation of microorganisms in foods. Trends in Food Science and Technology, 75, pp. 23–35, 2018.
















