Autores
Botelho, E.V.D. (UNIVERSIDADE FEDERAL DO PARÁ - CAMPUS ANANINDEUA) ; Lima, G.A. (UNIVERSIDADE FEDERAL DO OESTE DO PARÁ) ; Rodrigues, B.S. (UNIVERSIDADE FEDERAL DO PARÁ - CAMPUS ANANINDEUA) ; de Araújo, C.F. (UNIVERSIDADE FEDERAL DO PARÁ - CAMPUS ANANINDEUA) ; Almeida, A.L. (UNIVERSIDADE FEDERAL DO OESTE DO PARÁ) ; Nascimento, R.S. (UNIVERSIDADE FEDERAL DO OESTE DO PARÁ) ; Batista, R.G.C. (UNIVERSIDADE FEDERAL DO PARÁ - CAMPUS ANANINDEUA) ; Leite, W.C. (UNIVERSIDADE FEDERAL DO PARÁ - CAMPUS ANANINDEUA) ; da Silva, E.S. (UNIVERSIDADE FEDERAL DO PARÁ - CAMPUS ANANINDEUA) ; Fiqueira, B.A.M. (UNIVERSIDADE FEDERAL DO OESTE DO PARÁ)
Resumo
Neste trabalho apresenta-se os resultados de
síntese hidrotermal de zeolita P1
sintetizada por fusão alcalina, utilizando-se
rejeitos de caulim da Amazônia. A
caracterização do material foi feita por
difratometria de raios-X, espectroscopia
de infravermelho e Raman. Os resultados
indicaram que zeólita P1 pode ser
sintetizada com bom ordenamento estrutural,
sem impurezas e com bandas Si-O-Si e
Al-O-Al diagnosticas na espectroscopia Raman e
IV.
Palavras chaves
Amazônia; rejeitos; zeólita P1
Introdução
Zeólita P1 é um aluminosilicato com fórmula
geral Na6Al6Si10O32*12H2O e corresponde ao
material zeolítico obtido em laboratório. Sua
estrutura cristaliza no sistema ortorrômbico
que tem seu análogo na natural como o mineral
Gismondine (HANSEN et al., 1990). Devido as
suas propriedades físico-químicas especificas,
zeo P1 tem sido proposta como adsorventes de
corantes (TSAI et al., 2021) e metais pesados
(BARKAT et al., 2015), removedoras de amônio
da água (LIU et al., 2018) e acondicionantes
de solos (FUNGARO et al., 2004).
Geralmente, as rotas de síntese para sua
obtenção empregam um gel de aluminosilicato de
sódio como fonte de Si e Al, que apesar do seu
alto grau de pureza, possui a desvantagem do
seu custo elevado. Uma das alternativas para
redução destes custos, está o uso de fontes
naturais alternativas de baixo custo para sua
síntese, como por exemplo, cinzas voláteis,
cinzas de casca de arroz, caulim, rejeitos da
mineração, dentre outros (Maia et al., 2008;
Hildebrando et al., 2014).
Neste trabalho, rejeitos da mineração da
Amazônia foram usados como fonte de Si e Al de
baixo custo para síntese de zeolita P1 com
ausência de processo de metacaulinização do
argilo mineral.
Material e métodos
a) Rota de síntese: para a síntese de zeolita
P1, foi empregado os rejeitos da mineração da
Amazônia e o método de fusão alcalina com
tratamento hidrotermal com modificações (MA et
al., 2014). Inicialmente, foi obtido um
material fundido que foi resultado da mistura
de NaOH com rejeitos a 200º C por 4 h. O
produto gerado foi resfriado, pulverizado e
misturado com 50 mL de H2O para obtenção de
hidrogel de aluminosilicato de sódio, que após
ser agitado, foi tratado hidrotermalmente por
48 h a 90º C. O produto final foi lavado com
água deionizada, secado a 70 ºC e pulverizado
para caracterização mineral.
b) Caracterização: a caracterização inicial
por difratometria de raios-X foi feita em
difratometro de raios-X D2 phaser (Bruker),
equipado com tubo de cobre (CuKa = 1.5406 Å),
utilizando-se geometria de Bragg-Brentano no
modo contínuo e com sistema de detecção usando
um detector rápido modelo LynxEye. A tensão
foi de 30 kV e 10mA, respectivamente. O
espectro de IV-FTIR foi registrado através de
pastilhas prensadas a vácuo contendo 0,200 g
de KBr e 0,0013 g de amostra pulverizada. O
espectrofotômetro empregado utilizado foi da
Bruker, modelo Vertex 70. O espectro Raman
obtido foi coletado em espectrômetro Raman
portátil com faixa de resposta entre 200-700
cm-1, com laser de 785 nm e baixo ruído.
Resultado e discussão
Os difratogramas obtidos para as amostras de
caulinita purificada dos rejeitos e zeólita
sintetizadas por fusão alcalina são mostrados
na Fig. 1, que mostra uma composição mineral
formada por caulinita (PDF 012-0447), quartzo
(PDF 01-082-0511), anatásio (PDF 01-086-1157)
e muscovita (PDF 00-007-0042) foram
identificados em 25,3º, 26,67º e 8,8º (2
theta), respectivamente. Para o produto final
(Gizeo-P1) foram observados picos mais
intensos nas posições 12,3º, 17,5º, 21,6º,
27,9º, 28,5º, e 33,2º (theta), que
correspondem respectivamente aos planos:
(011), (002), (112), (031), (301) e (123),
tais representantes da estrutura de zeólita P1
(ACORSIA et al., 2009).
Os espectros de IV-FTIR e Raman da amostra
Gizeo-P1são mostrados na Fig. 2. Um total de 7
bandas foram identificadas na espectroscopia
de IV-FTIR (Fig. 2a), sendo que as bandas de
4000 a 3000 cm-1 correspondem aos alongamentos
da vibração dos grupos OH- e moléculas de água
que podem estar presentes nos poros das
zeólitas (Hildebrando et al., 2014). Os picos
em torno de 1600 cm-1 são de moléculas de H2O
adsorvidas na estrutura, enquanto entre 1500 a
400 cm-1 indicam bandas diagnosticas das
unidades básicas de TO4 (T = Si, Al) de
zeólita P1 e funcionam como uma “impressão
digital” da estrutura zeolitica. Vale
ressaltar que as bandas a 1015 cm-1, 980, 975,
740 e 605 cm-1, correspondes às vibrações de
alongamento simétricos Al-O-Al e Si-O-Si e do
anel duplo presente na estrutura da zeólitas
P1 (SHARMA et al., 2016). Na espectroscopia
Raman, bandas foram identificadas em 484, 424
e 164 cm-1 correspondentes aos modos
vibracionais de oxigênio em Si-O-Si e Al-O-Al
(TSAI et al., 2021).
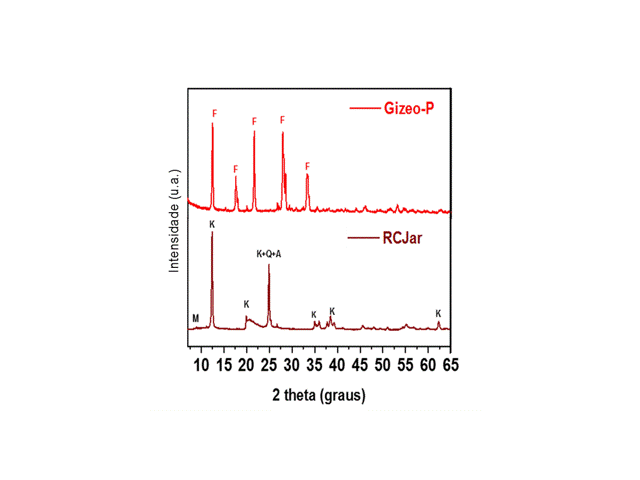
Padrões DRX do material de partida (RCJAr) e zeo (Gizeo P).
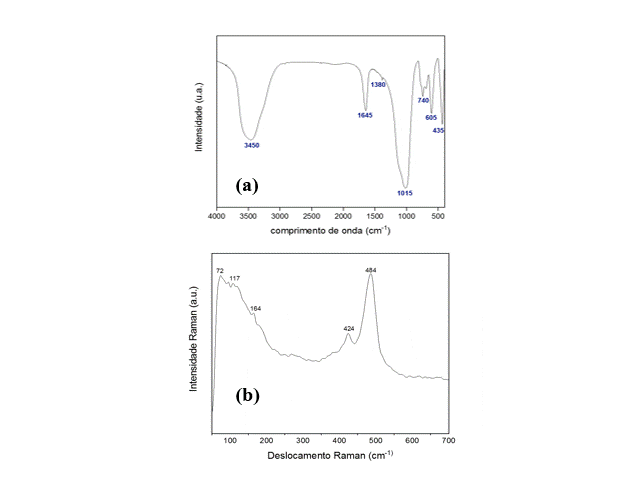
Espectro de IV(a) e Raman (b) de zeo P1 (Gizeo P)
Conclusões
Os rejeitos da mineração da Amazônia foram convertidos com sucesso em zeólita P1
através de fusão alcalina e tratamento hidrotermal, indicando que uma matéria
prima abundante e sem valor comercial atualmente pode ser reaproveitada, com a
vantagem de contribuir para a sustentabilidade da Amazônia.
Agradecimentos
Os autores agradecem a CAPES, CNPQ, UFOPA, LCM (IFPA), LAMIGA (UFPA) e CETENE pelo
apoio financeiro e analítico que permitiram a execução deste trabalho.
Ao prof. Dr. Bruno A. M. Figueira
Referências
ACORSIA, Marta M. et al. Transformação de Caulim em Zeólita Tipo P, Cerâmica Industrial, v. 14, 2009.
BARKAT, Mahfoud et al. Uranium (VI) adsorption on synthesized 4A and P1 zeolites: Equilibrium, kinetic, and thermodynamic studies. Comptes Rendus Chimie, v. 18, n. 3, p. 261–269, março, 2015.
FUNGARO, D. A.; SILVA, M. G. Utilização da Zeólita Preparada a partir da Cinza Residuária do Carvão como Adsorvedor de Metais em Água. Química Nova, São Paulo, v. 25, n. 6B, p.1081-1085, 2002.
HANSEN, S.; HÅKANSSON, U.; FÄLTH, L. Structure of synthetic zeolite Na-P2. Acta Crystallographica Section C Crystal Structure Communications, v. 46, n. 8, p.1361–1362, 1990.
HILDEBRANDO, E. A. et al. Synthesis and Characterization of Zeolite NaP Using Kaolin Wasteas a Source of Silicon and Aluminum. Materials Research, v. 17, p. 174-179, 2014.
LIU, Y. et al. Synthesis of zeolite P1 from fly ash under solvent-free conditions for ammonium removal from water. Journal of Cleaner Production, v. 202, p.11–22, 2018.
MA, Yunan et al. Synthesis and characterization of 13X zeolite from low-grade natural kaolin. Advanced Powder Technology, v. 25, n. 2, 495-499, março, 2014.
MAIA, A. A. B.; ANGÉLICA, R. S.; NEVES, R. F. Estabilidade térmica da zeólita A sintetizada a partir de um rejeito de caulim da Amazônia. Cerâmica, v. 54, p.345-350, 2008.
SHARMA, P. GIS-NaP1 zeolite microspheres as potential water adsorption material: Influence of initial silica concentration on adsorptive and physical/topological properties. Scientific Reports, v.6, n. 1, março, 2016.
TSAI, Ying-Lai et al. Raman Spectroscopic Characteristics of Zeolite Group Minerals. Minerals, v.11, n.2, p. 167, 2021.
















