Autores
Silva, L. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Calado, O. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Davi, L. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Almeida, J. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Silva, M. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Ferro, J. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Xavier, J. (UNIVERSIDADE FEDERAL DE ALAGOAS) ; Barbosa, C. (UNIVERSIDADE FEDERAL DE ALAGOAS)
Resumo
Os Carbon dots (CDs) são nanopartículas luminescentes de carbono que
apresentam
ampla aplicação, em especial na área de sensores. Nesse sentido, CDs foram
sintetizados a partir da o-fenilenodiamina (CDs-oPD) via método hidrotermal a
fim
de avaliar seu potencial na detecção de pH e como agente antioxidante. Os CDs-
oPD
exibiram tamanho abaixo de 10 nm, bandas de absorções no UV-Vis ((transições π -
π
* (C=C) e n - π *(C=O/C-N)) e FTIR com vibrações características dos grupos de
superfície dos CDs, além de emissão independente do comprimento de onda de
excitação (λExc) em 547 nm. Os CDs-oPD demonstraram viabilidade
celular até 1000
µg/mL, boa sensibilidade ao pH na faixa 6 -12 e porcentagem de eliminação do
ácido
hipocloroso (HOCl), (72,3 ± 0,9 %).
Palavras chaves
Nanopartícula; Radicais livres; Sensor fluorescente
Introdução
Os carbon dots (CDs) são nanopartículas luminescentes de carbono que
apresentam
tamanho inferior a 10 nm. É formado por um núcleo grafítico e grupos de
superfície característicos dos materiais utilizados na síntese, principalmente
do precursor (Liu et. al., 2021; Ding et. al., 2020). Os CDs conseguem exibir
excelentes propriedades óticas como fluorescência no espectro visível e possuem
boa solubilidade, biocompatibilidade, fotoestabilidade, baixa toxicidade e
sínteses de baixo custo (Tuerhong et. al., 2017; Yan et. al., 2019). Por esses
motivos, os carbon dots têm contribuído em diversas aplicações, a exemplo
de seu
uso em bioimagem e na detecção de pH em amostras ambientais e biológicas (Yang
et. al., 2019; Ehtesabi et. al., 2020).
Trabalhos têm demonstrado que os CDs apresentam fluorescência dependente do pH
capaz de torna-los ótimos nanomateriais para atuarem como sensores fluorescentes
(Ehtesabi et. al., 2020). Omidi e colegas (2017) sintetizaram carbon dots
a
partir do citrato de amônio via método hidrotermal e obtiveram CDs com emissão
em 462 nm independente do comprimento de onda de excitação. Esse material foi
avaliado frente a variação de pH (4 a 10) e foi observado um aumento gradual na
intensidade de fluorescência com o aumento do pH do meio (Omidi et. al., 2017).
Em 2019, Yang e pesquisadores realizaram um estudo semelhante, em que foram
produzidos CDs com emissão em 575 nm a partir do 1, 2, 4 - triaminobenzeno e
ureia. A emissão apresentou ser dependente do pH, com aumento de intensidade do
pH 4 ao 10 (Yang et. al., 2019). Em ambos os trabalhos, os carbon dots
foram
aplicados no monitoramento de cicatrização de feridas por meio da variação
colorímetrica/fluorescente, porém não foram realizados estudos de viabilidade
celular para garantir a biocompatibilidade do material.
Para além das propriedades fluoresecentes, os CDs têm exibido potenciais
aplicações como agente antioxidante na captura de espécies reativas de oxigênio
(ROS) em sistemas biológicos (Huangfu et. al., 2021). Estudos nesse sentido são
importantes pois várias doenças como as cardiovasculares e degenerativas são
causadas pelo stress oxidativo das células devido a ação irregular de
radicais
oxigenados, a exemplo dos hidroxil (•OH), peroxil (ROO•), ânion superóxido
(O2•˗) e algumas espécies que podem ser convertidas nesses radicais, como o
ácido hipocloroso (HOCl), peróxido de hidrogênio (H2O2), etc (Apak et. al.,
2022). Shen et. al (2017) sintetizaram carbon dots utilizando pomelo co-
dopados
com persulfato de amônio por um método hidrotermal e obtiveram nanopartículas
com emissão máxima em 450 nm. A atividade antioxidante dos CDs foi avaliada
utilizando os radicais DPPH, •OH e O2•˗, em que demonstraram bons resultados na
captura de radicais, principalmente dos O2•˗ atingindo 81% na concentração de
700 μg/mL (Shen et. al., 2017).
Nessa perspectiva, o trabalho buscou realizar estudos do efeito do pH e
atividade de eliminação frente ao radical ânion superóxido (O2•˗) e ácido
hipocloroso (HOCl) nos carbon dots obtidos da o-fenilenodiamina para
futuras
aplicações nas áreas biológicas e ambientais.
Material e métodos
Síntese dos Carbon dots (CDs-oPD) e estudo do efeito do pH: 20 mg de o-
fenilenodiamina e 10 mL de água deionizada foram adicionados em um reator de
teflon, revestido de aço inox, para procedimento hidrotermal por 4:30 h a 200
°C. Após, a solução contendo o CDs foi centrifugada a 15000 RPM/10 min e
filtrada em membrana de 0,22 µm (Davi et. al., 2021). O CDs obtido foi
denominado de CDs-oPD e armazenado em geladeira para posteriores análises. Os
CDs foram caracterizados por espectroscopia de absorção no ultravioleta e
visível (UV-VIS), infravermelho (FTIR) e fotoluminescência (FL). Ademais, foram
utilizadas as técnicas de Espalhamento Dinâmico de Luz (DLS) e microscopia
eletrônica de transmissão (MET). O efeito do pH na FL foi realizado utilizando
pH na faixa 2 ao 12 sob excitação em 385 nm.
Viabilidade celular:
Para o ensaio de viabilidade celular dos CDs-oPD foi utilizado o ensaio de MTT
((brometo de [3-(4,5-dimetiltiazol-2yl)-2,5-difenil tetrazolium])) em linhagem
de fibroblastos de pele humana (HFF-1). As células foram mantidas em estufa de
CO2/37º C em meio DMEM suplementado com SBF 15%, 100 µg/mL de penicilina e 100
U/mL de estreptomicina, acrescidos de 1,5 mM de L-glutamina. Para a realização
do ensaio, 3,5 x103 células foram plaqueadas (DMEM/SBF5%) e mantidas em estufa
por 20 h para sua adesão. Em seguida, foram tratadas com os CDs-oPD nas
concentrações de 100, 500 e 1000 µg/mL durante 24h. Após o tempo de exposição,
foi adicionado 23 µL de MTT (5 mg/mL) em todos os poços e a placa foi mantida em
estufa por 3h e, em seguida, o sobrenadante foi descartado e 150 µL de DMSO/poço
foi adicionado para a revelação dos cristais de formazan formados. Por fim, a
leitura dos poços foi realizada no espectofotômetro em comprimento de onda de
540 nm, obtendo-se os valores de densidade óptica (DO) (Viabilidade (%) = (DO de
células tratadas/DO de células não tratadas) × 100).
Atividade de eliminação do radical ânion superóxido (O2•˗):
A atividade de eliminação do O2•˗ foi realizada de acordo com Lucas et al.
(2021). O ensaio consistiu na adição NADH (166 µM), NBT (43,3 µM), solução de
CDs (100 - 800 µg mL-1 ) e PMS (2,7 µM). As medidas de absorbância foram
realizadas em 560 nm a 37 ◦C em um leitor de microplacas (Infinite® 200 PRO,
TECAN, Männedorf, Suíça).
Atividade de eliminação do ácido hipocloroso (HOCl):
A atividade de eliminação do HOCl foi realizada de acordo com Lucas et al.
(2021). A solução de HOCl foi preparada na hora da análise, ajustando o pH de
uma solução de NaOCl a 1% (v/v) para 6,2 com adição H2SO4. O sistema reacional
consistiu na adição de tampão fosfato (100 mM, pH 7.4), solução de CDs-OPD (100
- 400 µg mL-1 ), solução de dihidrorodamina (DHR, 5 µM) e HOCl (5 µM). As
medidas de fluorescência foram realizadas em um leitor de microplacas (Infinite®
200 PRO, TECAN, Männedorf, Suíça), a 37 °C, em comprimentos de onda de 505 ± 10
nm e 530 ± 10 nm, para excitação e emissão, respectivamente.
Resultado e discussão
As imagens de microscopia eletrônica de transmissão (MET) (figura 1 (a)) mostram
que os CDs-oPD possuem estruturas quase-esféricas e grafítica (com espaçamento
interplanar de 0,24 nm). O histograma de DLS também é representado na
figura 1
(b) e indica que o tamanho da nanopartícula está distribuído principalmente em
3,8 nm, confirmando seu tamanho inferior a 10 nm (Liu et. al., 2021; Davi et.
al., 2021). Uma vez que os grupos de superfície influenciam nas propriedades
óticas dos CDs, o FTIR foi utilizado e seu espectro é mostrado na figura 1 (c).
Em 3332 cm-1 e 3217 cm-1 são observados dois picos
característicos de aminas
primárias, associados as vibrações de deformação axial N-H. Em 1600
cm-1 uma
banda C=C de núcleo aromático também é detectada, relacionada a deformação axial
da dupla ligação. Bandas C-N de aromáticos e N-H de deformação angular associada
a ligação de cadeias aromáticas foram observadas em 1327 cm-1 e 779
cm-1,
respectivamente (Davi et. al., 2021). Sugere-se, portanto, que os CDs-oPD tenham
sido funcionalizados pelos grupos presentes na o-fenilenodiamina, uma vez que
sua composição é rica em grupos nitrogenados (Ding et. al., 2020, Davi et. al.,
2021).
O espectro de absorção UV-Vis foi obtido (figura 1 (d)) e quatro bandas
associadas as transições π - π * e n – π * dos CDs-oPD são visualizadas. Em 210
e 232 nm, bandas referentes a transição π - π * (C=C) do núcleo grafítico foram
detectadas. Por outro lado, as bandas localizadas em 288 e 428 nm relativas a
transição n – π * (C=O, C-N) foram observadas e possuem relação com os grupos
presentes no material precursor (Ding et. al., 2017; Zhao et. Al., 2020)
Uma vez que os carbon dots apresentam fluorescência na região do visível,
a emissão dos CDs-oPD foi investigada pela técnica de fotoluminescência,
variando o comprimento de onda de excitação (λExc) entre 365 a 445
nm. O gráfico é representado na figura 1 (e) e a emissão dos CDs-oPD encontra-se
centralizada em 547 nm, independente do λExc, possuindo intensidade
máxima sob excitação de 385 nm. Adicionalmente, o perfil independente dos CDs-
oPD é claramente observado no diagrama de cromaticidade (figura 1 (f)) e está
associado aos níveis de energia dos grupos de superfície, que favorecem sua
emissão na região do verde independente da radiação utilizada (Reckmeier et.
al., 2016; Ding et. al., 2020)
Estudos preliminares foram realizados para avaliar o comportamento ótico dos
CDs-oPD sob diferentes pH. A espectroscopia de fotoluminescência foi empregada
para o estudo em questão e o gráfico obtido é representado na figura 2 (a). O
espectro mostra que a intensidade de fluorescência dos CDs-oPD aumentou de forma
gradual do pH 2 ao pH 6, quando atingiu seu máximo. Em valores mais elevados de
pH (6 ao 12) a fluorescência passou a diminuir progressivamente, faixa na qual a
curva apresentou melhor linearidade (I = 1107,31 -83,7 pH, R2 = 0,97). As
imagens das soluções frente a variação do pH são demonstradas na mesma figura,
bem como sua visualização em papel. Como a literatura sugere que as propriedades
óticas dos carbon dots dependem de seus grupos de superfície, infere-se
que quando o pH do ambiente em que os CDs se encontram é modificado,
consequentemente a estrutura desses grupos podem sofrer alterações, afetando
principalmente seu mecanismo de fluorescência (Omidi et. al., 2017; Yang et.
al., 2019). Por ser um estudo recente, pesquisadores utilizam alguns mecanismos
para interpretar a sensibilidade dos carbon dots ao pH, que pode estar
relacionada a mudança no estado de energia, agregação dos CDs,
protonação/desprotonação, transferências de prótons, etc (Liu et. al., 202;
Ehtesabi et. al., 2020).
Buscando assegurar a aplicação dos CDs-oPD como sensor de pH em sistemas
biológicos e ambientais, um estudo de interferência na viabilidade celular foi
realizado utilizando uma linhagem de fibroblastos não tumorais de pele humana
(HFF-1). A figura 2 (b) mostra que os CDs-oPD mantiveram a viabilidade das
células HFF-1 superior a 80% nas 3 concentrações testadas. Os resultados obtidos
corroboram com a literatura quando atribuem de forma geral uma baixa
citotoxicidade dessa classe de nanopartícula para vários tipos de células (Vale
et. al., 2021; Roy et. al., 2022). Ademais, os CDs-OPD apresentaram excelente
potencial de eliminação de HOCl nas concentrações testadas, com mais de 50 % de
captura na menor concentração avaliada que foi de 100 µg mL-1 (figura 2 (c)). No
entanto, quando testado frente ao O2•˗, o tratamento com os CDs-OPD não
apresentou qualquer efeito de eliminação mesmo aumentando a concentração até 800
µg mL-1. Os resultados sugerem que esses CDs reagem seletivamente com espécies
reativas de importância biológica (Shen et. al., 2017).
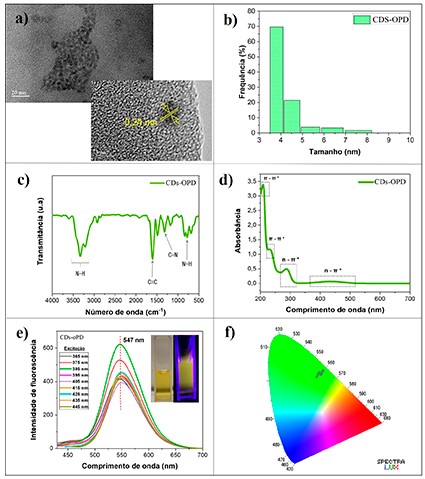
a) Microscopia eletrônica de transmissão e b) DLS. Espectros de c) FTIR, d) UV-Vis, e) fotoluminescência e f) coordenada de cor dos CDs- oPD.
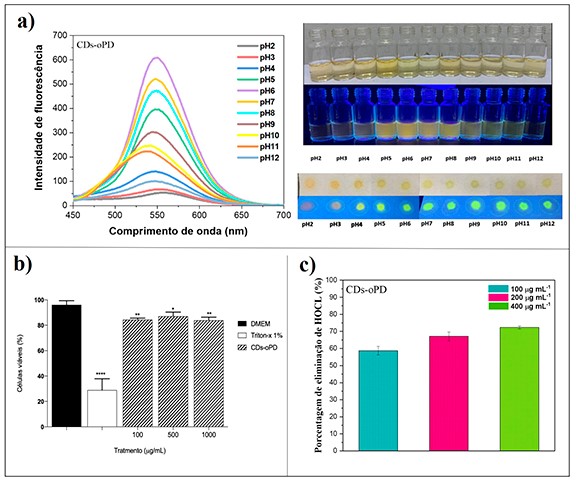
a) Fotoluminescência e fluorescência em solução e papel nos diferentes pH, b) viabilidade celular e c) porcentagem de eliminação de HOCl dos CDs-oPD
Conclusões
Os carbon dots obtidos a partir da o-fenilenodiamina (CDs-oPD) por método
hidrotermal apresentaram tamanho menor que 10 nm e grupos nitrogenados de
superfície, além de excelentes propriedades óticas com emissão em 547 nm. Os CDs
estudados se mostraram viáveis em células de fibroblastos não tumorais de pele
humana (HFF-1), exibindo boa viabilidade celular até concentrações de 1000 µg/mL.
Os diferentes pH (2 a 12) alteraram a intensidade de fluorescência dos CDs-oPD, o
qual exibiu faixa linear do pH 6 – 12. Por fim, esse estudo é de grande
relevância, pois proporciona um método simples para produção de CDs com ótimas
possibilidades de aplicações na detecção de pH em sistemas biológicas e
ambientais, bem como sequestrador de espécies reativas de oxigênio importantes em
alguns processos específicos das áreas supracitadas.
Agradecimentos
Os autores agradecem ao apoio financeiro da CAPES, UFAL, CNPq e FAPEAL e ao
laboratório multiusuário de microscopia de alta resolução (LabMic/UFG)
Referências
Apak, R. et al. Methods to evaluate the scavenging activity of antioxidants toward reactive oxygen and nitrogen species (IUPAC Technical Report). Pure and Applied Chemistry vol. 94 (2022).
Davi, L. B. de O., Lima, D. J. da P. & Barbosa, C. D. do E. S. Síntese De Carbon Dots a Partir De Derivados De Anilina a Fim De Avaliar O Efeito Dos Substituintes Nas Propriedades Fotofísicas E Estruturais / Synthesis of Carbon Dots From Aniline Derivatives in Order To Evaluate the Effect of Substituents on Photophysical and Structural Properties. Brazilian J. Dev. 7, 2732–2743 (2021).
Ding, H. et al. Facile synthesis of red-emitting carbon dots from pulp-free lemon juice for bioimaging. J. Mater. Chem. B 5, 5272–5277 (2017).
Ding, H. et al. Surface states of carbon dots and their influences on luminescence. J. Appl. Phys. 127, (2020).
Ehtesabi, H., Hallaji, Z., Najafi Nobar, S. & Bagheri, Z. Carbon dots with pH-responsive fluorescence: a review on synthesis and cell biological applications. Microchim. Acta 187, (2020).
Huangfu, S. et al. The use of crude carbon dots as novel antioxidants for natural rubber. Polym. Degrad. Stab. 186, 109506 (2021).
Liu, C., Zhang, F., Hu, J., Gao, W. & Zhang, M. A Mini Review on pH-Sensitive Photoluminescence in Carbon Nanodots. Front. Chem. 8, 1–9 (2021).
Omidi, M., Yadegari, A. & Tayebi, L. Wound dressing application of pH-sensitive carbon dots/chitosan hydrogel. RSC Adv. 7, 10638–10649 (2017).
Reckmeier, C. J., Schneider, J., Susha, A. S. & Rogach, A. L. Luminescent colloidal carbon dots: optical properties and effects of doping [Invited]. Opt. Express 24, A312 (2016).
Roy, S., Ezati, P., Rhim, J. W. & Molaei, R. Preparation of turmeric-derived sulfur-functionalized carbon dots: antibacterial and antioxidant activity. J. Mater. Sci. 57, 2941–2952 (2022).
Shen, J., Shang, S., Chen, X., Wang, D. & Cai, Y. Highly fluorescent N, S-co-doped carbon dots and their potential applications as antioxidants and sensitive probes for Cr (VI) detection. Sensors Actuators, B Chem. 248, 92–100 (2017).
Tuerhong, M., XU, Y. & YIN, X. B. Review on Carbon Dots and Their Applications. Chinese J. Anal. Chem. 45, 139–150 (2017).
Vale, N. et al. Normal breast epithelial MCF-10A cells to evaluate the safety of carbon dots. RSC Med. Chem. 12, 245–253 (2021).
Yan, F. et al. The fluorescence mechanism of carbon dots, and methods for tuning their emission color: a review. Microchim. Acta 186, (2019).
Yang, P. et al. Orange-Emissive Carbon Quantum Dots: Toward Application in Wound pH Monitoring Based on Colorimetric and Fluorescent Changing. Small 15, 1–11 (2019).
Zhao, Q., Song, W., Zhao, B. & Yang, B. Spectroscopic studies of the optical properties of carbon dots: Recent advances and future prospects. Mater. Chem. Front. 4, 472–488 (2020).
















