Autores
Pereira, C.E.B. (UFPE) ; Moreno, Y.P.M. (UFPE) ; Bonilla, H.M.S.A. (UFPE) ; Ojaimi, B.S. (UFPE) ; Correia de Melo, J. (CETENE) ; Galembeck, A. (UFPE)
Resumo
O presente estudo teve o intuito de incorporar os macronutrientes (N, P e K) em
nanomateriais para que aumentassem a eficiência da absorção de nutrientes pelas
plantas. Os nutrientes foram incorporados em nanopartículas de sílica e
quitosana e administrados em mudas de cana-de-açúcar. Foram realizadas
biometrias nas plantas que envolveram os seguintes parâmetros: altura, diâmetro
do colmo e teor de clorofila. A incorporação dos macronutrientes foi verificada
pelo método Kjeldahl e pelo ICP-OES; partes das plantas foram analisadas por
microscopia eletrônica de varredura (MEV). O estudo indicou que os
nanofertilizantes à base de sílica e quitosana proporcionaram uma melhoria na
absorção e eficiência de NPK pelas plantas, mesmo contendo uma menor quantidade
de nutrientes em sua formulação.
Palavras chaves
Nanofertilizantes; Biodisponibilização; Nutrientes
Introdução
Os fertilizantes provêm os nutrientes necessários para o aumento da
produtividade e crescimento das plantas (KHAN et al., 2018; PIRZADAH, B. et
al., 2020). Esses agroquímicos contêm os macronutrientes fundamentais para o
desenvolvimento adequado das plantas, sendo o nitrogênio (N), fósforo (P) e
potássio (K) os principais (ZEWDIE; RETA, 2021). De acordo com Kerbauy (2004), o
nitrogênio (N) é um elemento estrutural, visto que faz parte da estrutura de
proteínas e outros compostos orgânicos da célula vegetal, além de ser um
elemento regulatório nas reações de síntese. Quando não há um suprimento
adequado de nitrogênio, o crescimento da planta é retardado e este nutriente é
mobilizado das folhas mais velhas para as áreas de novo crescimento. O excesso
de N é uma das principais causas de baixa qualidade na cultura, pois promove um
crescimento vegetativo exagerado que provoca o acúmulo de açúcar nos vacúolos
(CARNAÚBA, 1990). O fósforo (P) é um elemento regulador de diversas vias
sintéticas, além de participar na otimização da absorção e utilização da água
pela planta (KORNDORFER, 2005), atua como elemento estrutural dos ácidos
nucleicos (DNA e RNA), é responsável por uma porcentagem significativa da
sacarose contida no caldo da cana-de-açúcar e a sua deficiência pode levar à
diminuição na formação dessa molécula e consequentemente interferir na qualidade
final da cana (BASTOS et al., 2008). Nas plantas, o cátion K+ é o mais abundante
no citoplasma e apresenta funções essenciais na planta, como no movimento dos
estômatos, fotossíntese e transporte de assimilados, além de possuir um
potencial hídrico. Plantas com um suprimento satisfatório de K são mais capazes
de resistir ao frio e a fungos (KERBAUY, 2004). Orlando Filho e colaboradores
(1993) constataram que a deficiência de potássio provoca a diminuição no
diâmetro e altura dos colmos. Contudo, esses nutrientes presentes nos
fertilizantes não conseguem chegar até a planta devido a fatores químicos e
físicos, tais como: a volatilização, que transforma o fertilizante em gás e a
lixiviação, ou seja, o carreamento do produto pela água (EMBRAPA, 2016). De
acordo com Solanki e colaboradores (2015), 40-70% do nitrogênio, 80-90% do
fósforo e 50-90% do potássio não chegam até a planta. Com o intuito de prevenir
o desperdício de nutrientes provocado pela aplicação dos fertilizantes, é
necessário recorrer a novas nanotecnologias com o intuito de diminuir os
impactos ambientais, minimizar a quantidade de nutrientes utilizados e ainda
assim, aumentar a sua eficácia (ZHAO et al., 2020). Dessa forma, os nutrientes
estão sendo encapsulados ou revestidos com nanomateriais em forma de
nanofertilizantes de liberação controlada, que são capazes de aumentar a
produtividade e crescimento da planta, assim como evitar possíveis patogenias
(PIRZADAH et al., 2020). Adicionalmente, nanofertilizantes são utilizados em
diversas culturas, como soja, pepino, morango, cana-de-açúcar, entre outros e
implicam no aumento da biomassa, crescimento das plantas, aumento de nutrientes
como K, Ca, Mg, Fe, Mn e Si e um maior teor de clorofila (SHEYKHBAGLOU et al.,
2010; YOUSEFI; ESNA-ASHARI, 2017; ELSHEERY et al., 2020; LU et al., 2020). Os
nanofertilizantes podem ser revestidos com polímeros biodegradáveis, que são
ambientalmente amigáveis e não geram acumulação de resíduos sintéticos no solo
(ZHAO, 2010). Entre os polímeros biodegradáveis destacam-se a quitosana, o
amido, a lignina, a sílica entre outros (KASHYAP et al., 2015). A quitosana é um
material natural biodegradável, além de ser o segundo biopolímero mais abundante
da terra (KUBAVAT, 2020). Tem propriedades antifúngicas que evitam possíveis
patógenos (HASSAN et al., 2017), é utilizada para melhorar a estabilidade das
nanopartículas, incluindo as propriedades de barreira ao vapor de água (ZHAO,
2010). Esse polímero tem sido explorado para encapsular fertilizantes compostos
de ureia, NPK, potássio e outros (JAMNONGKAN et al., 2010). A sílica é um
material abundante e inorgânico, que tem mostrado alto potencial em aumentar a
produtividade da planta ao melhorar a capacidade fotossintética, retardar o
envelhecimento e aumentar a resistência contra estresses bióticos e abióticos
(DESHMUKH et al., 2017; MANIVANNAN; AHN, 2017). A estrutura porosa da
nanopartícula de sílica possui centenas de canais vazios (mesoporos) que podem
ser preenchidos com uma grande quantidade de nutrientes (WANYIKA, 2012). Neste
contexto, estes materiais se destacam por serem acessíveis e por proporcionarem
diversos benefícios às plantas. O presente estudo, portanto, teve o intuito de
incorporar os macronutrientes (N, P e K) em nanomateriais à base de sílica e
quitosana para que atuem como estruturas carreadoras, utilizando uma menor
quantidade de nutrientes, à medida que diminuem os impactos ambientais que os
fertilizantes convencionais geralmente causam.
Material e métodos
As nanopartículas de sílica e de quitosana foram sintetizadas no Laboratório de
Compostos Híbridos e Colóides (Departamento de Química Fundamental da UFPE). As
nanosílicas foram preparadas pela hidrólise de tetraetilortoxisilicato (TEOS) e
3-aminopropil trietoxisilano (APTES) utilizando o processo semi-batelada de uma
etapa a partir do método sol-gel (STÖBER, 1968). A síntese das nanopartículas de
quitosana (Q) baseou-se na interação eletrostática da quitosana com eletrólitos
de íons opostos do tripolifosfato de sódio (TPP) (NASKAR et al., 2019). Na etapa
de incorporação dos macronutrientes nas nanopartículas, foram utilizados alguns
precursores em concentrações distintas, como NaHPO4.2H2O, KNO3 e CH4N2O. Para
incorporar os macronutrientes nos nanomateriais, os precursores foram
previamente misturados em água por 30 min e adicionados nas soluções de TEOS e
de TPP para a síntese de nanosílicas e nanopartículas de quitosana,
respectivamente. Nanopartículas sem nutrientes também foram utilizadas para fins
comparativos. Diversas concentrações de nanofertilizantes foram testadas em 15
plantas por tratamento. As amostras com o código “Si” correspondem aos
tratamentos com nanopartículas de sílica e as amostras com o código “Q”
correspondem aos tratamentos com nanopartículas de quitosana. O código MSIII/Q
representa o tratamento com a combinação de nanosílicas e nanoquitosanas. Já o
código Controle diz respeito ao tratamento com o fertilizante comercial. Durante
8 meses, foram realizadas biometrias nas plantas que envolveram os seguintes
parâmetros: altura, teor de clorofila A e B e diâmetro do colmo. Os
nanomateriais foram avaliados em testes biológicos utilizando mudas de cana-de-
açúcar (Saccharum officinarum) da variedade RB002754 da Biofábrica Governador
Miguel Arraes no Centro de Tecnologias Estratégicas do Nordeste-CETENE (PE).
Para a avaliação morfológica, a altura das plantas foi medida com uma trena,
desde a base da planta até o seu ápice, o diâmetro do colmo foi medido com o
auxílio de um paquímetro digital em três partes da planta (base, meio e ápice) e
para a análise do teor de clorofila A e B, foi utilizado um clorofilômetro
ClorofiLOG Falker® e vários pontos da folha foram explorados. Para avaliar se as
nanopartículas eram capazes de entrar pelo ostíolo por aplicação foliar dos
nanofertilizantes, algumas amostras das folhas da cana-de-açúcar foram
submetidas ao microscópio eletrônico de varredura (MEV) e imagens em diferentes
magnificações foram obtidas. As plantas já desenvolvidas foram secas e
trituradas em um moinho de facas para dar início aos processos do método
Kjeldahl para a determinação de N (GALVANI; GAERTNER, 2006) e ICP-OES para
quantificação de P e K. As concentrações foram definidas após um estudo
sistemático, porém, por sigilo de propriedade intelectual, detalhes da
concentração dos macronutrientes não serão expostas neste trabalho.
Resultado e discussão
QUANTIFICAÇÃO DOS NUTRIENTES: Neste trabalho, a determinação de nitrogênio total
(NT) pelo método Kjeldahl indicou que o teor deste nutriente presente nas
plantas variou entre 1,98 e 2,17%, enquanto o tratamento controle apresentou
1,88%, ou seja, foi inferior às plantas tratadas com nanofertilizantes. Os
tratamentos Si 4KPN, Q 4KPN e MSIII/Q apresentaram 2,17, 2,01 e 1,98 % de N,
isto é, foram 15,4%, 6,9% e 5,3% melhores que as plantas tratadas com o
fertilizante convencional. Os resultados de nitrogênio obtidos com os
nanofertilizantes estão de acordo com o que há na literatura acerca do teor
ideal de nitrogênio para a qualidade de cana-de-açúcar utilizada neste estudo,
que é de 1,9-2,5% (MALAVOLTA et al., 2017). Experimentalmente, Delgadillo et al.
(2016), utilizaram um nanofertilizante com ureia revestido com
quitosana e ácido metacrílico para o cultivo de alface e observaram que as
plantas apresentaram teores de N maiores que o controle. Adicionalmente, a
aplicação de 10 a 20 ppm de FLC à base de quitosana na cultura de café, permitiu
que a absorção deste nutriente aumentasse de 9,8 para 27,4% (VAN et al., 2013).
É importante ressaltar a importância da absorção eficaz de nitrogênio para a
cultura de cana-de-açúcar, visto que é o nutriente mais limitante em relação ao
perfilhamento, crescimento e desenvolvimento da planta (BOSCHIERO et al., 2020).
Da mesma forma que o N é importante, o P e K também são vitais para a planta.
Além de que, a depender do aproveitamento de outros nutrientes, pode haver uma
interferência na absorção dos demais (SANTOS, 2019); inclusive, Rufty et al.
(1993) relatam que a deficiência de fósforo na cultura de soja é capaz de
interferir de maneira significativa na assimilação de N pela planta. Para
garantir a aplicação apropriada desses macronutrientes, foram exploradas
concentrações distintas de fósforo e potássio e os resultados dos tratamentos
variaram entre 0,247 e 0,254% para P e 0,160 e 0,166% para K. Em relação ao
fósforo, os melhores resultados foram os tratamentos Si AF (0,254%), Si 4KPN
(0,253%) e Q 4KPN (0,247%), enquanto as plantas tratadas com o fertilizante
comercial apresentaram 0,250%. O percentual de K do tratamento com o
fertilizante comercial (controle) foi de 0,174%, em contrapartida, os melhores
tratamentos com os nanofertilizantes foram o Q MSI (0,166 %), Si 4KPN (0,162%) e
MSIII/Q (0,160%). Apesar de nem todos os tratamentos (P e K) terem sido
numericamente melhores em relação ao controle, vale ressaltar que os
nanofertilizantes continham o mínimo possível de nutrientes em sua formulação, e
ainda assim, os resultados foram semelhantes ou até mesmo melhores que aqueles
das plantas tratadas com uma alta quantidade de nutrientes. BIOMETRIA: Os
resultados a seguir correspondem a 180 dias de tratamento e 9 biometrias. O
gráfico da Figura 1 (A) mostra os resultados das alturas das plantas sob
tratamento de nanofertilizantes e o fertilizante convencional (controle). O
tratamento Si MSI apresentou um resultado satisfatório, visto que cresceu cerca
de 80 cm em apenas 40 dias, ao final do experimento, atingiu 131 cm. O
tratamento Si MSIII/Q cresceu 137 cm durante o período de desenvolvimento, e o
tratamento com a nanosílica Si CTAB cresceu 134 cm. Em contrapartida, as plantas
tratadas com o fertilizante comercial cresceram 133 cm, ou seja, menor que os
tratamentos com os nanofertilizantes. Estes resultados divergem daqueles
encontrados por Alimohammadi et al. (2020), visto que ao utilizarem
fertilizantes à base de ureia e nanofertilizantes de N, a altura das plantas de
ambos os tratamentos aumentou concomitantemente ao aumento do teor de
nutrientes, em outros termos, não houve uma diferença significativa entre os
dois tipos de fertilizantes. A Figura 1 (B) compara a variação do diâmetro do
colmo das plantas sob os tratamentos dos nanomateriais Si CTAB, Si MSIII, Q
1KPN, que apresentaram os melhores resultados nessa variável com os respectivos
valores de: 15,51, 15,19, 14,67 cm de diâmetro final; já as plantas tratadas com
o fertilizante comercial apresentaram 13,89 cm. Sendo os valores iniciais de
5,89, 5,09, 5,51 e 4,27 cm. Ou seja, os tratamentos aumentaram o tamanho do
diâmetro do colmo em 9,62, 10,1, 10,4 e 9,55 cm respectivamente após 180 dias
sob tratamento. Estes valores diferem daqueles apontados por Shao et al. (2010),
que aplicaram nanofertilizantes à base de N e K para o plantio de macieiras, e
tanto a altura, quanto o diâmetro do colmo não apresentaram diferença
significativa, enquanto os colmos das plantas submetidas ao fertilizante
comercial foram mais altos e espessos. Outra variável utilizada na biometria foi
o teor de clorofila (A e B). Um aumento de teor de clorofila com o tempo é
associado a uma maior atividade fotossintética da planta para maior conversão de
energia luminosa em ATP, consequência do desenvolvimento fisiológico da mesma
(MESA, 2018). Usualmente, o índice de clorofila A é maior que o índice de
clorofila B, isso se deve a que a clorofila A é a principal, ou seja, a
responsável pela fotossíntese, já a clorofila B funciona como um pigmento
acessório para impulsionar a captação de luz (STREIT et al., 2005). Na Figura 1
(C e D), é possível perceber que houve uma variação do teor de clorofila A e B
entre as biometrias, ou seja, não houve um aumento constante nos valores e
variou cerca de 5 ICFs em ambos os teores de clorofila a cada biometria
realizada, isso se deve à forma em que a medida era feita e a situação do limbo
foliar; um limbo foliar não muito verde, de fato não apresentará um índice de
clorofila alto. Outros fatores que podem ter influenciado na variação da
clorofila, em alguns momentos, as plantas sofreram estresse quando foram
transladas dos tubetes às sacolas de 2 kG e depois aos potes de 5 kG de acordo
com o seu desenvolvimento. Nos tratamentos com nanofertilizantes, o teor de
clorofila A variou entre 30,2-39,8 ICFs (Si AF), 27,6-40,7 ICFs (Q MSI),
30,1-37,2 ICFs (Q 1KPN) e no tratamento controle, entre 27,7 e 39,3 ICFs. Em
suma, o tratamento à base de quitosana Q MSI apresentou um maior valor no teor
de clorofila A, e foi 3,4% melhor que o controle. A clorofila B geralmente
apresenta resultados menores em relação à clorofila A, então as plantas tratadas
com os nanofertilizantes Si AF, Q MSI e Q 1KPN variaram entre 6,5-14,5 ICFs,
5,7-
10,1 ICFs e 6,5-10 ICFs, respectivamente. Enquanto o controle variou entre
6,8-12,4 ICFs. O tratamento Si AF obteve o maior resultado de clorofila B e
foi 17,4% melhor que o controle. MICROSCOPIA ELETRÔNICA DE VARREDURA: Estudos
recentes indicam que estômatos e tricomas atuam ativamente no processo de
absorção foliar de nutrientes (FERNANDEZ et al., 2021; OTTO et al., 2021). Para
obter informações topográficas da superfície da epiderme vegetal e visualizar se
as nanopartículas eram capazes de entrar pelo ostíolo, algumas imagens com
magnificações distintas foram obtidas pelo MEV. Na Figura 2(A), pode ser
observado um aglomerado de nanopartículas que se acumulam naturalmente ao longo
da aplicação dos nanofertilizantes; já a Figura 2(B) mostra a borda do ostíolo,
que tem cerca de 1.493 nm, além de um aglomerado de nanopartículas com o raio de
146 nm. Estas imagens revelam que mesmo as nanopartículas aglomeradas, elas são
quase 1000% menores que o ostíolo. Na Figura 2 (C) as nanopartículas estão
circuladas e apontadas com setas amarelas, o raio médio das quatro
nanopartículas é de 30,73 nanômetros. Já a Figura 2 (D) dá indícios da entrada
dessas nanoestruturas no interior dos estômatos, o que facilita a absorção dos
nutrientes pela superfície foliar.
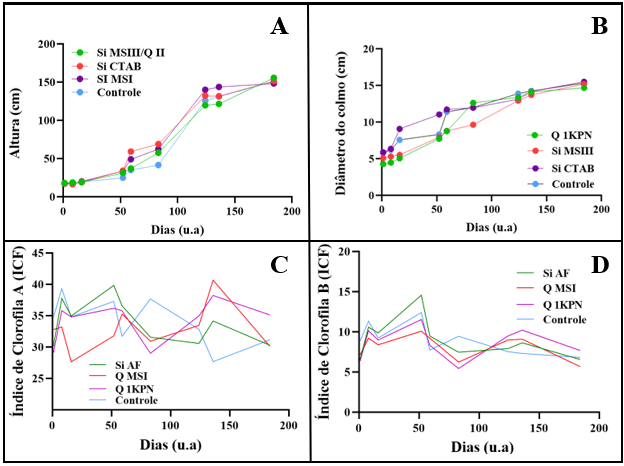
(A) Altura das plantas; (B) Diâmetro do colmo em função do tempo; (C) Variação no índice de clorofila A; (D) Variação no índice de clorofila B.
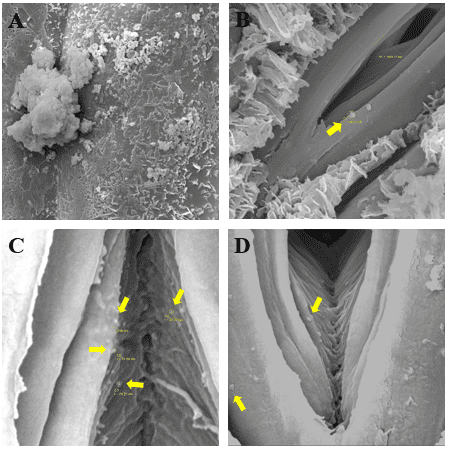
(A) Nanopartículas aglomeradas; (B) Nanopartículas na borda do ostíolo; (C e D) Nanopartículas no interior do estômato.
Conclusões
Este trabalho buscou alcançar uma maior absorção de nutrientes e consequentemente,
um maior
crescimento das plantas, utilizando o mínimo de NPK. As plantas de cana-
de-açúcar da variedade RB002754 apresentaram resultados satisfatórios nas
variáveis altura e diâmetro do colmo em comparação com o fertilizante comercial.
Possíveis estresses podem ter levado à uma variação do teor de clorofila em todas
as plantas, mas isto não indica que houve uma diminuição na produção deste
pigmento. O aumento do teor dos nutrientes N, P e K mediante a aplicação foliar
dos nanofertilizantes sugere que as NPs entregaram os macronutrientes de forma
eficiente, e que foram absorvidos e translocados pela planta. Assim como a raiz,
as folhas também atuam na nutrição mineral, isto é, são capazes de absorver
nutrientes pelos estômatos. As imagens obtidas pela microscopia eletrônica de
varredura comprovam o quanto as nanopartículas têm acesso para adentrar o ostíolo
para melhorar o desenvolvimento da planta. O estudo indicou que os
nanofertilizantes à base de sílica e quitosana proporcionaram uma melhoria na
absorção e eficiência de NPK pelas plantas, mesmo contendo uma menor quantidade de
nutrientes em sua formulação. Maiores estudos são necessários para avaliar o
desempenho destas nanoformulações em outras culturas para que o Brasil não dependa
fortemente da importação exacerbada de fertilizantes convencionais que são
desperdiçados e provocam grandes impactos ambientais.
Agradecimentos
Universidade Federal de Pernambuco (UFPE), Conselho Nacional de Desenvolvimento
Científico e Tecnológico (CNPq), Fundação de Amparo à Ciência e Tecnologia do
Estado de Pernambuco (FACEPE).
Referências
ALIMOHAMMADI, M; PANAHPOOR; NASERI, A. Assessing the effects of urea and nano-nitrogen chelate fertilizers on sugarcane yield and dynamic of nitrate in soil. Soil Science and Plant Nutrition, v. 66, p. 1-8, 2020.
BASTOS, A. L.; COSTA, J. P. V.; SILVA, I. F.; RAPOSO, R. W. C.; SOUTO, J. S. Influência de doses de fósforo no fluxo difusivo em solos de Alagoas. Revista Brasileira de Engenharia Agrícola e Ambiental, v. 12, 136-142, 2008.
BOSCHIERO, B.N; MARIANO, E.; DORANTE, L. O. T.; SATTOLO, T. M. S.; OTTO, R.; GARCIA, P. L.; DIAS, C. T. S.; TRIVELIN, P. C. O. Nitrogen fertilizer effects on sugarcane growth, nutritional status, and productivity in tropical acid soils. Nutrient Cycling Agroecosystems, v. 117, p. 367–382, 2020.
CARNAÚBA, B. A. A. O nitrogênio e a cana-de-açúcar. STAB- Açúcar, álcool e subprodutos, v. 8, p. 24-41, 1990.
DELGADILLO, A. L.; GONZÁLEX, R. C.; MARTÍNEZ, E. S. M.; FONSECA, M. R.; CHACÓN, A. Nanocapsules of urea in chitosan and polymethacrylic acid and their application to hydroponic culture of lettuce (Lactuca sativa L). Revista Mexicana de Ingeniería Química, v. 15, p. 423-431, 2016.
DESHMUKH, R. K.; MA, J. F.; BÉLANGER, R. R. Editorial: Role of Silicon in Plants. Frontiers in Plant Science, v. 8, 2017.
ELSHEERY, N.I.; SUNOK, V. S. J.; WEN, Y.; ZHU, J. J.; MURALIDHARAN, G.; CAO, K. F. Foliar application of nanoparticles mitigates the chilling effect on photosynthesis and photoprotection in sugarcane. Plant Physiology and Biochemistry, v. 149, p. 50-60, 2020.
EMBRAPA. (2016). "Fertilizante inteligente gera economia e minimiza impacto ambiental." 2020.
FERNÁNDEZ, V., GIL-PELEGRÍN, E.; EICHERT, T. Foliar water and solute absorption: an update. The Plant Journal, v, 28, p. 36-68, 2021.
GALVANI, F.; GAERTNER, E. Adequação da metodologia Kjeldahl para
determinação de nitrogênio total e proteína bruta. Circular Técnica, Nº63.
Corumbá: Embrapa Pantanal, p. 9, 2006.
HASSAN, O.; CHANG, T. Chitosan for Eco-friendly Control of Plant Disease. Asian Journal of Plant Pathology, v. 11, p. 53-70, 2017.
JAMNONGKAN, T; KAEWPIROM, S. Potassium Release Kinetics and Water Retention of Controlled-Release Fertilizers Based on Chitosan Hydrogels. Journal of Polymers and the Environment, v. 18, p. 413-421, 2010.
KASHYAP, P. L.; XIANG, X.; HEIDEN, P. Chitosan nanoparticle-based delivery systems for sustainable agriculture. International Journal of Biological Macromolecules, v. 77, p. 36-51, 2015.
KERBAUY, G.B. Fisiologia vegetal. Guanabara Koogan, Rio de Janeiro, 2004.
KHAN, M. N.; MOBIN, M.; ABBAS, Z. K. Fertilizers and Their Contaminants in Soils, Surface and Groundwater. Reference Module in Earth Systems and Environmental Sciences, v. 5, p. 225-240, 2018.
KORNDÖRFER, G. H.; OLIVEIRA, L. A. O potássio na cultura da cana-de-açúcar. In: YAMADA, T.; ROBERTS, T. L. (Eds.). Potássio na agricultura brasileira. Piracicaba: ESALQ/USP, p. 469-490, 2005.
KUBAVAT, D.; TRIVEDI, K.; VAGHELA, P.; PRASAD, K.; ANAND, G. K. V.; TRIVEDI, H.; PATIDAR, R.; CHAUDHARI, J.; ANDHARIYA, B.; GHOSH, A. Characterization of a chitosan‐based sustained release nanofertilizer formulation used as a soil conditioner while simultaneously improving biomass production of Zea mays L. Land Degradation & Development, v. 31, p. 2734– 2746, 2020.
LU, L.; HUANG, M.; HUAN, Y.; CORVINI, P. F. X.; JI, R.; ZHAO, L. Mn3O4 nanozymes boost endogenous antioxidant metabolites in cucumber (Cucumis sativus) plant and enhance resistance to salinity stress. Environmental Science: Nano Journal, v. 7, p. 1692-1703, 2020.
MALAVOLTA, E.; VITTI, G. C; OLIVEIRA, S. A. Avaliação do estado nutricional das plantas: princípios e aplicações. 2.ed, 319p, 1997.
MANIVANNAN, A.; AHN, Y.-K. Silicon Regulates Potential Genes Involved in Major Physiological Processes in Plants to Combat Stress. Frontiers in Plant Science, v. 8, 2017.
MESA, N. F. O. Avaliação do teor de clorofila em mudas de cana-de-açúcar por meio de imagens espectrais. 2018. 144 p. Dissertação (mestrado) - Universidade Estadual de Campinas, Faculdade de Engenharia Agrícola, Campinas, SP, 2018.
NASKAR, S.; SHARMA, S.; KUOTSU, K. Chitosan-based nanoparticles: An overview of biomedical applications and its preparation. Journal of Drug Delivery Science and Technology, v. 49, p. 66-81, 2019.
ORLANDO FILHO, J.; RODELLA, A. A.; BELTRAME, J. A.; LAVORENTI, N. A. Fontes de potássio na adubação da cana-de-açúcar: KCl e K2SO4 STAB. Açúcar, Álcool e Subprodutos, v. 11, p. 39-41, 1993.
OTTO, R., MARQUES, J. P. R.; PEREIRA, H. W. C. Strategies for probing absorption and translocation of foliar-applied nutrients. Journal of experimental botany, v. 72, 4600–4603, 2021.
PIRZADAH, B.; PIRZADAH, T. B.; JAN, A.; HAKEEM, K. R. Nanofertilizers: A Way Forward for Green Economy. Nanotechnology in the Life Sciences,v.1, p. 99–112, 2020.
RUFTY, T. W.; ISRAEL, D. W.; VOLK, R. J.; QIU, J.; SA, T. Phosphate regulation of nitrate assimilation in soybean. Journal of Experimental Botany, v. 44, p. 879-891, 1993.
SANTOS, R. B. Estudo do comportamento difusional de nutrientes em filmes de revestimento poliméricos: compreensão de processos de liberação controlada de fertilizantes. São Carlos, 2019, 121f. Tese (doutorado) – Programa de Pós-Graduação em Química Analítica e Inorgânica. Instituto de Química de São Carlos. Universidade de São Paulo, 2019.
SHAO, L; WANG, L. X; ZHANG, M; SUN, Z. J. Effects of controlled-release N and K fertilizers on N, P, and K use efficiency of mauls (Malus robusta). Chinese Journal of Applied Ecology, v. 21, p. 2309–2316, 2010.
SHEYKHBAGLOU, R.; SEDGHI, M.; SHISHEVAN, M. T.; SHARIFI, R. S. Effects of Nano-Iron Oxide Particles on Agronomic Traits of Soybean. Science Biology, v. 2, p. 112-113, 2010.
SOLANKI, P.; BHARGAVA, A.; CHHIPA, H.; JAIN, N.; PANWAR, J. Nano-fertilizers and Their Smart Delivery System. Nanotechnologies in Food and Agriculture, v. 1, p. 81–101, 2015.
STOBER, W., FINK, A.; BOHN, E. Controlled Growth of Monodisperse Silica Spheres in the Micron Size Range. Journal of Colloid and Interface Science, v. 26, p. 62-69, 1968.
STREIT, N. M.; CANTERLE, L. P.; CANTO, M. W.; HECKTHEUER, L. H. H. As clorofilas. Ciência Rural, v. 35, p. 748-755, 2005.
VAN, S. N.; MINH, H. D.; ANH, D. N. Study on chitosan nanoparticles on biophysical characteristics and growth of Robusta coffee in green house.
Biocatalysis and Agricultural Biotechnology, v. 2, p. 289-294, 2013.
WANYIKA, H.; GATEBE, E.; KIONI, P.; TANG, Z.; GAO, Y. Mesoporous Silica Nanoparticles Carrier for Urea: Potential Applications in Agrochemical Delivery Systems. Journal of Nanoscience and nanotechnology, v. 12, p. 2221–2228, 2012.
YOUSEFI, R.; ESNA-ASHARI, M. The effect of micro-and nanoparticles of silicon on concentration of macro-and microelements and silicon content of strawberry plant in soilless culture conditions. Journal of Science and Technology of Greenhouse Culture, v. 8, p. 57-70, 2017.
ZEWDIE, I; RETA, Y. Review on the role of soil macronutrient (NPK) on the improvement and yield and quality of agronomic crops. Direct Research Journal of Agriculture and Food Science, v. 9, p. 7-11, 2021.
ZHAO, G.; LIU, Y. Q.; TIAN, Y.; SUN, Y.Y.; CAO, Y. Preparation and properties of macromolecular slow-release fertilizer containing nitrogen, phosphorus, and potassium. Journal of Polymer Research, v. 17, p. 119-125, 2010.
ZHAO, L.; LU, L.; WANG, A.; ZHANG, H.; HUANG, M.; WU, H.; XING, B.; WANG, Z.; JI, R. Nano-biotechnology in Agriculture: Use of Nanomaterials to Promote Plant Growth and Stress Tolerance. Journal of Agricultural and Food Chemistry, v. 68, p. 1935-1947, 2020.
















