Autores
Medeiros Barbosa, E. (UFAM) ; Ferreira Cruz, J. (UFAM) ; Soares Souza, K. (UFAM) ; Ramos da Encarnação, J. (UFAM) ; Martins da Silva, E. (UFAM) ; Armani Aguiar, F. (UFRJ) ; Wilmo da Cruz Jr., J. (UFAM) ; Almeida Rosa, E. (UFAM) ; Sousa Maia, P.J. (UFRJ)
Resumo
Este estudo descreve a síntese e as propriedades eletroquímicas e eletrônicas de
um novo complexo uranila do tipo salen. O voltamograma cíclico indica dois pares
redox reversíveis em 0,67/0,56 V (E1/2 = 0,62 V) e 0,83/0,73 V (E1/2 = 0,78 V) vs.
ERH. Seis catalisadores à base de PtSn foram produzidos ajustando a razão molar do
complexo PtSn:UO2. A varredura direta das amostras indicou que o densidade de
corrente de pico para o catalisador 6:1 PtSn/C:[UO2(3-OMe-t-salcn)H2O] foi
superior aos catalisadores mistos. Além disso, em comparação com o PtSn puro
catalisador, o catalisador 6:1 PtSn/C:[UO2(3-OMe-t-salcn)H2O] exibiu melhorias
atividade catalítica para eletrooxidação do etanol; ou seja, apresentou menor
início valores potenciais durante a oxidação do etanol.
Palavras chaves
Agenda 2030; Células a combustível; Compostos de coordenação
Introdução
Dentre as tecnologias de economia de energia disponíveis, as células a
combustível de etanol direto (DEFCs) têm sido consideradas uma fonte de energia
alternativa promissora devido à baixa emissão, baixo impacto ambiental e
conveniente operação. No entanto, se faz necessário desenvolver materiais anodos
eficientes na etapa da quebra da ligação C-C do etanol para gerar CO2 e H2O da
oxidação completa [1,2]. Entre estes podemos citar os complexos de uranila cujas
estruturas têm sido descritas como pentagonal-bipiramidais distorcidas, uma vez
que a base de Schiff tetradentado e um ligante monodentado ocupam os cinco
sítios de coordenação equatorial, sendo que este último, em geral, está
fracamente ligado ao centro metálico, podendo ser substituído pelo substrato na
catálise [3,5]. Até onde sabemos, nenhum trabalho trata de complexos de uranila
de base de Schiff usados diretamente como catalisador ou cocatalisador em
processos de oxidação do álcool, abrindo novos perspectivas em catálise e
eletrocatálise neste campo.
Material e métodos
O ligante foi preparado a partir da reação entre trans-1,2- diaminociclohexano
(4 mmol) e (50 mL) de 3-metoxissalicilaldeído (8 mmol) na temperatura de refluxo
em etanol (50 mL) por 3 horas. Para a síntese do complexo, uma solução aquosa
(25 mL) de UO2(OOCHCH3)•2H2O (0,5 mmol) e cinco gotas glaciais de ácido acético
foram adicionadas a um 3-OMe-t-salcn (0,5 mmol) (MeOH, 40 mL), e o sistema foi
mantido na temperatura de refluxo por 3 h. O volume foi reduzido para 5 mL e o
sistema foi mantido a 5°C por 30 minutos. Em seguida, foi resfriado a
temperatura ambiente, filtrado e seco à vácuo. Ambos compostos foram
caracterizados por análise de CHN, RMN, FTIR, UV-Vis e eletroquímica. PtSn/C
(40% em peso de metal, 3:1 razão atômica Pt:Sn) foi preparado usando o método
ácido fórmico. O complexo [UO2(3-OMe-t-salcn)H2O] foi disperso em uma dispersão
previamente preparada de PtSn/C e metanol e gradualmente adicionada à suspensão
de carbono Vulcan XC-72; a quantidade total utilizada foi de 2 mg para todos os
catalisadores. Então, PtSn/C:[UO2(3-OMe-t-salcn)H2O] foi disperso em uma solução
contendo metanol (Vetec, UV/HPLC) e Nafion (Aldrich, p.a., 5,5% v/v). A tinta
resultante foi homogeneizado em ultra-som por 10 minutos. Depois disso, 50 mL
foi transferido para a superfície de um disco de ouro polido para avaliar sua
propriedades eletroquímicas. Os eletrodos foram obtidos variando a razão mássica
entre PtSn/C e complexo UO2(3-OMe-t-salcn)H2O]. A atividade eletrocatalítica foi
obtida a partir da voltametria cíclica (CV) e cronoamperometria em meio contendo
N2 e 0,5 mol•L−1 H2SO4 + 1,0 mol•L−1 solução de etanol usando uma célula de três
eletrodos com um contra-eletrodo de Pt e um eletrodo de hidrogênio reversível
como referência.
Resultado e discussão
O voltamograma do complexo apresentou dois pares reversíveis em 0,67/0,56 V
(E1/2 = 0,62 V) e 0,83/0,73 V (E1/2 = 0,78 V) vs. RHE atribuído a processos
ligantes, como duas oxidações sucessivas de fenolato a radicais fenoxil, sendo
que esses processos continuaram após 50 ciclos cíclicos consecutivos
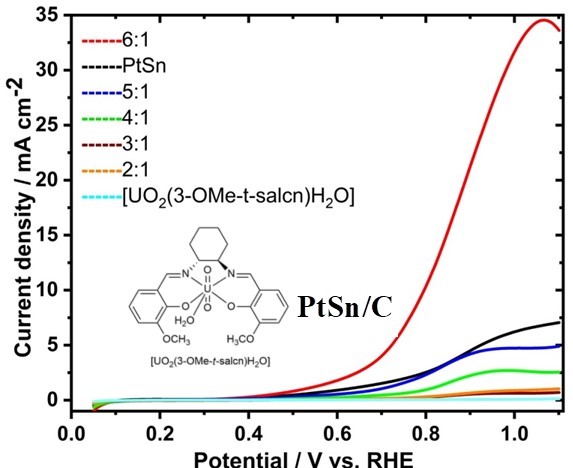
voltamogramas. A Figura 1 mostra a atividade catalítica dos eletrodos
modificados para a reação de eletrooxidação do etanol (REO), analisados em um
sistema eletroquímico com PtSn/C e PtSn/C:[UO2(3-OMe-t-salcn)H2O] em diferentes
proporções de massa: 6:1, 5:1, 4:1, 3:1 e 2:1. Para o catalisador 6:1 PtSn/C:
[UO2(3-OMe-t-salcn)H2O], a REO começou em 0,29 V, enquanto o potencial foi
deslocado positivamente para PtSn/C e 5:1, 4:1, 3:1 e 2:1 PtSn/C:[UO2(3-OMe-t-
salcn) H2O. Entre os catalisadores mistos, a corrente para 6:1 Pt/C:[UO2(3-OMe-
t-salcn)H2O] foi superior quando comparada a dos outros eletrocatalisadores
mistos sob investigação. A densidade de corrente de pico para 6:1 PtSn/C:[UO2(3-
OMe-t-salcn)H2O] foi 32,93 mA cm−2, ou seja, ~ 4,8 vezes, para o
eletrocatalisador PtSn/C, resultando em cinética de reação favorável para a REO.
O efeito da velocidade de varredura no comportamento voltamétrico do eletrodo
6:1 foi investigado em 0,5 mol L−1 solução de H2SO4. As densidades de corrente
de pico anódico (Jpa) aumentaram à medida que a taxa de varredura aumentou.
Jpa/Jpc vs. velocidade de varredura (v) não foi linear. Por outro lado, o
jpa/jpc vs. v1/2 teve uma correlação linear, com a equação Jpa/mA
cm−2=0,01451−0,0006 v1/2 (V s−1)1/2 com R2=0,9962 e e Jpc/mA cm−2 = − 0,01396 +
0,0005 v1/2 (V s−1)1/2 com R2 = 0,9948. Isso sugere um processo eletroquímico
controlado por difusão, indicando relativamente uma redução ou dificuldade na
difusão de íons H+ na superfície do eletrodo.
Conclusões
O composto de coordenação exibe baixo desempenho catalítico, mas quando associado
a catalisadores nanoparticulados, produz resultados satisfatórios. PtSn/C:[UO2(3-
OMe-t-salcn)H2O] em diferentes razões de massa foi usado para preparar eletrodos
modificados, onde foram avaliados como cocatalisadores na reação de oxidação do
etanol foram investigados em meio ácido (0,5 mol•L−1 H2SO4). Resultados
preliminares indicam que PtSn/C:[UO2(3-OMe-t-salcn)H2O] a 6:1 de massa proporção
melhora a atividade catalítica na eletrooxidação do etanol em comparação com
PtSn/C e [UO2(3-OMe-t-salcn)H2O].
Agradecimentos
PPGCTRA–UFAM, FAPEAM, FAPERJ (JCNE-2021, 27/2021-APQ1, 45/2021-APQ1, 05/2021-IC,
05/2022-IT, 06/2022-IC), CAPES and CNPq.
Referências
[1] Barbosa, E.M., Souza, K.S., de Oliveira, P.S. et al. Uranyl Salen-Type Complex as Co-catalyst for Electrocatalytic Oxidation of Ethanol. Electrocatalysis 13, 91–100 (2022). https://doi.org/10.1007/s12678-021-00697-0
[2] M.F.M. Ribeiro, E.N. Oiye, J.M.T. Katayama, J.W.C. Junior, E.R.
Dockal, M. Firmino de Oliveira, Brazilian J. Forensic Sci. Med.
Law Bioeth. 9, 440 (2020)
[3]. X. Liu, C. Manzur, N. Novoa, S. Celedón, D. Carrillo, J.R.
Hamon, Coord. Chem. Rev. 357, 144 (2018)
[4] P.J.S. Maia, J.F. Cruz, F.A. de Freitas, S. de Fátima Freire
dos Santos, and E. A. de Souza, Res. Chem. Intermed. 45, 5451
(2019)
[5] S.Y. Ebrahimipour, I. Sheikhshoaie, J. Castro, M. Dušek, Z.
Tohidiyan, V. Eigner, M. Khaleghi, RSC Adv. 5, 95104 (2015)
















