Autores
Marinho, T.C. (IPEN) ; Carvalho, E.F.U. (IPEN) ; Fernandes, V.C. (DQ-UFBA) ; Santiago, E.I. (IPEN)
Resumo
O iodo-131 é um radiofármaco emissor de partícula β-, utilizado no
tratamento do câncer de tireóide. Os
processos de produção do iodo-131 via fissão de urânio-235 ou irradiação de
alvos de telúrio, resultam em soluções
compostas por diferentes metais, como molibdênio (Mo), telúrio (Te) e rutênio
(Ru). O objetivo deste trabalho foi empregar
rotas eletroquímicas baseadas na mudança de temperatura e aplicação de potencial
para separação de iodo. Inicialmente Mo,
Te e Ru foram analisados quanto à sua interferência no processo de separação e o
iodo quanto ao potencial em que a reação
se processa com maior velocidade. Em seguida, o iodo foi separado, capturado e
testado qualitativamente. Os testes
indicaram boa captura em 25° C e 40 °C e pouca captura em 60 °C.
Palavras chaves
separação eletroquímica; iodo-131; radiofármaco
Introdução
O câncer de tireóide é um tipo de câncer bastante comum, que ocupa a nona
posição no mundo, equivalendo a cerca de 3% de todos os
cânceres estimados. Esta doença afeta em maior grau o sexo feminino, e estima-se
que entre 2020 e 2022 haja cerca de 1,72 casos novos
para cada 100 mil homens e 11,15 casos novos para cada 100 mil mulheres
(INSTITUTO NACIONAL DO CÂNCER JOSÉ ALENCAR GOMES DA SILVA,
2019). Para o tratamento do câncer de tireóide, além da cirurgia para remoção
total ou parcial da glândula, o radiofármaco
131I é utilizado como terapia complementar com o objetivo de destruir
focos microscópicos do tumor (AMERICAN CANCER
SOCIETY, 2019; INSTITUTO NACIONAL DE CÂNCER, 2022).Os radiofármacos são
medicamentos radioativos utilizados pela medicina nuclear
para fins de diagnóstico e terapia de doenças. Em diagnósticos são utilizados
elementos como iodo-123, molibdênio-99 e flúor-18, que
têm como característica principal a emissão de radiação eletromagnética
penetrante, como raios gama, que atravessam os tecidos
corporais e, ao decaírem, permitem sua detecção externa. Por outro lado, radio-
223 e iodo-131 são utilizados em terapias, que por
terem alto poder ionizante, tendem a danificar as células tumorais combatendo o
câncer (INSTITUTO DE PESQUISAS ENERGÉTICAS E
NUCLEARES, 2016).O iodo-131 é um radiofármaco com meia-vida de 8,025 dias, que
decai para o composto estável xenônio-131 (99%), e
xenônio-131m (1%) não-estavel (meia-vida de 11,8 dias), emitindo partículas beta
(β-), de alto poder ionizante e curto alcance, com
energia média de 182 keV, além de emitir raios gama com diferentes valores de
energia. Por esta razão é um radiofármaco de grande
importância capaz de auxiliar no tratamento do câncer de tireóide, gerar imagens
para o tratamento de neuroblastoma, por exemplo e
servir como marcador radioativo (MUSHTAQ, A. et al., 2013).A produção de
131I se dá por meio de reação de fissão de
235U ou, ainda, através da irradiação de alvos de telúrio.
Considerando a necessidade de se obter o radiofármaco com
elevada pureza para sua utilização, diversas técnicas, que possibilitam a
separação do iodo de alguns interferentes comuns como o
99Mo, também utilizado como radiofármaco, o 103Ru, e o
130Te proveniente da irradiação de
TeO2, são empregadas (MUSHTAQ, A. et al., 2013). Damasceno (2019)
avaliou rotas de purificação de iodo-131 e molibdênio-99
utilizando como ponto de partida uma coluna de resina aniônica Dowex 1x8 para
separação, seguida por demais técnicas como
precipitação seletiva, destilação e extração por solvente para
purificação. Wilkinson, M. V.; Mondino, A. V.; Manzini, A. C (2002)
realizou a separação de iodo proveniente da dissolução de alvos de urânio em
meio básico utilizando coluna de alumina com prata e
obteve bons resultados na retenção e eluição de iodo obtendo rendimento de 85 a
90%. Bignardi (2013) utilizou diversos tipos de
materiais para captura e separação de iodo-131 proveniente do processo de
produção de molibdênio-99 pela rota de dissolução ácida do urânio-
235. A separação baseou-se na utilização de colunas de alumina com cobre,
alumina ácida com cobre, carvão ativado, cartuchos
aniônicos, resina aniônica, microesferas de prata e, ainda, microesferas de
cobre. Obteve melhores resultados utilizando cartuchos
aniônicos com rendimento de 81 a 90% e precipitação de iodeto de prata com 100%
de rendimento. As reações de oxirredução são aquelas
em que ocorre transferência de elétrons via circuito externo. Neste sentido, o
elemento iodo, na forma de iodeto, é capaz de sofrer
este tipo de reação de oxidação em um potencial bem definido, com a formação de
iodo molecular (I2), de
acordo com a Equação 1.
2I-(aq) ⇌ I2(g) + 2e- E= 0,75 V vs Ag/AgCl
(1). Por esta razão, a separação eletroquímica do iodo é uma alternativa
apresentada neste trabalho que se baseia na mudança de estado físico deste
elemento ao ser oxidado. A técnica de voltametria cíclica, realizada em
umacélula eletroquímica de 3 eletrodos, permite a caracterização dos elementos
que sofrem reações redox quanto à espontaneidade
da reação,
à concentração da solução e ao potencial em que a reação se processa com maior
velocidade (BARD,A. J.; FAULKNER, L. R, 2001). Com
estes parâmetros torna-se possível descobrir quais dos elementos (Ru, Te, Mo)
torna-se um interferente, ou seja, que sofrem reação
redox em potencial próximo a 0,75 V vs Ag/AgCl. A técnica de cronoamperometria,
que analisa a corrente pelo tempo, pode ser aplicada
para realizar a separação em si, a partir da aplicação do potencial em que a
reação se processa com maior velocidade (Ep), obtida via
voltametria cíclica, por determinado período.
Material e métodos
Todos os experimentos foram realizados em uma célula eletroquímica de 3
eletrodos, cujo eletrodo de trabalho consistiu em uma malha de platina, o
contra-eletrodo um fio de platina e o eletrodo de referência utilizado foi
prata/cloreto de prata (Ag/AgCl).Além disto, havia na célula um
recipiente para realizar a coleta de iodo e um borbulhador para permitir a
passagem de gás nitrogênio N2 que atuou como gás inerte para
purga e gás de arraste de iodo molecular I2 até o coletor. Para a
limpeza da célula, solução sulfonítrica foi preparada na proporção
3:1 de ácido nítrico e ácido sulfúrico, respectivamente. O processo de limpeza
consistiu em deixar a solução em contato com a célula por cerca de
15 minutos seguida de uma lavagem exaustiva com água deionizada. A limpeza foi
realizada diariamente, a cada 4 experimentos, aproximadamente.
Foram preparadas soluções de concentração 0,01 mol/L com os sais iodeto de
potássio, molibdato de amônio, dióxido de telúrio e cloreto de rutênio
III, dissolvidos separadamente em solução tampão acetato pH 5. Todos os
experimentos foram realizados em um potenciostato/galvanostato PGSTAT302N
Metrohm. A técnica de voltametria cíclica permitiu a caracterização
eletroquímica de todos os elementos separadamente nas temperaturas de 25 °C,
40 °C e 60 °C. Para isto foi utilizado um sistema de banho-maria em que foi
submersa a célula de acordo com a temperatura pretendida. Os
experimentos voltamétricos foram realizados com velocidade de varredura de 0,2
V/s, janela de potencial de 0 a 1,0 V vs Ag/AgCl para todas as
soluções exceto a solução de molibdato de amônio com janela de potencial de -1,0
V a 1,0 V vs Ag/AgCl. A purga foi realizada em todos os
experimentos e consistiu em passar N2 nas soluções por 20 minutos
antes de cada experimento. Para o branco a solução tampão pura foi
ciclada até que fosse observada estabilização do perfil voltamétrico. A técnica
de cronoamperometria foi utilizada para realizar a separação em
si, o Ep (potencial de pico) obtido a partir da voltametria cíclica, foi
aplicado por 4800 s, na forma de salto de potencial, sendo aplicado 0,05
V por 600 s no início e no fim do experimento, e 4800 s ininterruptos de Ep. A
técnica de onda quadrada consistiu em variar a aplicação em 0,05 V
por 300 s e Ep por 600 s, em 8 ciclos. A solução a ser separada consistiu em
uma mistura de todos os sais citados anteriormente na concentração
de 0,01 mol/L. Para realizar a separação do iodo em 60 °C, além dos passos
citados acima, o coletor foi colocado em um banho de gelo, com o
objetivo de aumentar a solubilidade do gás I2 no coletor O iodo
coletado foi analisado qualitativamente, por meio da adição de uma
solução de sulfato de cobre II, de cor azul que, em contato com iodeto de
potássio, reage de acordo com a Equação 2, resultando em uma solução
acastanhada. CuSO4(aq) + 2 KI(aq) → CuI2(s) +
K2SO4 (2)
Resultado e discussão
O comportamento eletroquímico do iodeto de potássio em meio ácido foi avaliado
nas temperaturas de 25 °C, 40 °C e 60 °C utilizando a técnica de
voltametria cíclica. Os resultados obtidos são apresentados na Figura 1 (A). Por
meio dos voltamogramas cíclicos foi possível identificar dois processos
redox: um processo anódico em que a espécie sofre uma reação de oxidação e um
processo catódico em que a espécie sofre uma reação de redução (Figura 1(A)).O
potencial de interesse para este estudo é aquele em que a reação de oxidação
atinge o maior valor de corrente, logo antes de começar a decrescer, e é
denominado potencial de pico anódico (Epa). Além deste, outro pico relacionado à
redução de iodo molecular para iodeto é denominado potencial de pico
catódico (Epc). Os valores de Epa obtidos nos voltamogramas correspondem à
0,8081 V para 25 °C, 0,8032 V para 40 °C e 0,8765 V para 60 °C. É possível
também classificar a reação redox do iodo quanto à sua reversibilidade pois, se
há dois picos, um de oxidação e um de redução, pode-se afirmar que uma
parte do iodeto retorna à iodo molecular. Para uma reação ser considerada
reversível a diferença entre o pico anódico e o pico catódico deve corresponder
à cerca de 59 mV/n (ARISTOV, N.; HABEKOST, A, 2015). No entanto, foram obtidos
os valores de 49 mV/n para 60 °C, 57 mV/n para 40 °C e 68 mV/n para 25 °C,
indicando reações quasi-reversíveis, pois exibem comportamento intermediário
entre reações irreversíveis e reversíveis.Em relação ao aumento de
temperatura, não houve alterações significativas, o que indica pouca ou nenhuma
influência da temperatura na reação redox. Porém, a temperatura é um fator
importante para garantir o aumento da fração de I2 a ser capturado
pelo coletor e a diminuição dele em solução, desta forma é possível evitar
que o iodo molecular reaja com o íon iodeto formando íons triiodeto, de acordo
com a Equação 3.I- + I2 ⇌ I3- (3). O molibdênio é um
elemento com diversos estados de oxidação que podem variar de +1 a +6 com
tendência a formar diversos óxidos (LEE, 1980), além dos molibdênios bronze que
ocorrem quando íons monovalentes, como H+, intercalam-se com seus óxidos
(KOSMINSKY, L.; BERTOTTI, M., 1999). O íon molibdato (Figura 1 (B)) apresentou
voltamograma característico de reações redox, especialmente em potenciais mais
negativos, indicando tendência em sofrer reações de redução. Em potenciais
mais positivos, a corrente observada é apenas capacitiva e não apresenta sinais
de interferência na reação de oxidação de iodo. Em relação ao aumento de
temperatura, é possível observar que não houve deslocamento de potencial, apenas
aumento de corrente, indicando o aumento da velocidade da reação
eletroquímica. Já o dióxido de telúrio é pouco solúvel em água e tem estados de
oxidação que podem variar de -2 a +6. O perfil voltamétrico deste elemento
foi avaliado, Figura 1 (C), e não foram observados picos anódicos em 25 °C e 40
°C que pudessem indicar interferência no intervalo de potencial em que
ocorre a reação de oxidação do iodo. Isto pode ser explicado pela reação em que
este sal sofre em meio ácido, transformando-se em ácido teluroso, um
composto bastante estável, de acordo com e Equação 4. TeO2(s) +
H2O(l) → H2TeO3(aq)(4). Em temperaturas mais
elevadas (60 °C), observou-se corrente catódica no intervalo de potencial de 0,8
V a 1,0 V, esta reação corresponde à redução de Te4+ para Te, de
acordo
com a Equação 5. TeO2 + 4 H+ + 4e- → Te(s) + 2H2O
E= 0,81 V (5). O cloreto de rutênio III é um sal bastante estável, reage
com oxigênio apenas em altas temperaturas, em soluções alcalinas é comumente
oxidado a +2, +3 e +4, no entanto em soluções ácidas não costuma sofrer
reações.Os voltamogramas deste sal, Figura 1 (D), indicam a ausência de picos
anódicos no potencial em que a reação de oxidação do iodo ocorre em 25 ° C e
40 °C, no entanto em 60 °C nota-se um pico acentuado de corrente catódica
acompanhado de um pico anódico menos intenso. Esta reação associa-se a oxidação
de Ru2+ para Ru3+ e pode ser considerada uma reação que
interfere na separação
eletroquímica de iodo, ou seja, nesta temperatura e concentração, a reação
de oxidação de iodo poderá competir com a de oxidação do rutênio, diminuindo seu
rendimento.O teste qualitativo de iodo baseou-se no fato de o
CuI2 apresentar coloração amarronzada, enquanto o CuSO4
apresenta
coloração azul. Ao reagir o CuSO4 com o iodo resultante da
separação eletroquímica, buscou-se uma mudança de coloração, indicando que
alguma quantidade de iodo foi capturada. Vale ressaltar que o iodo capturado,
quando em contato com a solução de KOH, torna-se iodeto novamente e reage com o
CuSO4 de acordo com a Equação 2, descrita anteriormente.
CuSO4 (aq) + KI (aq)→ CuI2 (s) +
K2SO4 (aq) (2). A Figura 2 (A) indica as colorações
obtidas utilizando a
solução com todos os sais em conjunto na temperatura de 25 °C, quando a
cronoamperometria foi realizada na forma de onda quadrada, ou seja, alternando a
aplicação de potencial em 0,05 V e 0,81 V para 25°C por 8 ciclos e, em salto de
potencial, com aplicação inicial e final de 0,05 V entre a aplicação
ininterrupta de 0,81 V. A cronoamperometria realizada na forma de onda quadrada
originou uma solução bastante amarronzada, após a adição de CuSO4,
indicando que foi possível separar uma boa quantidade de iodo. Ainda, a
cronoamperometria em salto de potencial apresentou uma coloração
amarronzada,porém
menos intensa, o que pode indicar menor eficiência deste método. Já a Figura 2
(B) representa as colorações obtidas aplicando 0,81 V, o potencial de pico
anódico para 40 °C, em forma de onda quadrada e em salto de potencial. Foi
obtida uma coloração amarronzada bastante intensa, indicando que nesta
temperatura, a aplicação em forma de salto de potencial se apresenta como um bom
método de separação. Por fim, na Figura 2 (C) estão os experimentos de
separação em 60 °C, tanto na forma de onda quadrada quanto de salto de
potencial, e o resultado obtido foi uma coloração azul intensa, que indica pouca
ou
nenhuma reação do cobre com o iodo. Neste sentido, pode-se afirmar que pouco
iodo foi capturado nesta temperatura.
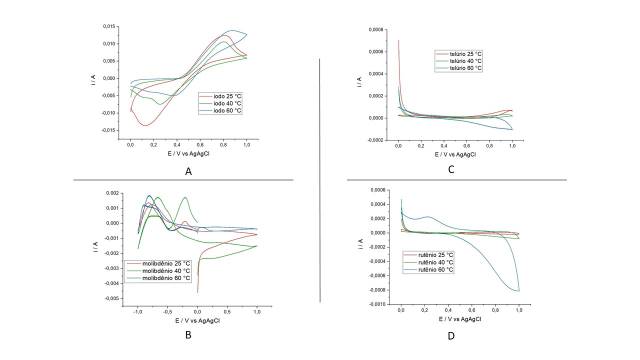
Voltamogramas dos sais de iodo (A), molibdênio (B), telúrio (C) e rutênio (D) em [0,01] mol/L, pH 5, nas temperaturas de 25°, 40° e 60° C
Figura 2 - Testes qualitativos de recuperação de iodo na presença de metais interferentes em 25 °C (A), 40 °C (B) e 60 °C (C)
Conclusões
Neste trabalho foi possível estudar o comportamento eletroquímico dos sais de
iodo, molibdênio, telúrio e rutênio através dos
experimentos de voltametria cíclica, possibilitando a utilização dos potenciais
de pico da reação redox identificados para cada
temperatura nos experimentos de cronoamperometria. O iodo apresentou picos bem
desenvolvidos e dentro do valor esperado em todas as
temperaturas estudadas. Os sais de molibdênio e telúrio não se mostraram
interferentes em nenhum dos valores de temperatura, no entanto
o rutênio em temperatura de 60° C apresenta-se como um interferente que compete
com a reação de oxidação do iodo tornando a separação
mais lenta. Apesar da interferência do rutênio, é possível realizar a separação,
pois o iodo é recuperado em sua forma gasosa enquanto o
rutênio, mesmo sofrendo reações redox, permanece em solução. Os experimentos
qualitativos de recuperação de iodo na presença de metais
interferentes indicaram boa captura em 25° C e 40° C a partir do método de salto
de potencial.
Em 60° C não houve boa captura de iodo,
indicado pela coloração azulada no tubo de ensaio. Apesar de o aumento de
temperatura aumentar a cinética da reação e evitar a formação
de triiodeto, não houve boa ressolubilização do iodo molecular no coletor, o que
resultou em grande escape do elemento.
Agradecimentos
Os autores agradecem o apoio financeiro cedido pela CAPES, e o laboratório e
equipamentos cedidos pelo CECON IPEN - Centro do combustível Nuclear.
Referências
AMERICAN CANCER SOCIETY. Surgery for Thyroid Cancer. 2019. Disponível em: https://www.cancer.org/cancer/thyroid-cancer/treating/surgery.html. Acesso em: 29 jun. 2022.
ARISTOV, N.; HABEKOST, A.. Cyclic Voltammetry - A Versatile Electrochemical Method Investigating Electron Transfer Processes. World Journal Of Chemical Education. Ludwigsburg, p. 115-119. nov. 2015.
BARD, A. J.; FAULKNER, L. R.. Electrochemical Methods: fundamentals and applications. New York: John Wiley & Sons, Inc., 2001.
INSTITUTO DE PESQUISAS ENERGÉTICAS E NUCLEARES. Radioisótopos na medicina. 2016. Disponível em: https://www.ipen.br/portal_por/portal/interna.php?secao_id=40&campo=5854. Acesso em: 27 jun. 2022.
INSTITUTO NACIONAL DO CÂNCER. Câncer de Tireóide. Disponível em: https://www.gov.br/inca/pt-br/assuntos/cancer/tipos/tireoide. Acesso em: 28 ago. 2022.
INSTITUTO NACIONAL DO CÂNCER JOSÉ ALENCAR GOMES DA SILVA. Estimativa 2020: incidência de câncer no Brasil. Rio de Janeiro: Inca, 2019.
KOSMINSKY, L.; BERTOTTI, M. Estudos eletroquímicos sobre a redução de iodato em superfícies modificadas por filmes de óxidos de molibdênio. 1999, Anais.. Tabuleiro dos Martins: CCEN/UFAL, 1999. . Acesso em: 20 jul. 2022.
MUSHTAQ, A. et al. Separation of fission Iodine-131. Paquistão. Ago. 2013. Acesso em: 01 set 2022.
WILKINSON, M. V.; MONDINO, A. V.; MANZINI, A. C.. Separation of iodine produced from fission using silver-coated alumina. Journal Of Radioanalytical And Nuclear Chemistry. Argentina, p. 413-415. jun. 2002.
















