Autores
Araujo, R. (IQSC) ; Perez, J. (IQSC)
Resumo
A eletroredução do nitrogênio para amônia em condições de temperatura e pressão
ambiente tem ganhado destaque, como uma alternativa ao processo tradicional,
Haber-Bosch, diminuindo as emissões de CO2 via síntese de NH3. Por essa razão, a
reação de redução de nitrogênio (RRN) está sendo profundamente investigada como
uma via de produção de amônia em grande escala e de forma sustentável. Este
trabalho consiste no estudo da atividade dos catalisadores de MoS2 e WS2 frente a
RRN. As técnicas utilizadas foram voltametria cíclica e cronoamperometria. Os
produtos da eletrólise, NH3 e N2H4 foram analisados por espectrofotometria UV-Vis.
A taxa de produção de amônia foi de 34,4 µg mg-1cat h-1 e 7,5 µg mg-1cat h-1 em
0,6 V vs. RHE, para MoS2 e WS2, respectivamente, mostrando-se promissores
Palavras chaves
Redução de Nitrogênio; Amônia; Eletrocátalise
Introdução
Estudos envolvendo o uso da amônia têm ganhado bastante destaque no setor
energético, uma vez que sua reação de oxidação pode trazer soluções tanto
ambientais quanto energéticas. O processo de obtenção da amônia é bem
estabelecido pelo método Haber-Bosch (1913) (JEERH; ZHANG; TAO,
2021).Entretanto, a obtenção da amônia por esse método não é totalmente limpo e
sustentável, sendo necessário o uso de hidrogênio produzido pela reforma a vapor
de hidrocarbonetos para formação da amônia, o que contribui para emissão de
gases de efeito estufa. Além disso, é um processo que requer condições adversas
na produção como, altas temperaturas e pressões de operação demandando um alto
gasto energético (WU; JI; DAI; CHEN et al., 2020).
A RRN a amônia em condição ambiente, de temperatura e pressão tem sido bastante
explorada recentemente(DU; YANG; PU; ZENG et al., 2020; MA; CHEN; WANG, 2021;
SU; CHEN; CHEN; SI et al., 2020). Esse processo é visto como uma alternativa
promissora de produção amigável ao meio ambiente, dado que o hidrogênio da
amônia é provindo de solução aquosa, desta maneira, contribuindo na redução de
uma grande fração das emissões de CO2 contidos na síntese de NH3. Contudo, o
processo ainda sofre com a falta de eletrocatalisadores ativos e eficientes,
dado que a cinética da reação de conversão é lenta (GUO; RAN; VASILEFF; QIAO,
2018; TANG; QIAO, 2019).
O processo de conversão a partir RRN possui diversas vantagens como, a
eliminação do uso de produtos derivados do petróleo, uma conversão sustentável
de energia a partir de N2 e H2O, desnecessidade de uma planta maior de operação,
redução na demanda de matriz energética, além disso, a diminuição nas emissões
de gases poluentes (CHEN JINGGUANG; CROOKS RICHARD; SEEFELDT LANCE; BREN KARA et
al., 2018; FOSTER; BAKOVIC; DUDA; MAHESHWARI et al., 2018).
O trabalho tem como intuito de estudar a relação entre os eletrocatalisadores
como, dissulfeto de molibdênio (MoS2) e sulfeto de tungstênio (WS2) frente a
reação de redução de nitrogênio a amônia.
Material e métodos
Determinação da Amônia
A concentração de amônia foi determinada pelo método do indofenol azul (LI et
al., 2020), após a eletrólise, foi retirado 10 mL do compartimento catódico e
misturado com o reagente de coloração. A amostra foi analisada pelo
espectrômetro UV-Vis (800-600nm). A curva de calibração foi realizada a partir
de sulfato de amônio como padrão.
Determinação da Hidrazina
O produto foi determinado pelo método de Watt e Chrisp (WATT; CHRISP, 1952). Ao
final dos ensaios de cronoamperometria, 2 mL de amostra foi coletado do
compartimento catódico e misturado com 2 mL do agente de coloração. Analisado o
produto no espectrofotômetro UV-vis (510-415 nm). A curva de calibração foi
montada a partir de solução H2H4 de concentração conhecida.
Eficiência Faradaica (EF) e Taxa de formação de NH3
A taxa de rendimento de NH3 e a eficiência faradaica foi calculada através das
seguintes expressões (CHU; LIU; LI; WANG et al., 2019):
Taxa de rendimento (µg mg-1cat h-1) = (CNH4+ x V x 17) / (18 x t x mcat)
Eficiência Faradaica = (3 x F x CNH4+ x V) / (18 x Q) x 100%
Onde CNH4+ é a concentração medida do íon NH4+, V o volume utilizado de
eletrólito, t o tempo de duração da cronoamperometria, m a massa de catalisador
depositado sobre o eletrodo de trabalho, F a constante de Faraday e Q sendo a
integral da área da corrente por tempo depois da eletrólise.
Preparação do Eletrodo de trabalho
Para o preparo do eletrodo de trabalho, 10 mg de catalisador de MoS2 ou
WS2 foi pesado e misturado com 37 µL de uma solução de 5% m/v de Nafion, em
seguida a mistura foi levada para o banho de ultrassom por 30 minutos. A tinta
homogênea foi transferida para o eletrodo de papel carbono com uma área
geométrica de 2,0 cm2. O eletrodo foi seco em temperatura ambiente.
Medidas Eletroquímicas
Para os ensaios eletroquímicos foi utilizado uma célula do tipo H com os
compartimentos anódico e catódico separados por uma membrana de Nafion 115. A
configuração eletroquímica sendo, eletrodo de trabalho, de papel carbono com
área 2,0 cm2, Pt e Ag/AgCl/KClsat utilizados como contra eletrodo e eletrodo de
referência, respectivamente. Os potenciais foram controlados pelo potenciostato
PARSTAT 3000A-DX.
As medidas de voltametria cíclica foram conduzidas em solução de 10 mmol L-1 de
H2SO4 com N2-saturado. Foi registrado diversas curvas em velocidades de
varredura (1, 2, 3, 4 e 5 mV s-1) em um intervalo de potencial de 0,35 V a 0,40
V vs. RHE, para obter a capacitância da dupla camada (Cdl) dos catalisadores.
As medidas de cronoamperometria foram realizadas em solução de 10 mmol L-1 de
H2SO4 com N2-saturado na configuração de três eletrodos, sendo os potenciais
utilizados de -0,4, -0,5 e -0,6 V vs. RHE, por 1 h. Uma alíquota do
compartimento catódico foi utilizada para as análises dos produtos.
Resultado e discussão
Para avaliar a área eletroquimicamente ativa dos catalisadores (AEA) foi
realizado voltametrias nas regiões da dupla camada elétrica, conforme a figura 1
a, b, o coeficiente angular obtido, figura a,b inset, representa a capacitância
da dupla-camada elétrica (Cdl) do material. A partir dos valores obtidos, o MoS2
apresentou um valor maior de 10,74 mF cm-2 e o WS2, 9,72 mF cm-2 indicando uma
maior área ao primeiro comparado ao segundo.
Os métodos, Indofenol azul e de Watt e Chrisp foram usados para analisar os
eletrólitos em diferentes potencias após a eletrólise, tanto como detectar os
produtos como, amônio e hidrazina, respectivamente. A figura 1 c, d apresenta as
curvas de calibração para os dois produtos.
O valor de maior absorbância para amônio foi obtido para o catalisador de MoS2
no potencial de -0,6 V vs. RHE, consequentemente apresentando uma maior taxa de
produção de NH3 (34,38 µg h-1 mgcat-1). Em comparação com trabalho relatado por
XIANGHONG Li. (2019)(LI; REN; LIU; ZHAO et al., 2019) utilizando MoS2 como
catalisador para RRN depositado em nano folhas de grafeno apresentou um valor
de conversão 24,82 µg h-1 mgcat-1 inferior ao deste trabalho. A análise do
intermediário de reação N2H4 no MoS2 foi maior no potencial de -0,4 V, indicando
que o potencial de -0,6 V é favorável para conversão de amônia, produto
desejado.
Por outro lado, o catalisador de WS2 apresentou uma maior absorbância no
potencial -0,6V vs. RHE para amônio, porém com baixa eficiência faradaica
indicando uma baixa seletividade para RRN, neste caso, a reação favorecida no
processo foi a reação de redução de hidrogênio, reação paralela indesejável no
processo de redução do nitrogênio. O intermediário de reação N2H4 foi encontrado
no potencial de -0,5 V vs. RHE. Valores para o catalisador de WS2 encontrado no
trabalho de LIANGYU (2021) foi de 3,63 µg mg-1cat h-1 no potencial de -0,6 V vs.
RHE assemelhando com os resultados obtidos neste estudo.
Os resultados obtidos para o catalisador WS2 para a taxa de produção foram de
1,26 e 7,5 µg mg-1cat h-1 para amônia e 0,169 ppm e 0,003 ppm para N2H4
apresentando uma EF 1,15% e 4,47%, nos potenciais -0,5 e -0,6 V vs. RHE,
respectivamente. Os resultados obtidos para o catalisador MoS2 foram 16,08 e
34,38 µg mg-1cat h-1 para amônia e 0,280 ppm e 0,001 ppm para N2H4 com uma EF de
22,85% e 25,31%, nos potenciais -400 e -600 mV vs. RHE, respectivamente. Os
resultados indicam que o melhor suporte para RRN seria o MoS2.
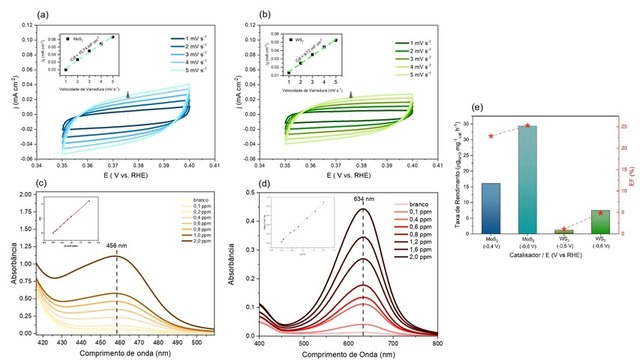
(a) VCs MoS2, inset Cdl. (b) VCs do WS2. (c) Curva de calibração para o N2H4. (d) Curva de calibração do íon NH4+. (e) taxas de rendimento e a EF.
Conclusões
Conclui-se que a partir dos resultados apresentados o catalisador que apresentou a
maior performance na redução de nitrogênio foi o MoS2 no potencial de -0,6V vs.
RHE mostrando um bom candidato para a proposta, enquanto para o catalisador de WS2
os resultados não foram favoráveis a RNN, sendo notado uma maior eficiência para a
reação de redução de hidrogênio. Uma respectiva futura para o trabalho será a
utilização desses materiais como suporte para outros metais e verificar se ocorre
um aumento da atividade frente a NRR.
Agradecimentos
Agradeço a CNPQ (processo#161144//2021-7) e pela FAPESP (processo#2019/22183-6),
ao programa de Pós-graduação do IQSC.
Referências
CHEN JINGGUANG, G.; CROOKS RICHARD, M.; SEEFELDT LANCE, C.; BREN KARA, L. et al. Beyond fossil fuel–driven nitrogen transformations. Science, 360, n. 6391, p. eaar6611, 2018/05/25 2018.
CHU, K.; LIU, Y.-P.; LI, Y.-B.; WANG, J. et al. Electronically Coupled SnO2 Quantum Dots and Graphene for Efficient Nitrogen Reduction Reaction. ACS Applied Materials & Interfaces, 11, n. 35, p. 31806-31815, 2019/09/04 2019.
DU, H.; YANG, C.; PU, W.; ZENG, L. et al. Enhanced Electrochemical Reduction of N2 to Ammonia over Pyrite FeS2 with Excellent Selectivity. ACS Sustainable Chemistry & Engineering, 8, n. 28, p. 10572-10580, 2020/07/20 2020.
FOSTER, S. L.; BAKOVIC, S. I. P.; DUDA, R. D.; MAHESHWARI, S. et al. Catalysts for nitrogen reduction to ammonia. Nature Catalysis, 1, n. 7, p. 490-500, 2018/07/01 2018.
GUO, C.; RAN, J.; VASILEFF, A.; QIAO, S.-Z. Rational design of electrocatalysts and photo(electro)catalysts for nitrogen reduction to ammonia (NH3) under ambient conditions. Energy & Environmental Science, 11, n. 1, p. 45-56, 2018. 10.1039/C7EE02220D.
JEERH, G.; ZHANG, M.; TAO, S. Recent progress in ammonia fuel cells and their potential applications. Journal of Materials Chemistry A, 9, n. 2, p. 727-752, 2021.
LI, X.; REN, X.; LIU, X.; ZHAO, J. et al. A MoS2 nanosheet–reduced graphene oxide hybrid: an efficient electrocatalyst for electrocatalytic N2 reduction to NH3 under ambient conditions. Journal of Materials Chemistry A, 7, n. 6, p. 2524-2528, 2019. 10.1039/C8TA10433F.
LI, H.;LI, T.;Qian, J. et al. CuCo2S4 integrated multiwalled carbon nanotube as high-performance electrocatalyst for electroreduction of nitrogen to ammonia. International Journal of Hydrogen Energy, v. 45, n. 29, p. 14640-14647, 2020.
MA, H.; CHEN, Z.; WANG, Z. Electroreduction of nitrogen to ammonia on nanoporous gold. Nanoscale, 13, n. 3, p. 1717-1722, 2021. 10.1039/D0NR07362H.
SU, H.; CHEN, L.; CHEN, Y.; SI, R. et al. Single Atoms of Iron on MoS 2 Nanosheets for N 2 Electroreduction into Ammonia. Angewandte Chemie International Edition, 59, n. 46, p. 20411-20416, 2020.
TANG, C.; QIAO, S.-Z. How to explore ambient electrocatalytic nitrogen reduction reliably and insightfully. Chemical Society Reviews, 48, n. 12, p. 3166-3180, 2019. 10.1039/C9CS00280D.
WATT, George W.; CHRISP, Joseph D. Spectrophotometric method for determination of hydrazine. Analytical Chemistry, v. 24, n. 12, p. 2006-2008, 1952.
WU, L.; JI, Y.; DAI, D.; CHEN, T. et al. Exceptional size-dependent activity enhancement in the catalytic electroreduction of N2 over Mo nanoparticles. International Journal of Hydrogen Energy, 45, n. 56, p. 31841-31848, 2020/11/13/ 2020.
















