Autores
Jacinto, C. (UNIVERSIDAD NACIONAL DE INGENIERÍA) ; Picasso, G. (UNIVERSIDAD NACIONAL DE INGENIERÍA) ; Lopez, R. (UNIVERSIDAD NACIONAL DE INGENIERÍA) ; Maza, I. (UNIVERSIDAD NACIONAL DE INGENIERÍA) ; Taboada, M.D.P. (2UNIVERSIDAD ESTADUAL PAULISTA (UNESP))
Resumo
Se determinó tartrazina en bebidas gaseosas utilizando un polímero
molecularmente impreso (MIP) y el análisis de imágenes del aplicativo
PhotoMetrix Pro®. El MIP y respectivo NIP se prepararon por el método de
precipitación, se caracterizaron mediante espectroscopía infrarrojo y
microscopía electrónica de barrido (SEM). Las pruebas de adsorción del MIP
mostró condiciones óptimas de pH 3. Para el análisis de imágenes, el MIP se puso
en contacto con muestras de tartrazina y se agitó, se filtró y el sólido se
analizó con el aplicativo PhotoMetrix® Pro. Con el método propuesto se determinó
tartrazina en bebidas gaseosos para dos marcas de bebidas gaseosas de Perú, Sol
de Oro (16,4±3,4) ppm e Inca Kola (14,9±1,9), estos resultados fueron
comparables a las obtenidas por UV-Visible.
Palavras chaves
Tartrazina; MIP; Análisis de imágenes
Introdução
La tartrazina es un colorante amarillo utilizado en bebidas, dulces y alimentos
en general. La ingesta diaria máxima de tartrazina en humanos es hasta 7,5 mg/kg
de masa corporal (Yamjala et al., 2016 como se cito en Vidal et al., 2018). Se
han desarrollado múltiples técnicas para la determinación de tartrazina que son
efectivas, pero tienen el inconveniente de ser costosos, procedimientos
complicados en la preparación de muestra, tiempos de análisis prolongados y
grandes cantidades de solventes tóxicos.
Los polímeros molecularmente impresos, MIPs, son materiales sintéticos que
funcionan como un mecanismo de "cerradura y llave" para unir selectivamente la
molécula con la que fueron moldeadas durante la síntesis. Los MIP ofrecen la
especificidad y selectividad potencial de los receptores biológicos con las
ventajas explícitas de durabilidad con respecto a las condiciones ambientales y
de bajo costo (Belbruno, 2019).
El análisis de imágenes aplicado al análisis químico es bastante reciente. La
evaluación del color es de gran utilidad en el análisis de imágenes digitales
(Sivakumar & Lee, 2021). El uso de teléfonos inteligentes (smartphones)
combinado con sensores o dispositivos de análisis de color, se puede utilizar
como detectores o cuantificadores de sustancias coloreadas, haciendo los métodos
de análisis más rápidos y fáciles de usar (Liu et al., 2019).
Este trabajo de investigación propone desarrollar un procedimiento para
cuantificar tartrazina de bebidas gaseosas. Esta se basa en la adsorción del
colorante en polímeros molecularmente impresos, y según la cantidad de
tartrazina adsorbida produce una intensidad de color que es capturado por la
imagen de la cámara de un smartphone, y finalmente realizar el análisis de
imágenes utilizando el Photometrix Pro instalado.
Material e métodos
Se preparó el MIP por precipitación utilizando el procedimiento general de la
síntesis propuesto por Córdova (Ruiz-Córdova et al., 2021). Los materiales MIP y
NIP sintetizados se caracterizaron por espectroscopía Infrarroja con
Transformada de Fourier (FTIR) para identificar sus grupos funcionales, por
sorción de N2 (método BET) para estimar la porosidad y superficie
específica, y por Microscopia Electrónica de Barrido (SEM) para evaluar la
morfología superficial y la distribución de tamaños de las partículas del
material. Las pruebas de adsorción se realizaron para optimizar primero el pH,
la masa del adsorbente, tiempo de contacto y selectividad con diversos
colorantes. Para las pruebas de análisis de imágenes, en un frasco de 20 mL se
agregó 15 mg de MIP o NIP y 15 mL de la solución de tartrazina a pH 3,0. Se
agitó en un homogenizador por 10 minutos y se filtró en papel Whatman No 40. Se
retiró el sólido del papel y se colocó en el portamuestra para luego llevarlo en
el dispositivo que contiene el smartphone y ser analizado con el aplicativo
PhotoMetrix®.
Resultado e discussão
Los espectros IR del MIP y NIP muestran picos característicos a 1640
cm-1 y 3300 cm-1, correspondientes al pico de vibración
del C=O y al pico de vibración del NH2 respectivamente,
correspondientes a grupos funcionales del monómero estructural. A 1660
cm-1 no se observa el pico característico del doble enlace C = C del
monómero estructural, confirmando la polimerización a través de estos enlaces.
La microscopía SEM muestra que ambos materiales tienen morfología similar. La
medición del diámetro de partícula promedio mediante el software ImageJ, reportó
que el MIP presenta 173,4 (± 1,4) nm y el NIP, 128,2 (± 2,7) nm. Se realizaron
estudios de adsorción de soluciones de tartrazina con el MIP y se encontraron
las condiciones óptimas para la adsorción de 1,5 mL de solución de tartrazina de
20 pm; pH de la solución de 3,0, masa de adsorbente 6 mg y tiempo de contacto de
10 minutos.
El análisis de imágenes con el aplicativo PhotoMetrix® consistió en la
extracción de los valores de RGB de la imagen y construcción de la curva de
calibración multivariada mediante regresión PLS (Partial Least Squares). El
tratamiento PLS extrae 6 factores con lo cual se obtiene un RMSEC (raíz cuadrada
media de calibración) de 0,260 y un coeficiente de correlación de la gráfica de
calibración de 0,9978. El resultado de repetibilidad para 10 ppm de tartrazina
para el MIP fue de 11,1 (± 1,6) ppm. Para las bebidas gaseosas se obtuvieron
para Sol de Oro 16,4 (± 3,4) ppm e Inca Kola 14,9 (± 1,9) ppm utilizando el MIP
y con el método UV-Visible se obtuvieron 11,9 (± 0,5) ppm y 13,6 (± 0,7) ppm
respectivamente. En pruebas adicionales, se comprobó que el método UV-visible es
comparable con el de HPLC para bebidas gaseosas.
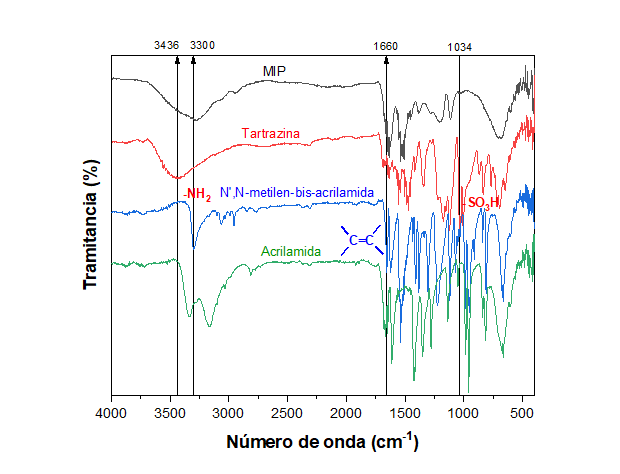
Espectros infrarrojos MIP y reactivos de la síntesis tartrazina, N’, N-metilen-bis-acrilamida y acrilamida

Imagen de microscopía de barrido electrónico (SEM) del MIP.
Conclusões
Se obtuvo el MIP por el método de precipitación capaz de adsorber tartrazina de
soluciones acuosas y fue caracterizado por IR y microscopía SEM. Se realizaron
pruebas de adsorción de soluciones acuosas de tartrazina y se obtuvieron las
condiciones óptimas de adsorción. Los resultados obtenidos muestran que es posible
utilizar MIP para captar selectivamente la tartrazina de bebidas gaseosas. La
cuantificación de tartrazina se realizó por análisis de imágenes del MIP expuesta
a muestras de bebidas gaseosas utilizando la cámara de smartphone y el aplicativo
PhotoMetrix Pro.
Agradecimentos
Al gobierno del Perú a través del programa FONDECYT (Contrato N° 067-2021-
FONDECYT) por el financiamiento de la investigación.
Referências
Belbruno, J. J. (2019). Molecularly Imprinted Polymers. Chemical Reviews, 119(1), 94–119. https://doi.org/10.1021/ACS.CHEMREV.8B00171
Liu, J., Geng, Z., Fan, Z., Liu, J., & Chen, H. (2019). Point-of-care testing based on smartphone: The current state-of-the-art (2017–2018). Biosensors and Bioelectronics, 132, 17–37. https://doi.org/10.1016/J.BIOS.2019.01.068
Ruiz-Córdova, G. A., Villa, J. E. L., Khan, S., Picasso, G., & Del Pilar Taboada Sotomayor, M. (2021). Surface molecularly imprinted core-shell nanoparticles and reflectance spectroscopy for direct determination of tartrazine in soft drinks. Analytica Chimica Acta, 1159, 338443. https://doi.org/10.1016/J.ACA.2021.338443
Sivakumar, R., & Lee, N. Y. (2021). Recent progress in smartphone-based techniques for food safety and the detection of heavy metal ions in environmental water. Chemosphere, 275, 130096. https://doi.org/10.1016/J.CHEMOSPHERE.2021.130096
Vidal, M., Garcia-Arrona, R., Bordagaray, A., Ostra, M., & Albizu, G. (2018). Simultaneous determination of color additives tartrazine and allura red in food products by digital image analysis. Talanta, 184, 58–64. https://doi.org/10.1016/j.talanta.2018.02.111
Yamjala, K., Nainar, M. S., & Ramisetti, N. R. (2016). Methods for the analysis of azo dyes employed in food industry – A review. Food Chemistry, 192, 813–824. https://doi.org/10.1016/J.FOODCHEM.2015.07.085
















