Autores
Souza, L.D. (UFVJM) ; Silva, K.C. (UFVJM) ; Gomes, V.A. (UFVJM) ; Souza, E.R. (UFVJM) ; Vieira, A.W. (UFVJM) ; Lemos, L.R. (UFVJM)
Resumo
Os Sistemas Aquosos Bifásicos (SAB) formados por polietilenoglicol (PEG) e sal são
bastante utilizados em pesquisas envolvendo partição de moléculas e íons devido ao
seu baixo custo e rápida separação de fases. Foram caracterizados os diagramas de
fases dos SAB formados por PEG 10K e sais ditionito de sódio (Na2S2O4) e sulfito
de sódio (Na2SO3), em diferentes temperaturas. Com o estudo, foi observado que a
temperatura não causou uma alteração significativa nas regiões bifásicas,
demonstrando que a segregação de fases foi entropicamente dirigida. Também foi
estudado o efeito dos ânions na região bifásica dos sistemas, o SO32- apresentou
maior efeito salting out do que o S2O42-, necessitando de uma menor concentração
do ânion sulfito para que ocorra a separação entre as fases dos sistemas.
Palavras chaves
Química Verde; Sistema Aquoso Bifásico; Polietilenoglicol
Introdução
Os sistemas aquosos bifásicos (SAB’s) são uma técnica de extração líquido-
líquido composta por duas fases imiscíveis e ricas em água, alinhados com os
princípios da química verde devido às suas características sustentáveis e de
baixa periculosidade (DA SILVA; LOH, 2006). Apresentam diversas vantagens frente
à processos convencionais, como fácil preparação, baixo custo, baixa tensão
interfacial, alta seletividade, além de não fazer uso de solventes orgânicos
tóxicos e possibilitar a reciclagem dos componentes (RODRIGUES et al., 2010).
Dentre os diversos tipos de SAB’s, os mais utilizados são os sistemas formados
por uma fase polimérica e uma fase eletrolítica devido ao seu baixo custo e a
rápida e eficiente separação de fases (ALVARENGA et al., 2014), além de baixa
viscosidade e maior seletividade (ROSA et al., 2011), com destaque para o
polietileno glicol (PEG) nas mais diversas massas molares. O PEG é o polímero
mais utilizado no estudo de SAB’s por ser relativamente atóxico e estável em
todos os seus estados físicos e soluções. Neste contexto, este trabalho visa a
obtenção de novos dados de equilíbrio líquido-líquido para SAB’s formados pelo
polímero PEG 10000 g mol-1 (PEG10K) e sais ditionito de sódio e
sulfito de
sódio, nas temperaturas de 278,15K, 288,15K e 298,15K.
Material e métodos
As regiões monofásica e bifásica foram determinadas por titulação turbidimétrica
para obtenção de uma curva binodal. Em um tubo foi adicionado 1,0 g da solução
estoque do polímero PEG10K (40% m/m), na sequência titulou-se com auxílio de uma
micropipeta adicionando-se alíquotas de 30 μl das soluções de ditionito de sódio
(Na2S2O4) (15% m/m) ou sulfito de sódio
(Na2SO3) (25% m/m). As alíquotas foram
adicionadas até a observação da turvação da solução, o que indica que o sistema
se tornou heterogêneo. Após estabelecer o equilíbrio, adicionou-se alíquotas de
30 μl de água até observar a desturvação da solução. Repetiu-se este
procedimento até a obtenção de vinte pontos.
Após a obtenção da estimativa da posição da linha binodal, foram
escolhidos de 4 a 5 pontos na região bifásica para cada sistema a fim de se
obter as linhas de amarração. Os SAB’s foram preparados misturando-se
quantidades adequadas das soluções estoque de polímero, sal e água, para a
obtenção de um sistema com 10 g de massa total. As misturas foram vigorosamente
agitadas com auxílio do vortex e na sequência mantidos em repouso nas
temperaturas de estudo em banho ultratermostático até que o sistema atingisse o
equilíbrio. O estado de equilíbrio foi caracterizado pela ausência de turbidez
em ambas as fases. Para as análises da composição das fases, foram retiradas com
auxílio de uma seringa alíquotas das fases superior (FS) e inferior (FI). Para a
medida da concentração de sal realizada por condutimetria as FS e FI foram
diluídas 700 e 1000 vezes, respectivamente. A concentração de polímero foi
determinada através das medidas de índice de refração em ambas as fases com
diluição de 1,5 vezes.
Resultado e discussão
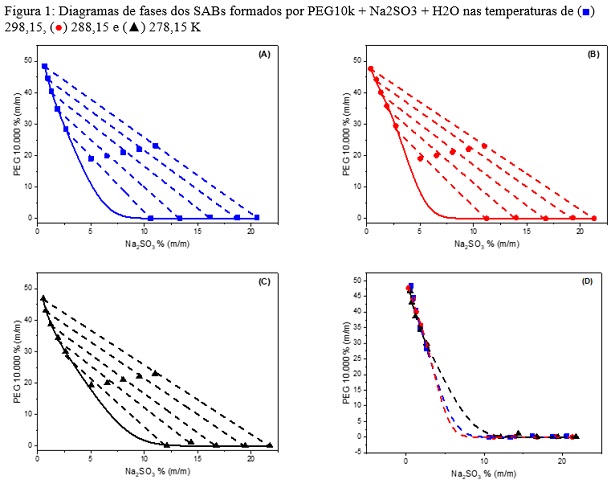
Na Figura 1 estão representados os diagramas dos SAB’s formado por PEG 10K +
Na2SO3 + H2O, nas temperaturas de 278,15,
288,15 e 298,15 K. Nas Figuras 1A-1C observa-se uma boa correlação linear entre
os pontos de composição global (no centro da linha de amarração) e os pontos de
composição de FS (rico em polímero) e FI (rico em sal), indicando um bom balanço
de massa, mostrando a exatidão da metodologia utilizada. Para todos os sistemas
a água é o principal componente das fases, e uma aumento da concentração dos
componentes nos pontos globais geram linhas de amarração de comprimentos
maiores, ocorrendo um incremento na diferenciação das propriedades
termodinâmicas intensivas entre as fases.
Na Figura 1D, observa-se que não houve uma diferença significativa nas regiões
bifásicas com a variação da temperatura, demonstrando que a segregação de fases
foi entropicamente dirigida. Comportamentos similares foram obtidos para o SAB
formado por PEG 10K +Na2S2O4 + H2O.
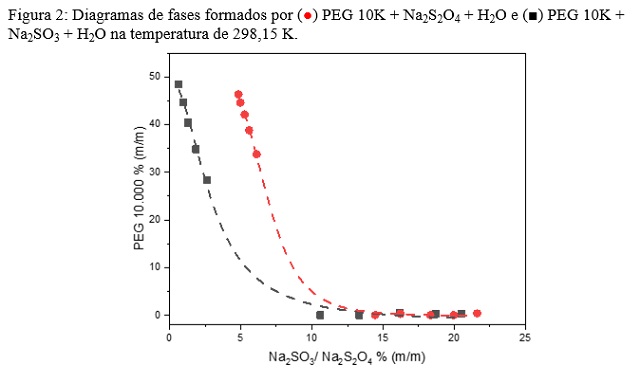
A Figura 2 mostra a comparação das regiões bifásicas dos SAB’s em função do
ânion formador (S2O42- ou SO32-) na
temperatura de 298,15 K, sendo que SO32 apresentou uma região bifásica maior que
o S2O42-, este comportamento foi similar nas demais temperaturas estudadas. Este
comportamento se deve ao efeito salting out, o qual ocorre quando íons induzem a
separação de fases de polímeros em uma solução aquosa (FU, 2021). Ambos os sais
estudados foram capazes de diminui a solubilidade do PEG10K e induzir a
separação de fases. Porém, apesar dos dois aníons possuírem a mesma carga, o
SO32- tem um menor raio iônico fazendo com que coordene um maior
número de moléculas de água ao seu entorno, desta forma, o SO3
2- causa um maior efeito salting out que o S2O4
2-, induzindo a separação de fases em menores concentrações.
Conclusões
Novos SABs formados por PEG 10K, Na2S2O4, e Na2SO3 foram caracterizados em
diversas temperaturas. Para os sistemas estudados a temperatura não interferiu
significativamente na região bifásica, desta forma, a segregação de fases foi
entropicamente dirigida. Avaliando o efeito do aníon, o sulfito foi um melhor
indutor de separação de fases, já que foi necessária uma menor concentração do
mesmo para segregar as fases.
Neste contexto, o desenvolvimento do trabalho possibilitou a obtenção de
novos dados de equilíbrio líquido-líquido, aumentando a gama de SAB disponíveis
para aplicações diversas.
Agradecimentos
À UFVJM, FAPEMIG, CNPq e ao PPGQ.
O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de
Pessoal de Nível Superior – Brasil (CAPES) – Código de Financiamento 001.
Referências
ALVARENGA, B. G.; VIRTUOSO, L. S.; LEMES, N. H. T.; SILVA, L. A.; MESQUITA, A. F.; NASCIMENTO, K. S.; SILVA, M. C. H.; SILVA, L. H. M. Measurement and correlation of the phase equilibrium of aqueous two-phase systems composed of polyethylene(glycol) 1500 or 4000 + sodium sulfite + water at different temperatures. Journal of Chemical & Engineering Data, v. 59, n. 2, p.382-390, 2014.
DA SILVA, L. H. M.; LOH, W. Sistemas aquosos bifásicos: fundamentos e aplicações para partição/purificação de proteínas. Química Nova, v.29, n.6, p.1345-1351, 2006.
FU, C.; LI, Z.; SUN, Z.; XIE, S. A review of salting-out effect and sugaring-out effect: driving forces for novel liquid-liquid extraction of biofuels and biochemicals. Frontiers of Chemical Science and Engineering, v. 15, n. 4, p. 854-871, 2021.
RODRIGUES, G. D.; LEMOS, L. R.; SILVA, L. H. M.; SILVA, M. C. H.; MINIM, L. A.; COIMBRA, J. S. R. A green and sensitive method to determine phenols in water and wastewater samples using an aqueous two-phase system. Talanta, v.80, n.3, p.1139-1144, 2010.
ROSA, P. A. J.; AZEVEDO, A. M.; SOMMERFELD, S. BÄCKER, W. AIRES-BARROS, M. R. Aqueous two-phase extraction as a platform in the biomanufacturing industry: economical and environmental sustainability. Biotechnology Advances, v.29, n.6, p.559-567, 2011.
















