Autores
Castro, H.G.C. (SEEC-RN) ; Moura, M.F.V. (UFRN) ; Dantas, T.N.C. (UFRN) ; Neto, M.H.L. (UFCG)
Resumo
Neste trabalho determinou-se as constantes de velocidade de hidrólise da
sacarose em meio micelar, ou seja, verificou-se a influência do meio micelar
(presença de um tensioativo) sobre as constantes de velocidades de hidrólise da
sacarose, catalisada pelo íons H+, além disso verificou-se a influência do meio
salino (utilizando-se soluções de cloreto de sódio). Utilizou-se como meios
micelares dois tensioativos (um catiônico e um aniônico) em diferentes
concentrações, com e sem adição de sal. Observou-se que não houve diferença
significativa na velocidade de hidrólise da sacarose num meio micelar simples,
apenas houve leve diminuição quando do aumento na concentração do tensioativo, o
que ocorreu tanto para concentração de sacarose a 5% quanto para 10%. Foram
observadas maiores variações.
Palavras chaves
SACAROSE; HIDRÓLISE; TENSIOATIVOS
Introdução
O estudo de reações em meio micelar tem sido de muito interesse devido a sua
grande importância em muitos campos. Por exemplo, muitas das reações que ocorrem
nos organismos vivos ocorrem no meio micelar. Reações que dificilmente
ocorreriam em meio não-micelar, se realizam rapidamente ou diminuem muito seu
tempo de reação num meio micelar adequado. E, ainda, pode-se utilizar um meio
micelar para impedir que uma reação ocorra.
A cinética é a parte da físico-química que trata dos detalhes que ocorrem numa
reação química, tomando como variável fundamental o tempo. A interpretação dos
resultados das medidas de concentração em vários tempos, juntamente com os
resultados obtidos da termodinâmica, permitem a compreensão dos mecanismos das
reações. Assim, a cinética é usada para medir quantitativamente as variações de
concentração que ocorrem com as reações químicas em intervalos de tempo. Essas
medidas podem ser obtidas a partir da observação de propriedades aplicáveis ao
meio reacional. Assim, pode-se utilizar propriedades que sofram variações
conforme os reagentes se transformam em produtos; ou seja, à medida que a
composição do meio reacional sofre variação. Exemplos desses tipos de
propriedades são: medidas de variação de volume num sistema que evolui à pressão
constante; medidas da variação de condutividade elétrica, que ocorrem com a
maioria das reações com espécies iônicas em solução; medida da variação da
rotação óptica, que ocorre quando reagentes ou produtos são opticamente ativos;
medidas da intensidade de luz que atravessa uma solução quando reagentes ou
produtos absorvem luz em diferentes comprimentos de onda.
Neste trabalho, para medir a velocidade de reação entre a sacarose e a água,
catalisada pelo íon H+, utilizou-se a medida do ângulo de rotação da luz
polarizada que atravessa a solução contida no tubo de um polarímetro. A sacarose
é uma substância opticamente ativa, desviando o plano da luz polarizada para a
direita (dextrógira); entretanto, a mistura resultante de sua hidrólise é
levógira. Portanto, pode-se observar o desenvolvimento dessa reação a partir da
medida da rotação óptica, utilizando-se um polarímetro que é um instrumento a
partir do qual se pode obter medidas da rotação do plano da luz polarizada. Um
polarímetro consiste em um tubo reto cujas extremidades estão interrompidas por
dois prismas de Nicol, dispostos em paralelo, onde a função do primeiro consiste
em polarizar a luz recebida de uma fonte (que pode ser uma lâmpada de vapor de
sódio), enquanto, que o segundo indica a medida de quanto foi o ângulo de desvio
da luz polarizada ao atravessar a solução. Foram utilizados vários autores como
base para o desenvolvimento da parte experimental dessa pesquisa, os principais
estão descritos nas referências deste trabalho.
Material e métodos
Na parte experimental, tentou-se verificar a influência da presença de
tensioativos sobre a reação de hidrólise da sacarose, que é uma reação bastante
conhecida e cujo desenvolvimento é fácil de ser observado. A sacarose reage com
água, numa reação que é catalisada pelo íon hidrogênio. Pode-se verificar o
desenvolvimento da reação por meio de um polarímetro, porque, durante a reação,
há inversão do ângulo da rotação da luz plano polarizada, que é positivo no
início da reação e vai diminuindo até se tornar negativo no final da reação.
As micelas são formadas por várias moléculas de tensioativo, chamadas monômeros,
que se ajuntam por interações hidrofóbicas dos componentes da cadeia
hidrocarbonada (forças de Van der Waals) e adquirem estabilidade devido à ação
da dupla camada iônica na superfície da micela. Os monômeros se aglomeram
geralmente em torno de 50 a 100 por micela, considerando a influência do tamanho
da cadeia hidrocarbônica. A estabilidade da micela é afetada por adição de sais
ao meio micelar, em decorrência da ação de íons de carga oposta sobre a parte
iônica da micela. Dependendo da concentração de sal no meio, a micela pode ser
precipitada por quebra da dupla camada iônica. A camada de íons que circunda a
superfície externa da micela (contraíons) faz com que as micelas mantenham-se
afastadas umas das outras por forças de repulsão.
Num meio micelar, as micelas mantêm-se em equilíbrio dinâmico, o que significa
que ao se estabelecer o equilíbrio há formação e destruição de micelas
continuamente. As micelas se desfazem tão rapidamente quanto se formam (na
escala de ms). Além disso, em concentrações maiores que a CMC, as micelas
mantêm-se equilíbrio com o meio, perdendo e recebendo monômeros simultaneamente
(na escala de ms). A influência dos meios micelares nos foi limitada à
observação do aumento ou diminuição na velocidade de consumo de sacarose (g) por
unidade de tempo (min). As misturas foram obtidas de modo que as concentrações
de todas as substâncias
no meio reacional fossem inicialmente conhecidas. Primeiro dissolveu-se a
sacarose (no momento em que ia ser utilizada) em quantidade de água deionizada
inferior à capacidade do tubo do polarímetro (capacidade do tubo do polarímetro
era de 25 cm3); em seguida adicionou-se volume determinado do tensioativo, de
solução salina (para os meios salinos) e, por último, de solução ácida.
Resultado e discussão
Quando a sacarose vai sendo consumida conforme a reação da Figura 01, a medida
do ângulo de rotação indica que há um desvio deste para a esquerda.
Considerando-se 0 o ângulo inicial de rotação e o ângulo ao final da reação,
tem-se que a diferença, 0-, é proporcional à concentração inicial de sacarose.
Então, pode-se determinar a concentração para tempos intermediários, desde que
seja conhecida a concentração de sacarose no tempo infinito (quando se
estabelece o equilíbrio e a medida do ângulo de rotação permanece constante nos
tempos posteriores).
A reação de hidrólise da sacarose, Figura 02, obedece à lei cinética de primeira
ordem. Considerando-se que a reação ocorre em solução aquosa e,
consequentemente, a massa de água no final da reação será quase constante, e o
catalisador presente, íons H+, também permanece constante. Assim, a velocidade
da reação dependerá apenas da concentração de sacarose a uma temperatura
constante. A reação de hidrólise da sacarose é dita de pseudo-primeira ordem
porque, ainda que não seja monomolecular, obedece à lei cinética para reações de
primeira ordem.
A ordem de reação e a equação de velocidade são determinadas a partir de
resultados experimentais. Uma reação obedece à lei cinética de primeira ordem se
sua velocidade de reação, a uma temperatura constante, depende somente da
primeira potência da concentração de um dos reagentes. Muitos fatores podem
alterar a velocidade de uma reação; fatores como temperatura, concentração e
presença de catalisadores podem alterar sensivelmente a velocidade das reações
químicas. A adição de tensioativos a um meio reacional, com consequente formação
de micelas, pode levar a um aumento de muitas ordens de magnitude a velocidade
de algumas reações químicas. A maioria das reações que têm sido investigadas na
presença de micelas ocorrem entre substratos relativamente hidrofílicos ou entre
substratos hidrofóbicos e íons. As micelas podem também limitar o mecanismo de
reações; por exemplo, a fotodescarboxilação de dibenzilcetonas assimétricas que
se obtém três produtos em solução homogênea passa a obter-se um só produto na
presença de micelas de brometo de hexadeciltrimetilamônio (CTAB). Na Tabela 01
apresentam-se os resultados de condutância medidos para as soluções de CTACl a
diversos valores de concentração.
Para a solução de sacarose a 5% em meio SDS houve aumento na velocidade da
reação de hidrólise da sacarose (consumo de sacarose por minuto) para o meio sem
adição de sal, à medida em que se aumentou a concentração do tensioativo. Em
meio salino, no entanto, na concentração de 5 mM não se verificou alteração na
velocidade da reação e para a concentração de 10 mM houve diminuição no consumo
de sacarose em função do tempo.
Para a solução de sacarose a 10% em meio SDS os resultados mantiveram-se quase
constante para as concentrações de tensioativo de 5, 10 e 20 mM, mas houve um
aumento pequeno no consumo de sacarose para a concentração de 40 mM, quando se
trabalhou em meio sem adição de sal. Em meio salino houve diminuição no consumo
de sacarose em função do tempo para todas as concentrações deste tensioativo.
Mas comparando-se os meios micelares entre si, observa-se leve aumento na
velocidade de hidrólise da sacarose com o aumento gradativo na concentração do
SDS.
Para a solução de sacarose a 5% em meio CTACl houve aumento no consumo de
sacarose para concentrações de tensioativo de 5 e 10 mM, enquanto que, em
concentrações de tensioativo de 20 e 40 mM a velocidade de hidrólise da sacarose
diminui, em meio não salino. Em meio salino houve diminuição no consumo de
sacarose para concentrações de 5 e 10 mM de CTACl, e aumento de mais de dez
vezes no consumo de sacarose, em função do tempo, para concentrações de
tensioativo de 20 e 40 mM.
Para a sacarose a 10% em meio CTACl 5 e 10 mM, a velocidade de reação se
manteve constante, enquanto que à concentração de 20 e 40 mM de CTACl houve
aumento na velocidade de hidrólise da sacarose, para o meio não salino. Em meio
salino houve diminuição nas velocidades das reações de hidrólise da sacarose
para todas as concentrações de tensioativo. Todos os experimentos foram
realizados à temperatura constante.
A Tabela 01 mostra os resultados obtidos para k calculados a partir dos dados
utilizados para a construção dos gráficos colocados na Figura 03.

As figuras 1 e 2, mostram a inversão da sacarose e a reação de hidrólise da sacarose
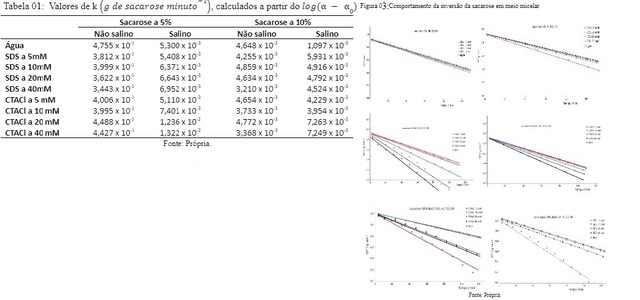
Na Tabela 01 estão os valores da constante k e na Figura 03 os gráficos de Infravermelho, com o comportamento da inversão da sacarose em meio micelar.
Conclusões
Considerando-se os valores obtidos, pode-se afirmar que: Não houve diferença
significativa na velocidade de hidrólise da sacarose num meio micelar simples.
Apenas houve leve diminuição quando do aumento na concentração do tensioativo, o
que ocorreu tanto para concentração de sacarose a 5% quanto para 10%.
Considerando a concentração do tensioativo constante e duplicando-se a
concentração do reagente de 5 para 10% não se observam diferenças. Também não se
observou diferença quando da substituição de um tensioativo aniônico para um
tensioativo catiônico. A mudança de meio não salino para meio salino causou
mudanças significativas principalmente, quando se aumentou a concentração do
tensioativo. O consumo de sacarose (g min-1) aumenta de uma casa decimal para a
sacarose a 5%. Para a sacarose a 10% o aumento no consumo de sacarose foi menor
que 5%. Para a solução de sacarose a 5% em meio SDS houve aumento na velocidade
da reação de hidrólise da sacarose (consume de sacarose por minuto) para o meio
sem adição de sal, à medida em que se aumentou a concentração do tensioativo. Em
meio salino, no entanto, na concentração de 5 mM não se verificou alteração na
velocidade da reação e para a concentração de 10 mM houve diminuição no consumo
de sacarose em função do tempo. Para a solução de sacarose a 10% em meio SDS os
resultados mantiveram-se quase constante para as concentrações de tensioativo de
5, 10 e 20 mM, mas houve um aumento pequeno no consumo de sacarose para a
concentração de 40 mM, quando se trabalhou em meio sem adição de sal. Em meio
salino houve diminuição no consumo de sacarose em função do tempo para todas as
concentrações deste tensioativo. Mas comparando os meios micelares entre si,
observa-se leve aumento na velocidade de hidrólise da sacarose com o aumento
gradativo na concentração do SDS. Para a solução de sacarose a 5% em meio CTACl
houve aumento no consumo de sacarose para concentrações de tensioativo de 5 e 10
mM.
Agradecimentos
Ao CNPq pelas bolsas concedidas.
Referências
MAHAN. B. H.; “QUÍMICA – UM CURSO UNIVERSITÁRIO”, 4ª edição, São Paulo, Editora Edgar Blucher Ltda. 1995.
MOORE. W. J.; “FÍSICO QUÍMICA”, Vol. I, São Paulo, Editora Edgar Blucher, 1976.
MORRISON. R.; Boyd, R.; “QUÍMICA ORG NICA”, 5ª edição, Lisboa, Fundação Caloust Gulbenkian, 1980.
OHLWEILER. O. A.; “QUÍMICA ANALÍTICA QUANTITATIVA”, Vol. 3, Rio de Janeiro, Livros Técnicos e Científicos Editora S. A, 1974.
OLIVEIRA. J. X.; “MÉTODOS ABSORCIOMÉTRICOS”, monografia, UFRN, 1974.
VOGEL. A. L.; “A TEX BOOK OF PRATICAL ORGANIC CHEMISTRY”, 3ª edition; Longmans, 1966.
















