Autores
Ferreira, L.T. (IQ, UNESP - ARARAQUARA) ; Ferreira, P.O. (FC, UNESP - BAURU) ; de Almeida, A.C. (FC, UNESP - BAURU) ; Porto, M.V. (FC, UNESP - BAURU) ; Caires, F.J. (FC, UNESP - BAURU)
Resumo
Uma vez que busca-se melhorar a solubilidade e consequentemente a
biodisponibilidade de um insumo farmacêutico ativo (IFA) as formas sólidas
farmacêuticas são alternativas inovadoras, eficientes e que vão de encontro com as
necessidades da indústria farmacêutica. Este trabalho teve como objetivo
sintetizar e caracterizar o co-amorfo formado pelos fármacos candesartana e
carvedilol, utilizando Espectroscopia no infravermelho com transformada de Fourier
e Difração de raios X pelo método do pó. A partir da síntese Slurry obteve-se um
produto amorfo conforme mostrado pelo difratograma de raios X. A análise do
espectro na região do infravermelho indica que os fármacos interagem pela pelos
grupos funcionais ácido carboxílico e pirrol.
Palavras chaves
drug-drug; candesartana; co-amorfo
Introdução
As formulações sólidas são de grande interesse para a indústria farmacêutica
pois apresentam menores custos de fabricação, no entanto os fármacos na forma
sólida administrados por via oral dependem de sua liberação, solubilização e
permeabilidade através das membranas do trato gastrointestinal (PRADO, ROCHA, p.
2080, 2015; RODRIGUES, 2016; MORISSETTE et al p.275, 2004). Estima-se que 40%
dos medicamentos existentes e 90% das novas moléculas apresentam baixa
solubilidade aquosa, portanto necessitam de manipulações para serem
administrados (TAMBOSI et al, p.23, 2018; KALEPU et al, p. 442,
2015).
Os sistemas fármaco-fármaco (do inglês Drug-Drug) além de permitirem
melhoras das propriedades físico-químicas dos IFA, atendem ao fato de que
terapias combinadas são amplamente prescritas na prática clínica, despertando
grande interesse da indústria farmacêutica. Portanto este trabalho teve como
objetivo sintetizar um novo sistema formado entre os fármacos candesartana e
carvedilol (EESAM et al, p. 1, 2020).
O insumo farmacêutico ativo (IFA) candesartana é classificado como classe IV,
segundo o SCB (SRIVASTAVA et al, p. 62, 2019). O IFA apresenta eficácia
no tratamento de hipertensão, insuficiência cardíaca, entre outras doenças
(CERNES et al, p. 749, 2011), no entanto apresenta baixa
biodisponibilidade oral (menor que 5%) limitando sua eficácia clínica. O IFA
carvedilol apresenta propriedades anti-hipertensivas e diuréticas, é
classificado como classe II, segundo o SCB (FERNANDES et al, p. 373,
2019), e apresenta uma baixa biodisponibilidade oral de aproximadamente 25%
(EESAM et al, p. 1, 2020; LEONETTI et al, p. 307, 2012).
Material e métodos
Síntese Slurry: A síntese foi realizada pelo método Slurry. O qual é um
processo de transformação de fase mediada por solução, realizado pela formação
de uma solução supersaturada sob agitação constante. Os fármacos candesartana e
carvedilol, em proporção molar 1:1, foram adicionados em 400 μL de solvente
etanol e mantidos em sistema fechado sob agitação magnética constante, em 300
rpm, durante 12 horas. Em seguida o frasco aberto foi mantido em dessecador.
Difração de raios X do pó (DRXP): Os difratogramas de raios X foram
obtidos pelo Difratômetro Siemens DMAX 2000 utilizando-se tubo de cobre,
submetido a 40 kV, corrente de 20 mA, Cu κα, λ = 1,5406 Å.
Espectroscopia no infravermelho com transformada de Fourier (FTIR): Os
espectros no infravermelho foram obtidos no espectrômetro Vertex 70, da Bruker,
através da técnica de refletância total atenuada (ATR) com cristal de diamante,
no intervalo de a 4000-400 cm-1, resolução de 4 cm-1 e 32
varreduras por espectro.
Resultado e discussão
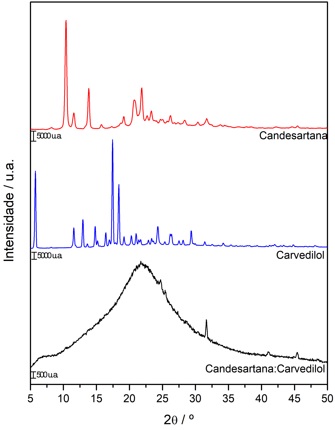
Na Figura 1, são apresentados os difratogramas de raios X da
candesartana, carvedilol de do co-amorfo candesartana-carvedilol, os principais
picos de difração observados para a candesartana aparecem em 10,4º, 11,6º 13,8º,
20,7º e 21,9º, enquanto os principais picos de difração observados para o
carvedilol aparecem em 5,8º, 11,6º, 12,9º, 17,4º e 18,8º, no entanto no
difratogramas de raios X do co-amorfo candesartana-carvedilol esses picos não
são observados, o difratograma apresenta uma halo largo característico de
material amorfo, indicando a amorfização da amostra pelo processo de síntese. Na
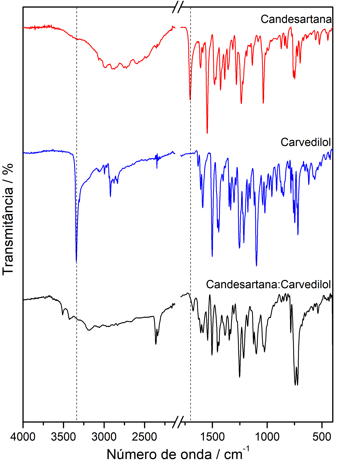
Figura 2, são apresentados os espectro de infravermelho da candesartana,
carvedilol de do co-amorfo candesartana-carvedilol, a principal banda observada
no espectro de infravermelho da Candesartana é a banda intensa em 1704
cm-1, referente ao estiramento C=O do ácido carboxílico (ISLAS et
al, p. 143, 2012; PAVIA et al, 2014). No espectro de infravermelho do
carvedilol a principal banda observada é o estiramento N-H da amina secundária
do grupo pirrol em 3341 cm-1 (IBRAHIM et al, p. 873, 2018). No
espectro do co-amorfo candesartana-carvedilol observa-se o estiramento C=O da
candesartana deslocado para valores de 1673 cm-1 e o estiramento N-H
da amina secundária do grupo pirrol do carvedilol deslocado para valores de 3430
cm-1, além da diminuição considerável da intensidade das bandas. Os
deslocamentos indicam que os IFA interagem pelos grupos funcionais citados,
formando um sistema co-amorfo e não apenas uma mistura física de dois amorfos.
Conclusões
A método Slurry foi eficiente na síntese do co-amorfo fármaco-fármaco
candesartana-carvedilol 1:1. O co-amorfo apresentou um difratograma diferente dos
difratogramas dos precursores e típico de um material amorfo,
indicando a amorfização da amostra. A formação de interações entre os fármacos na
formação do co-amorfo candesartana-carvedilol pode melhorar questões relacionadas
a estabilidade termodinâmica (comumente encontradas em fármacos amorfos) assim
como ocorre em dispersões fármaco-polímero (VRANI, p. 35, 2004; TEJAA et
al, p. 70, 2016).
Agradecimentos
Agradecemos a CEPID/CDMF Unesp-Bauru (FAPESP Processo 2013/07296-2), FAPESP
(Processo 18/24378-6; Processo 024/2012 Pró-equipamento Unesp - Bauru), CAPES
(Processo 88887.373555) e CNPq (Processo 422893/2021-8 e 317282/2021).
Referências
CERNES, R.; MASHAVI, M.; ZIMLICHMAN, R. Differential clinical profile of candesartan compared to other angiotensin receptor blockers. Vascular Health and Risk Management, 749, 2011.
EESAM, S.; BHANDARU, J. S.; NALIGANTI, C.; BOBBALA, R. K.; AKKINEPALLY, R. R. Solubility enhancement of carvedilol using drug–drug cocrystallization with hydrochlorothiazide. Future Journal of Pharmaceutical Sciences, no 1, 1-13, 2020.
FERNANDES, G. J.; RATHNANAND, M.; KULKARNI, V. Mechanochemical synthesis of carvedilol cocrystals utilizing hot melt extrusion technology. Journal of Pharmaceutical Innovation, no 4, 373-381, 2019
IBRAHIM, T. M.; ABDALLAH, M. H.; EL-MEGRAB, N. A.; EL-NAHAS, H. M. Upgrading of dissolution and anti-hypertensive effect of Carvedilol via two combined approaches: self-emulsification and liquisolid techniques. Drug Development and Industrial Pharmacy, no 6, p. 873-885, 2018.
ISLAS, M. S.; FRANCA, C. A.; ETCHEVERRY, S. B.; FERRER, E. G.; WILLIAMS, P. A.; MARÍA, S. Computational study and spectroscopic investigations of antihypertensive drugs. Vibrational Spectroscopy, 143-151, 2012.
KALEPU, S.; NEKKANTI, V. Insoluble drug delivery strategies: review of recent advances and business prospects. Acta Pharmaceutica Sinica B, no 5, 442-453, 2015.
LEONETTI, G,; EGAN, C. G. Use of carvedilol in hypertension: an update. Vascular health and risk management, 307-322, 2012.
MORISSETTE, S. L.; ALMARSSON, O.; PETERSON, M. L.; REMENAR, J. F.; READ M. J; LEMMO, A. V.; ELLIS, S.; CIMA M. J.; GARDNER, C. R. High-throughput crystallization: polymorphs, salts, co-crystals and solvates of pharmaceutical solids. Advanced drug delivery reviews, no 3, 275-300, 2004.
PAVIA, D. L.; LAMPMAN, G. M.; KRIZ, G. S.; VYVYAN, J. A. Introduction to spectroscopy. Cengage learning. 2014
PRADO, L. D.; ROCHA, H. V. A. Estado sólido na indústria farmacêutica: Uma breve revisão. Revista Virtual de Química, no 6, 2080-2112, 2015.
RODRIGUES, A. L. F. Bicalutamida: um contributo para a investigação do processo de cristalização e de co-cristalização. 2016. Tese de Doutorado.
SRIVASTAVA, D.; FATIMA, Z.; KAUR, C. D.; TULSANKAR, S. L.; NASHIK, S. S.; RIZVI, D.A.; Pharmaceutical cocrystal: a novel approach to tailor the biopharmaceutical properties of a poorly water soluble drug. Recent Patents on Drug Delivery & Formulation, no 1, 62-69, 2019.
TAMBOSI, G.; COELHO, P. F.; LUCIANO, S.; LENSCHOW, I. C. S.; ZÉTOLA, M.; STULZER, H. K.;PEZZINI, B. R. Challenges to improve the biopharmaceutical properties of poorly water-soluble drugs and the application of the solid dispersion technology. Matéria (Rio de Janeiro), 23, 2018.
TEJAA S.B.; PATILA S. P.; SHETEA G.; PATELB S.; BANSAL A. K.. Drug-excipient behavior in polymeric amorphous solid dispersions. Journal of Excipients and Food Chemicals, no 3, 70-94, 2016.
VRANI, E. Amorphous pharmaceutical solids. Bosnian Journal of Basic Medical Sciences. no 3, 35-39, 2004.
















