Autores
Lasmar, M.C.S. (UFPA) ; Bezerra, F.F. (UFPA) ; Silva, A.S. (UFPA) ; Carneiro, A.S. (UFPA) ; Pantoja, S.S. (UFPA) ; Gomes, C.D.P. (UFPA) ; Santos, T.P.A. (UFPA)
Resumo
A hipertensão arterial é uma doença que tem alta incidência sobre a população,
caracterizada pela elevação da pressão nas artérias. O controle da qualidade de
medicamentos é imprescindível pois é um meio de assegurar a eficácia terapêutica
dos mesmos. Este trabalho foi desenvolvido com o objetivo de verificar o teor de
captopril 25 mg em 3 laboratórios diferentes (medicamento similar), sendo
comprado 3 lotes de cada fabricante. Foram feitos testes para a determinação do
peso médio e doseamento por titulação iodimétrica. Os teores de captopril nas
amostras analisadas variaram de 98,3% a 122,34%. com coeficiente de variação
percentual (CV%) de 0,1% a 1,69%. Assim, cinco das amostras analisadas
encontraram-se em conformidade com as normas regulatórias para o teor de
captopril.
Palavras chaves
Controle de qualidade ; Medicamento; Titulometria
Introdução
A hipertensão arterial é uma doença que tem alta incidência sobre a população,
caracterizada pela elevação da pressão nas artérias em relação à medida de
referência de 120/80 mmHg, a qual requer cuidados para evitar problemas de saúde
posteriores, como, por exemplo, doenças cardíacas e acidentes vascular cerebral.
Entre estes cuidados, destaca-se o uso de medicamentos para ajudar a controlar a
pressão, além de prática de atividades físicas, dieta e hábitos saudáveis
(BRASIL, 2014). Dentre os fármacos mais utilizados no tratamento da Hipertensão
Arterial encontra-se o Captopril, um princípio ativo dos medicamentos Capox®,
Captosen® e Captolab®. De acordo com a definição da ANVISA, um medicamento
similar é aquele que contém os mesmos princípios ativos, mesma concentração,
forma farmacêutica, via de administração, posologia e indicação terapêutica,
equivalente ao medicamento registrado no órgão federal responsável pela
vigilância sanitária; podendo diferir somente em características relativas ao
tamanho e forma do produto, prazo de validade, embalagem, rotulagem, excipientes
e veículo, devendo sempre ser identificado por nome comercial ou marca. As
resoluções RDC 133 e 134 visam garantir que os medicamentos similares
tenham o mesmo comportamento no organismo e possuam as mesmas características de
qualidade que o medicamento de referência (BRASIL, 2003). Dessa maneira, este
trabalho foi desenvolvido com o objetivo de avaliar a dosagem de Captopril em
amostras de medicamentos similares disponíveis no mercado para a população,
verificando-se se estão de acordo com a bioequivalência exigidas pela ANVISA.
Material e métodos
As amostras foram compradas em farmácias de Belém-PA, usando como critério de
inclusão todos os medicamentos classificados como “similar” sendo de 3
laboratórios diferentes e 3 lotes de cada laboratório, posteriormente foram
levadas até o Laboratório de Física Aplicada à Farmácia em julho de 2022. As
amostras foram mantidas sobre o lacre de origem, bem como sob as condições de
conservação orientadas pelo fabricante do produto. Utilizou-se da farmacopeia
brasileira (BRASIL, 2010) em conjunto com a monografia do Captopril segundo a
farmacopeia brasileira (BRASIL, 2002) para a obtenção de padrões dos comprimidos
para a análise e como guia para escolha das práticas a serem adotadas quanto à
determinação do princípio ativo. As amostras foram rotuladas (SA1, SA2, SA3,
SB1, SB2, SB3, SC1, SC2, SC3) e foram submetidas às seguintes análises:
determinação do peso médio: a partir de uma cartela de 30 unidades, foram
selecionados 20 comprimidos para determinação de massa exata em uma balança
analítica. Estes foram pesados individualmente e feitos em triplicata. Dosagem:
a determinação de captopril nas amostras foi realizada por método titulométrico
utilizando KIO3 0,001M como titulante, (VALENTINI et al. 2004). Um comprimido de
Captopril foi triturado em frasco tipo penicilina e transferido para um
Erlenmeyer de 250 mL. O material triturado foi solubilizado em 25 mL de água e
acrescentado 2,5 mL de H2SO4 10% (v/v), 0,25 mL de solução de amido 1% e 250 mg
de Iodeto de Potássio (KI). A solução foi titulada até a obtenção de coloração
azul. Os resultados expressos em termos de média, desvio e coeficiente de
variação percentual. Para compensação de cálculo, um branco foi preparado. O
método estatístico (ANOVA) foi conduzido para verificar as variâncias entre as
médias das amostra.
Resultado e discussão
Os resultados estão na tabela 1. Diante dos dados obtidos, constatou-se que
nenhum comprimido teve seu peso acima ou abaixo do limite de variação (10%) em
relação à média, como especifica a Farmacopeia Brasileira (2010). Os dados
obtidos na determinação do teor médio de captopril revelaram que as amostras
(SA1, SA2, SA3; SB1, SB2, SB3 e, SC1, SC3) estão dentro das normas estabelecidas
pela Farmacopeia Brasileira (2010) que é de 90 a 110% de captopril em relação ao
valor declarado pelo fabricante, sendo que os resultados dessas amostras
variaram entre 98,30% e 109,47%, demonstrando que estas formulações
farmacêuticas encontram-se adequadas quanto ao teor do princípio ativo. Apenas a
amostra SB2 (122,34%) apresentou níveis de teor do captopril acima dos padrões
vigentes. Em estudo realizado por Pugens et al. (2008) observou-se que o teor de
captopril no medicamento de referência foi de 26,6 mg/unid que equivale a 106,4%
de teor do medicamento. No estudo realizado por Dias (2005), os teores do
medicamento encontrados em amostras genéricas e similares locais, foi de 101,75%
a 105,71% para o medicamento genérico e para o similar variou entre 103,65% a
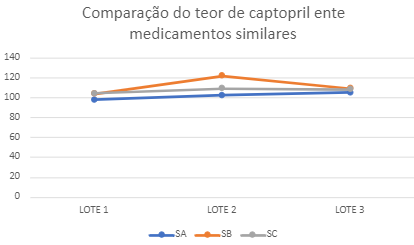
106,44%. Para a comparação das amostras foi utilizado o método estatístico
ANOVA, e ao compara-las identificou que não há diferença significativa entre as
amostras como exposto no gráfico 1.
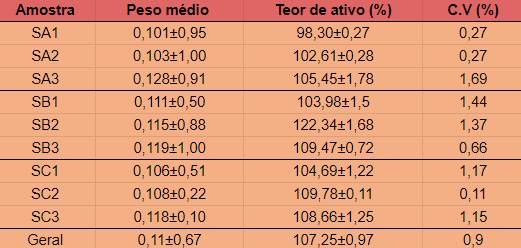
C.V (%)= coeficiente de variação percentual.
Conclusões
A avaliação da qualidade de medicamentos farmacêuticos disponíveis no mercado é
imprescindível, em razão de proporcionar mais segurança aos usuários. De acordo
com os resultados obtidos pode-se concluir que as amostras AS1, AS2, AS3, SB1,
SB3, SC1, SC2, SC3 estão de acordo com os parâmetros da Farmacopeia Brasileira
(2010) em relação ao peso médio e o teor do medicamento, no entanto apenas a
amostra SB2 revelou níveis de teor de captropil elevados para os padrões
estabelecidos. Pois, é importante avaliar todos os parâmetros exigidos pela
legislação brasileira para aprovação de um medicamento.
Agradecimentos
UFPA, UFRA, LAFFA.
Referências
ANVISA. Disponível em: < http://portal.anvisa.gov.br> acesso em: 10 de julho de 2022.
MINISTÉRIO DA SAÚDE. Disponível em: <http://portalms.saude.gov.br/images/pdf/2014/agosto/28/Captopril.pdf.> Acesso em: 28 de junho de 2022.
BRASIL, 2002. Farmacopeia Brasileira 4. Ed. – São Paulo: Atheneu Editora, 2003.
BRASIL, 2010. Farmacopeia Brasileira 5. Ed., volume 1 - Agência Nacional de Vigilância Sanitária. Fundação Osvaldo Cruz. Brasília: Anvisa, 2010.
BRASIL. Mistério da Saúde. Hipertensão Arterial Sistêmica: caderno de atenção básica n. 37. Brasília: Ministério da Saúde, 2013.
DIAS, C, R; BATISTA, A, C, M; AQUINO, C, F; MENEZES,F, S, R. AVALIAÇÃO DA QUALIDADE DE COMPRIMIDOS DE CAPTOPRIL:ESTUDO COMPARATIVO ENTRE MEDICAMENTOS GENÉRICO E SIMILAR. Revista Saúde dos Vales. 2020.
PUGENS, A. M; DONADUZZI, C. M; MELO, E. B. Controle de qualidade total
equivalência farmacêutica de três apresentações de captopril. Revista Eletrônica de Farmácia. v. 5, n. 1, p. 32-45, 2008.
Resolução da Diretoria Colegiada – RDC n° 134 de 13 de junho de 2001, Boas Práticas de Fabricação de Medicamentos. Diário Oficial da União, Poder Executivo, Brasília, DF.
Resolução da Diretoria Colegiada - RDC nº 133 de 15 de dezembro de 2016. Diário Oficial da União, Poder Executivo, Brasília, DF.
VALENTINI, S. R.; SOMMER, W. A.; MATIOLI, G. Validação de métodos analíticos na quantificação de comprimidos de Captopril-comparação de metodologias para um programa de garantia de qualidade. Acta Scientiarum. Health Sciences, v. 26, n. 2, p. 357-364, 2004.
















