Autores
Junior, P.S.B. (UFS) ; Sobrinho, A.A.S. (UFS) ; Dorea, H.S. (UFS)
Resumo
Esse trabalho visou o desenvolvimento e a validação de um método por Dispersão de
Matriz em Fase Sólida (MSPD) com Óxido de Grafeno Magnético (OGM) como suporte
sólido) para determinar e quantificar pesticidas (Clorpirifós e Permetrina) em
amostras de hortaliças. A seleção dos pesticidas usados na cultura de hortaliças
na região, os analitos selecionados, bem como as condições cromatográficas foram
definidas. Para o clorpirifós foi obtida uma recuperação de 26,7% e um RSD < 15%,
no entanto, para a permetrina a recuperação de 93,9% e RSD < 3%. A acetonitrila
foi escolhida como solvente de eluição e o acetato de etila, C18, carvão ativado
e sulfato de sódio anidro como agentes de limpeza no processo de clean-up da
clorofila.
Palavras chaves
MSPD; OGM; PESTICIDAS
Introdução
Atualmente, é perceptível a constante busca da humanidade pela sustentabilidade.
As áreas científicas vêm procurando reduzir continuamente o impacto ambiental,
inclusive a química, com o surgimento da química verde. A Química Verde é
definida como um "projeto para produtos químicos e processos que reduzam ou
eliminem o uso ou geração de substâncias perigosas. A Química Verde aplica-se ao
longo do ciclo de vida de um produto químico, incluindo projeto, fabricação, uso
e disposição final”. (USEPA, 2017).
Para atender essa nova demanda sustentável, algumas técnicas foram surgindo na
intenção de substituir técnicas com pouco cunho sustentável. A dispersão de
matriz em fase sólida (MSPD) é grande exemplo, tal técnica surgiu como
alternativa para suprir limitações encontradas na extração por Soxhlet,
reduzindo drasticamente o consumo de solventes orgânicos, diminuindo a
quantidade da amostra, reduzindo o tempo de extração e o número de etapas
envolvidas na preparação. (DOREA, 2015)
Este método é utilizado para amostras sólidas e/ou semi-sólidas, viscosas ou
não. Onde consiste na dispersão da amostra com auxílio de um suporte sólido que
atua como abrasivo causando a ruptura da estrutura física da amostra, a qual
sofre uma dispersão na superfície do material suporte, formando uma nova fase o
que proporciona o isolamento dos analitos em várias matrizes. Em seguida, essa
fase é transferida para uma coluna para posterior eluição com solvente orgânico
apropriado. (DOREA, 2015; CALDAS et al., 2013; WIANOWSKA; GIL, 2019)
A técnica por MSPD possui diversas vantagens, como a seletividade, a
versatilidade e a eficiência do método analítico, sem perder a simplicidade e o
menor custo, tornando uma técnica atrativa para as análises multirresíduos de
rotina. (DOREA, 2015)
Atualmente, um material inovador a ser utilizado como suporte sólido nessa
técnica é o grafeno. Como o grande sistema de elétrons deslocalizados do grafeno
pode formar uma forte interação de empilhamento com algumas moléculas orgânicas,
ele pode ser servido como um bom adsorvente. (CHATZIMITAKOS; KARALI; STALIKAS,
2019; LU et al., 2014)
Desde que foi descoberto em 2004, tal composto vendo sendo explorado para uma
ampla gama de aplicações em diversos campos científicos. Além de ser facilmente
obtido e ter baixo custo, tem propriedades extraordinárias, como grande área de
superfície específica, forte hidrofobicidade, versatilidade e sintonia química e
alta estabilidade química. (LU et al., 2014)
Uma das maiores aplicações de MSPD é a determinação de pesticidas. Tais
compostos estão presentes nosso dia-a-dia em larga escala, principalmente no
âmbito alimentar, visto que para acompanhar o aumento exponencial da população
mundial a indústria alimentícia adotou a utilização de produtos químicos
sintéticos, culminando em um uso intensivo de pesticidas ao redor do mundo.
(CARVALHO, 2017)
Os pesticidas são categorizados com base na estrutura química, origem e
organismo alvo. Grande parte dos pesticidas são de origem sintética, esses
possuem o poder de matar as pragas diretamente. Eles são principalmente
classificados como inseticida, herbicida, fungicida, rodenticida, nematicida.
(NARENDERAN; MEYYANATHAN; BABU, 2020)
Segundo a FAOSTAT (2019), o Brasil está entre um dos dez principais países em
consumo de pesticidas, entre os anos de 2015 e 2019. No país, os pesticidas
recebem a denominação de agrotóxicos, que de acordo com o Decreto nº 4.074, de 4
de janeiro de 2002, são definidos como:
Produtos e agentes de processos físicos, químicos ou biológicos, destinados ao
uso nos setores de produção, no armazenamento e beneficiamento de produtos
agrícolas, nas pastagens, na proteção de florestas, nativas ou plantadas, e de
outros ecossistemas e de ambientes urbanos, hídricos e industriais, cuja
finalidade seja alterar a composição da flora ou da fauna, a fim de preservá-las
da ação danosa de seres vivos considerados nocivos, bem como as substâncias e
produtos empregados como desfolhantes, dessecantes, estimuladores e inibidores
de crescimento.
Em sua maioria, o consumo de pesticidas provem dos alimentos agrícolas,
pois a maioria dos consumidores escolhem com base na aparência mais atraente. As
hortaliças são um bom exemplo desse consumo, por serem uma parte importante de
uma dieta saudável devido à presença significativa de quantidade de vitaminas,
fibras e minerais. (LOZOWICKA et al., 2016)
Com isso, para garantir a segurança alimentar e evitar a exposição
desnecessária do consumidor a resíduos de pesticidas, foram estabelecidos
limites de máximos de resíduos (LMR). No Brasil o órgão responsável pela
regulamentação dos LMRs é o Ministério da Agricultura, Pecuária e Abastecimento
(MAPA). Outro órgão reconhecido mundialmente por regulamentar LMRs é a Codex
Alimentarius Commission, responsável pela CODEX ALIMENTARIUS, que se trata de
uma coleção de padrões, diretrizes e códigos de prática alimentares.
Material e métodos
Primeiramente, em um béquer de vidro, 1g de pó de grafite e 6g de permanganato
de potássio foram misturados e, em seguida, 140mL de uma mistura 9:1 de ácido
sulfúrico concentrado: ácido fosfórico concentrado foi adicionada. A mistura foi
agitada durante 24 h a 50 º C. Após resfriar até a temperatura ambiente, a
mistura foi colocada em banho de gelo e foi adicionada 130 mL água fria contendo
6 mL peróxido de hidrogênio concentrado. Após 30 min de agitação, a mistura foi
deixada em repouso durante a 5 dias e 4 noites. O sobrenadante foi decantado e
adicionou-se 30 mL de ácido clorídrico concentrado. A mistura foi agitada
durante 2 horas à temperatura ambiente e depois centrifugada durante 5 minutos,
a 3000 rpm para decantar o sobrenadante. O sólido remanescente foi lavado várias
vezes com água bidestilada (DDW) até o pH ser 7. Finalmente, o sólido foi lavado
com 25 mL de etanol puro 3 vezes, seguido de centrifugação.
Para a síntese do óxido de grafeno magnético (OGM), foi adicionado 0,5 g
de óxido de grafeno (OG) a 100 mL de DDW em um béquer de vidro e foi levado ao
ultrassom por 1 hora. A dispersão foi aquecida a 80 ° C e desgaseificada sob
fluxo de nitrogênio, por 10 min. Em seguida, 20 mL de DDW, contendo 0,7 g de
cloreto férrico e 0,42 g de cloreto ferroso foram adicionados lentamente à
dispersão acima, sob fluxo de nitrogênio e a mistura foi agitada vigorosamente.
Em seguida, foram adicionados 6 mL de uma solução concentrada de amoníaco e
posteriormente a mistura foi agitada durante 30 min. O óxido de grafeno
magnético foi colhido com imã de neodímio, lavado três vezes com DDW e três
vezes com etanol. Por fim, o nanomaterial foi seco em um forno a 70 ° C, durante
a 12 horas, moído até um pó fino em um almofariz e armazenado em temperatura
ambiente.
Colocou-se 1g de couve em um almofariz, e foi adicionado 500 µL do mix de
pesticidas. Em seguida adicionou-se 0,3 do OGM e prosseguiu-se para etapa de
maceração/mistura por 2 minutos. Após a mistura/maceração, foram adicionados 10
mL água destilada e transferida toda a mistura para um Becker. Com auxílio de um
imã de neodímio o nanossorvente foi separado e coletado, este foi lavado duas
vezes com água bidestilada, posteriormente transferido para um tubo de ensaio e
secado suavemente por uma corrente de nitrogênio. Foram adicionados 3 mL de
acetonitrila (solvente de eluição) ao tubo, e foi levada a mistura ao ultrassom
por 90 s. O nanosorvente foi separado novamente usando um imã de neodímio e
concentrou-se o solvente orgânico até 1000 µL, em rotoevaporador. Antes da
injeção no cromatógrafo, o solvente passou por um processo de clean up para a
diminuição dos níveis de clorofila proveniente das hortaliças, esse processo
consistiu na eluição do concentrado com 10 mL (duas vezes de 5 mL) de acetato de
etila, em um coluna contendo lã de vidro, 200 mg de C18,200 mg de carvão ativado
e um fio de sulfato de sódio anidro, seguinte a eluição o solvente foi
concentrado em rotoevaporador até 1mL e GC-MS.
Resultado e discussão
A priori, os pesticidas utilizados nesse estudo (Abamectina, Acetamiprido,
Cipermetrina, Clorpirifós, Deltametrina, Imidacloprido e Permetrina) foram
escolhidos diante da disponibilidade no laboratório e por meio de uma grande
pesquisa de campo virtual, onde foram contactados agrônomos do estado para
realizar um levantamento dos pesticidas mais utilizados em hortaliças na região,
consonante a informações presentes em sites oficiais como CODEX ALIMENTARIUS e
Ministério da Agricultura, Pecuária e Abastecimento (MAPA).
A posteriori, fez-se necessária a identificação de cada pesticida a partir dos
padrões disponíveis, para isso, cada um foi injetado no GC-MS em modo Scan, em
seguida, os cromatogramas de cada composto em questão foram analisados a partir
dos dados de massa/carga presentes na literatura. Desse modo, apenas dois dos
sete pesticidas escolhidos foram identificados nos padrões injetados, sendo
eles, o clorpirifós e a permetrina. Com base em estudos de artigos, notou-se que
abamectina, acetamiprido e imidacloprido não são compatíveis com o limite de
temperatura dos cromatógrafos disponíveis para uso, já a deltametrina e
cipermetrina não foram detectados nos cromatogramas feitos. A causa provável é a
degradação dos padrões.
Por fim, após o processo de identificação dos padrões, foi estabelecido o uso
apenas dos dois pesticidas identificados, para produção do mix de pesticidas a
ser usado no projeto em questão.
Preparação da Amostra
Com o fim das análises qualitativas, iniciou-se o preparo da amostra, com base
em pesquisas bibliográficas a couve foi escolhida para os estudos iniciais e
definido como matriz padrão, devido aos motivos expostos no item 10, não foi
possível concluir o estudo com as demais hortaliças.
Alguns problemas foram notados no decorrer do procedimento de preparação da
amostra, o primeiro deles foi o tamanho da couve usada, seu tamanho grosseiro
dificultou a extração além de causar muita sujeira, como pode ser visto na
Figura 1.
Figura 1 - Imagens representativas das primeiras etapas do procedimento MSPD
desenvolvido: (1) OGM e amostra de couve previamente fortificada, (2) OGM e
couve após o processo de mistura/maceração e adição de água destilada, (3)
atração da mistura de OGM e couve pelo imã de neodímio, (4) nanossorvente
separado e coletado.
Para solucionar esse problema, triturou-se a couve antes da extração, assim
facilitando a extração. Contudo, a trituração deveria ser de forma que
mantivesse a matriz o próximo da sua originalidade, então, para tal procedimento
foi necessária a utilização de um triturador manual, adquirido para o projeto.
Outra questão foi a recuperação do OGM após o processo de extração, pois por se
tratar de um sorvente muito fino e adaptável ele se liga bastante aos resquícios
da couve. Com isso, foi implementado o processo de peneiramento com passagem de
água destilada, para que haja a separação entre OGM e os restos da couve, como
pode ser visto na Figura 2.
Figura 2 - Resquícios da couve após o processo de peneiramento.
Por fim, verificou-se a ineficácia do clean-up proposto incialmente no plano de
trabalho, sendo assim, o procedimento foi alterado e otimizado. Ao comparar o
resultado antes e depois da otimização nota-se a grande melhoria na limpeza da
amostra, a grande parte da clorofila presente na amostra foi separada, como pode
ser visto na Figura 3. A adição de carvão ativado à coluna foi o fator principal
para essa melhoria, por possuir um grande poder filtrante, retendo diversas
impurezas.
Figura 3 - Comparação entre as amostras: (1) depois da mudança no procedimento,
(2) antes da mudança no procedimento.
O sucesso no processo de clean-up é de suma importância para todo o
procedimento, pois a clorofila presente na amostra é um interferente na análise
cromatográfica.
Linearidade, Recuperação, Precisão e Limite de Quantificação
Por motivos expressos no item 10, o desenvolvimento da curva de calibração foi
feito no GC-FID. Inicialmente foi necessária identificação do tempo de retenção
dos pesticidas, onde fez necessária a injeção de diferentes concentrações do mix
de pesticidas, dessa forma, foi possível analisar as áreas dos picos,
verificando quais seguiam o padrão de mudança da concentração, expressadas na
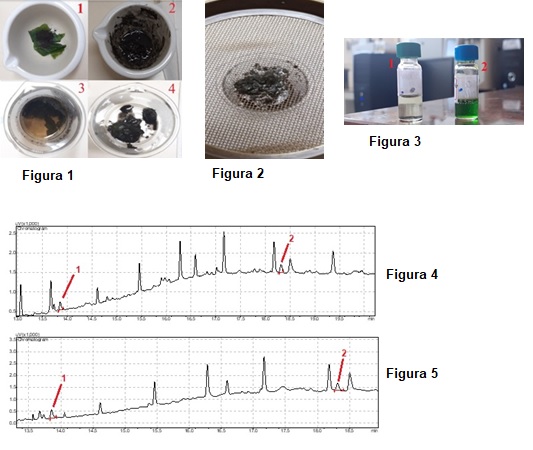
Tabela 2 e nas Figuras 4 e 5.
Tabela 2 – Detalhes acerca do tempo de retenção e áreas dos pesticidas no GC-
FID.
Figura 4 – Cromatograma referente ao padrão de 150 pbb: (1) clorpirifós, (2)
permetrina.
Figura 5 – Cromatograma referente ao padrão de 200 pbb: (1) clorpirifós, (2)
permetrina.
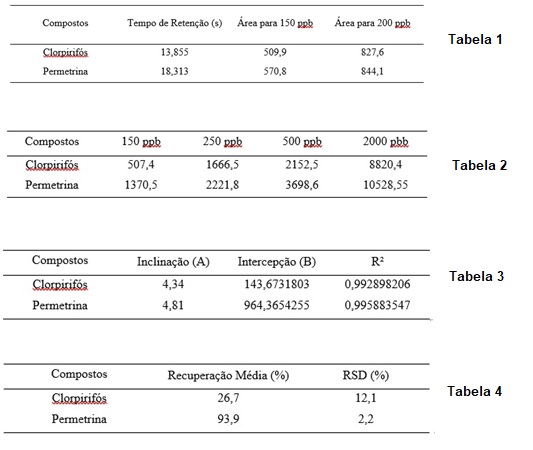
Após identificar os tempos de retenção, os pontos da curva de calibração foram
preparados e injetados em duplicata, foram eles 150, 250, 500 e 2000 ug/L. Em
seguida, foram feitas as médias das as áreas recolhidas de cada ponto, como pode
ser visto na Tabela 3.
Tabela 3 – Médias das as áreas de cada ponta da curva de calibração, em
duplicata.
(1)
Tabela 4 – Características determinadas da curva de calibração.
Ao verificar os valores de R2 de ambos pesticidas, nota-se que os
resultados são linearmente proporcionais à concentração do analito, enquadrados
na faixa analítica especificada. Desse modo, com as curvas de calibração, o
extrato da amostra foi injetado em duplicata, sendo assim, possível determinar a
recuperação média e o desvio padrão relativo (RSD) de cada pesticida, vide na
Tabela 5, a partir das áreas detectadas em ambas injeções.
Tabela 5 – Recuperação média e desvio padrão relativo de cada pesticida.
Os resultados das recuperações evidenciam a falta de sensibilidade da análise
por meio do GC-FID ao comparamos a baixa eficiência de extração descrita para o
clorpirifós com a ótima recuperação da permetrina. Contudo, os resultados
obtidos para RSD de ambos os compostos demonstram a proximidade entre várias
medidas efetuadas, ou seja, precisão do método. Sendo assim, com tais resultados
obtidos é evidente o quanto o método desenvolvido é promissor.
O Limite de Quantificação (Limit of Quantitation, LOQ) foi definido como o
primeiro ponto da curva, ou seja, 150 ug/L para uma amostra de 1g de couve, o
que equivale a um LOQ de 150 ug/Kg.
Conclusões
A experiência adquirida proporcionou um maior domínio da técnica proposta. O
mapeamento dos pesticidas vendidos comercialmente no mercado de Sergipe
apresentou uma gama de informações diversificadas e importantes para este projeto
e para futuros trabalhos a serem realizados. A elaboração de todo o procedimento
aplicado foi algo inovador para o cenário da região, por se tratar de um
adsorvente recente, a síntese do OGM demonstrou ótimos resultados. A recuperão de
26,7% e com RSD < 15% obtidos para o clorpirifós mostra que esse composto precisa
ser melhor estudado, no entanto, para a permetrina a recuperação de 93,9% e RSD <
3% demonstra o potencial do método mesmo com essa adversidade. A partir disso
torna-se perceptível que a técnica de extração por MSPD com o OGM é promissora e
que pode ser utilizada para as determinações dos analitos selecionados nesse
estudo para as amostras de hortaliças.
Agradecimentos
Ao Condomínio de Laboratórios de Química (CLQM) da UFS pelo uso do GC-MS e
GC/FID.
Referências
ARMENTA, S.; GARRIGUES, S.; DE LA GUARDIA, M. Green Analytical Chemistry. TrAC - Trends in Analytical Chemistry, v. 27, n. 6, p. 497–511, 2008.
CALDAS, S. S. et al. Avanços recentes da MSPD para extração de resíduos de agrotóxicos, PPCPs, compostos inorgânicos e organometálicos. Scientia Chromatographica, v. 5, n. 3, p. 190–213, 2013.
CARVALHO, F. P. Pesticides, environment, and food safety. Food and Energy Security, v. 6, n. 2, p. 48–60, 2017.
CHATZIMITAKOS, T. G.; KARALI, K. K.; STALIKAS, C. D. Magnetic graphene oxide as a convenient nanosorbent to streamline matrix solid-phase dispersion towards the extraction of pesticides from vegetables and their determination by GC–MS. Microchemical Journal, v. 151, n. July, p. 104247, 2019.
CODEX ALIMENTARIUS. INTERNATIONAL FOOD STANDARS. Disponível em: http://www.fao.org/fao-who-codexalimentarius/en/. Acesso em: 21 dez. 2021.
DOREA, H. S. Dispersão da matriz em fase sólida. In: BORGES, K. B.; FIGUEIREDO, E. C. DE; QUEIROZ, M. E. C. P. P.-R. DE J. Preparo de amostras para análise de compostos orgânicos, LTC, 2015.p. 80-87.
LOZOWICKA, B. et al. Toxicological evaluation of multi-class pesticide residues in vegetables and associated human health risk study for adults and children. Human and Ecological Risk Assessment, v. 22, n. 7, p. 1480–1505, 2016.
LU, W. et al. Research developments for applications of graphene in sample preparation. Fenxi Huaxue/ Chinese Journal of Analytical Chemistry, v. 42, n. 1, p. 136–144, 2014.
NARENDERAN, S. T.; MEYYANATHAN, S. N.; BABU, B. Review of pesticide residue analysis in fruits and vegetables. Pre-treatment, extraction and detection techniques. Food Research International, v. 133, n. February, p. 109141, 2020.
USEPA. Basics of Green Chemistry. https://www.epa.gov/greenchemistry/basics-green-chemistry#definition. Acesso em: 20-06-2022.
WIANOWSKA, D.; GIL, M. New insights into the application of MSPD in various fields of analytical chemistry. TrAC - Trends in Analytical Chemistry, v. 112, p. 29–51, 2019.
















