Autores
Martínez Valencia, C.X. (UNIVERSIDAD DEL CAUCA) ; Pérez, E.H. (UNIVERSIDAD DEL CAUCA) ; Bravo Realpe, I. (UNIVERSIDAD DEL CAUCA)
Resumo
Se estudió la composición química de Ácidos Húmicos (AH) en el horizonte A de
tres sistemas en Typic Hapludands de suelos altoandinos, con el fin de determinar
la influencia del cambio de uso de bosque a cultivo y pastura. Los AH se
extrajeron de forma secuencial con soluciones de tetraborato, pirofosfato, NaOH y
su composición química se determinó mediante CPMAS 13 CNMR. Se realizó la
estimación del almacenamiento de carbono (C) en los suelos y en AH, considerando
densidad aparente y profundidad. El AH-cultivo dominó en calidad, grado de
condensación y aromaticidad, frente a los AH-bosques y AH-pasturas con mayor grado
de alifaticidad. Los constituyentes hidrofóbicos correspondientes a C-alquil es
superior en pasturas y bosques con un mayor índice de hidrofobicidad.
Palavras chaves
Ácidos húmicos; Almacenamiento de carbono; CPMAS 13 CNMR
Introdução
La MOS es fundamental para mantener y regular las propiedades físicas y químicas
del suelo, es la principal determinante de la actividad biológica, favorece la
biodiversidad, constituyéndose en indicador clave de la calidad del suelo, tanto
en sus funciones agrícolas como ambientales, participando de forma activa en la
captura de carbono y calidad del aire. La MOS tiene una composición compleja y
heterogénea (GHABBOUR & DAVIES, 2005), conformada por una fracción lábil
denominada materia orgánica libre (MOF) y una fracción estable denominada MOH
(POIRIER et al., 2005). La primera es altamente sensible a cambios en el uso y
manejo de suelo, es susceptible a procesos de mineralización. Mientras que la
MOH es altamente estable, está fuertemente unida a la fracción mineral a través
de diferentes tipos de enlaces, favorece la formación de una estructura edáfica
adecuada, mejora las propiedades físicas y químicas del suelo y reduce
notablemente la actuación de fenómenos de degradación tan extendidos como la
erosión hídrica.
La sustancias húmicas (SH), constituyentes de la MOH, pueden definirse como:
“una serie de sustancias heterogéneas de peso molecular relativamente alto, con
carácter refractario, formadas por reacciones de síntesis secundaria” (HAYES et
al., 2007; LÓPEZ et al., 2003; NAAFS, 2004; SENESI et al., 2003). Químicamente
se clasifican en ácidos fúlvicos (AF), huminas y ácidos húmicos (AH); su
composición y estructura química varían con diferentes suelos, con el cambio de
uso y con la profundidad de ellos (VAN DER KAMP et al., 2009; KANG, 2008). Los
AH juegan un papel importante en procesos medioambientales, gobiernan el destino
y transporte de contaminantes orgánicos e inorgánicos, evitan la erosión hídrica
y eólica del suelo y contribuyen al almacenamiento de C en el suelo; propiedades
que se ven influenciadas por su estructura química.
La cantidad de C total en la tierra es casi constante, sin embargo, las formas y
las cantidades de C presentes en los diferentes compartimentos geoquímicos
(atmósfera, biosfera, pedosfera, hidrosfera y litosfera) no son constantes, y
las transferencias tienen lugar como consecuencia de los ciclos naturales o
actividades antropogénicas, existiendo pérdidas por flujo de compuestos de
carbono de bajo peso molecular a la atmósfera (MACÍAS & CAMPS, 2010), que
podrían corresponder a la mineralización de MOF. Mientras los AH, fracción de
las SH biológicamente más resistente a la mineralización, contribuyen al
almacenamiento de C en el suelo, asociado a una gama amplia de estructuras
aromáticas condensadas envueltas por componentes de cadenas alifáticas, de alto
peso molecular, evitan la emisión de gases efecto invernadero y contribuyen a
mitigar el cambio climático global.
En ecosistemas Altoandinos de Colombia los suelos derivados de cenizas
volcánicas, son importantes almacenadores y estabilizadores de carbono orgánico,
resultado de la fuerte unión con alófanos (NAAFS, 2004; NIEROP et al., 2001).
Los sitios muestreados esta ubicados en una cuenca andina de alta montaña y es
parte de un reservorio estratégico conformado por trece microcuencas, humedales,
y manantiales. Predominan las formas de montaña de escarpado relieve, con
procesos de erosión natural. Actualmente en esta zona se vienen ocupando
ecosistemas naturales para expansión de la frontera agrícola y de pastoreo, por
razones de seguridad alimentaria y carencia de fertilidad de sus suelos,
manifestada en la deficiencia de fósforo asociada a la adsorción sobre la fase
coloidal del suelo, especialmente sobre alófanos.
Material e métodos
Los suelos Altoandinos estudiados se encuentran a 2850-3238 msnm, con clima
frío-húmedo.Pertenecen al orden Andisoles, suborden Udands, gran grupo
Hapludands y subgrupo Typic (SOIL SURVEY STAFF, 2010, IGAC, 2009), se encuentran
localizados entre las coordenadas 2º 26' 17.73" N, 76º 24' 17.32" W.
Las unidades experimentales se seleccionaron considerando el uso de suelo
(PEARSON et al., 2005). Cada parcela se delimitó por una cuadrícula de 400 m2
tomando submuestras cada 5 m del horizonte A a 20 cm de profundidad. Los ácidos
húmicos extraídos de cada parcela son identificados como: AH-bosque I, AH-bosque
II, AH-bosque III, AH-pastura II, AH-pastura III y AH-cultivo.
El fraccionamiento de MOS en materia orgánica humificada (MOH) y materia
orgánica fresca (MOF), mediante el método granulométrico de tamizaje en
húmedo. Las fracciones: AH-AF y huminas, se separan mediante extracción
secuencial de la MOH con soluciones básicas de tetraborato, pirofosfato e
hidróxido de sodio (0,1N) y centrifugación a 16.508 x g. Los AH se separan de
la fracción fúlvica por precipitación con H2SO4 a pH 1 y centrifugación a 16.508
x g. Los AH se purificaron mediante redisoluciones en NaOH y precipitación con
HCl (pH 1), centrifugación, diálisis y liofilización (NIEROP, 2005).
La composición elemental C, H, N, S, O fue determinada usando un analizador
elemental Thermo Scientific Modelo Flash 2000. La relación E4/E6 fue calculada
como la relación de absorbancias a 465 y 665 nm de los AH disueltos en NaHCO3
0,05N. La resonancia magnética nuclear de estado sólido (CPMAS13CNMR) en los AH
se realizó en un equipo Bruker 600 WB PLUS bajo los parámetros de adquisición
descritos por KANG et al.(2003). Se usó el área total como referencia para la
integración de ciertas zonas, definiendo una relación entre zona A (0-108 ppm)
correspondiente a la suma de carbonos alifáticos y zona B (108-162 ppm)
correspondiente a C aromático, con estas zonas se determinó el factor de
aromaticidad (KNICKER et al., 2005). Se determinó el Índice de Hidrofobicidad de
los Ácidos Húmicos: HB/HI y se calculó de acuerdo a PICCOLO et al. (1996).
El almacenamiento de C en el suelo (COS) y AH (CAH), se estimó con el porcentaje
de Corg determinado en el suelo y el porcentaje de C de AH determinado por
análisis elemental; la densidad aparente del suelo y la profundidad a la cual se
tomó la muestra en el horizonte A en cada uso (CARVALHO et al., 2009; AVILA et
al., 2012; DELGADILLO & QUECHULPA, 2006).
Para el procesamiento y análisis de los datos obtenidos de AH se utilizó el
programa SPSS 20. Se identificó la variable independiente (uso de suelo) y las
variables dependientes (todas las medidas) tanto en suelo como en los AH.
Resultado e discussão
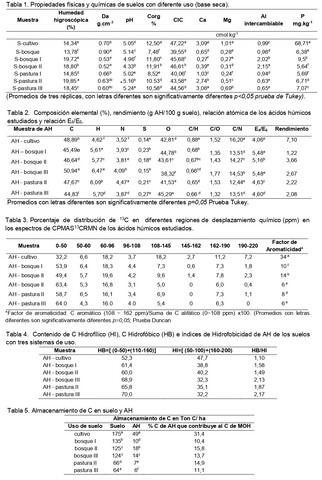
Los suelos de todos los usos presentaron textura Franco Arenosa, densidad
aparente baja, valores bajos de pH con acidez extrema, fuerte y muy fuerte,
altos contenidos de Corg, superiores a 5,8%, deficiencia de Ca excepto en
cultivo y pastura III, deficiencia de Mg y P excepto en cultivo; el Al
intercambiable es alto en suelos de bosque I y bosque II (SILVA, 2000), (tabla
1).
La caracterización de los AH se realizo por análisis elemental, caracterizados
por altos contenidos de C, O, bajos contenidos de H, N, S y presentan
diferencias significativas en su composición elemental en todos los usos de
suelo (p<0.05), (Tabla 2)
La relación atómica C/N es significativamente superior en AH-cultivo mostrando
mayor actividad biológica en estos suelos. La relación C/H en todos los usos es
cercana a 1, indica una mezcla de carácter alifático/ aromático, de acuerdo a
SENESI et al., (2003), mostrando para AH-cultivo mayor carácter aromático (>C/H)
mientras que AH de pasturas y bosques presentan mayor carácter alifático (<C/H).
En AH-cultivo la relación C/N refleja el incremento en la condensación,
demostrada por la menor alifaticidad en ellos (>C/H) y por la correlación
positiva y altamente significativa entre éstas dos relaciones (Coeficiente de
Pearson =0.842**).
La relación E4/E6 es inferior a 5 en AH-cultivo y AH-pasturas y se encuentran
dentro del valor referenciado por SENESI et al. (2003) para AH, es inferior en
AH-cultivo, indica la presencia de una estructura más condensada que en los AH
provenientes de bosques y pasturas, debido al sistema de labranza y aplicación
de abonos orgánicos con aporte de alta carga microbial, favorece procesos de
neosínteis e incrementa la policondensación de AH en el suelo de cultivo. Las
relaciones E4/E6 son más altas a las de otros andisoles sometidos a explotación
agropecuaria (JARAMILLO, 2011), evidencia AH con menor grado de condensación,
probablemente por variación de condiciones climáticas, altitud y régimen de
humedad en la zona de estudio. El comportamiento inverso entre la relación E4/E6
y C/H de los AH, demostrado por la correlación de Pearson (-0,669**), evidencia
el incremento del carácter aromático con la disminución en la relación E4/E6 .
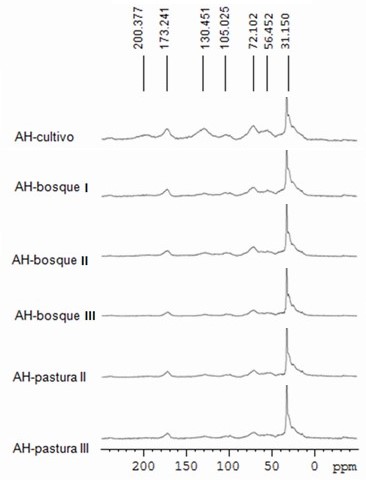
Resonancia magnética nuclear de estado sólido (CPMAS 13 CNMR).
Los espectros de los AH (Figura 1), muestran una composición dominada por un
pico intenso de C alifático a 31.150 ppm, atribuido a grupos metileno en cadenas
alquílicas largas o grupos de CH2 derivados de varios compuestos lipídicos
(SPACCINI & PICCOLO, 2009). Este estudio permitió discriminar regiones
específicas para cada tipo de carbono (C) (Tabla 3) así: 0~50 ppm C- alquilo,
50~60 ppm C-alquilo de grupos metoxi, 60~96 ppm -CH2OH, 96-108 ppm grupos
anómericos, 108-145 ppm C-aromático, 145-162 ppm grupos fenólicos, 162-190 ppm C
de grupo carboxilo, 190-220 ppm C de grupo carbonilo en los AH. Los porcentajes
relativos de distribución de carbono en las diferentes regiones de
desplazamiento obtenidos por integración de señales, permiten determinar el
factor de aromaticidad de los ácidos húmicos dado por la relación entre la
región de C aromático (108~162 ppm) y la región total de C alifático (0~108 ppm)
como se detalla en la Tabla 3.
El factor de aromaticidad y relación C/H de AH-cultivo son significativamente
superiores y conjuntamente con la menor relación E4/E6 y menor grado de
alifaticidad revelan nuevamente un grado superior de transformación, confirmado
por la correlación negativa y altamente significativa con la relación E4/E6
(Coeficiente de Pearson -0,647**) y correlación positiva y altamente
significativa con la relación C/H (Coeficiente de Pearson =0,968**). El factor
de aromaticidad es inferior para AH-bosque III y AH-pastura III, indicando un
grado de alifaticidad significativamente superior, aun cuando la relación E4/E6
de AH-pastura III muestra mayor condensación, se podría inferir en este último
una estructura aromática envuelta por componentes de cadena alifática de alto
peso molecular. Estos resultados confirman los obtenidos en análisis elemental.
Otros estudios con NMR de estado sólido demuestran que el fortalecimiento de las
actividades bioquímicas observado en el suelo bajo sistema de labranza cero,
resulta en mayores cantidades de hidratos de carbono, aminoácidos y azúcares
aminados, y menor aromaticidad que en suelo bajo labranza convencional, los AH
de labranza convencional son menos alifáticos y más aromáticos que los AH de
conservación, o no labranza (DING, et al., 2002; PICCOLO, 1996).
El índice de hidrofobicidad (Tabla 4) en todos los casos superior a 1 indica
alta hidrofobicidad, estabilidad y madurez. Los AH-cultivo presentan mayor
aromaticidad y grado de condensación pero menor valor de hidrofobicidad,
manifestando probablemente menor resistencia al efecto del agua o de actividades
antrópicas.
El almacenamiento de C en suelos altoandinos Typic Hapludands de la microcuenca
es alto (tabla 5), si se compara con otros Typic Hapludands de la
cordillera Oriental Andina (AVILA et al., 2012), favorecido especialmente por
los procesos pedogenéticos que promueven el desarrollo de horizontes ricos en
materia orgánica y el crecimiento de biomasa. La correlación positiva y
altamente significativa (coeficiente de Pearson=0,845**) con la relación C/N
muestra que el almacenamiento de C en el suelo es inverso a la mineralización.
El cambio de uso de suelo de bosque a cultivo incrementa significativamente el
almacenamiento de C en el suelo y en los AH. Probablemente la aplicación de
abonos orgánicos y el mejoramiento en las condiciones del suelo con corrección
de acidez y de fósforo beneficia a los microorganismos encargados del proceso de
biosíntesis de AH, permitiendo obtener moléculas con mayor grado de condensación
(< E4/E6), aromaticidad y menor alifaticidad, favoreciendo el almacenamiento de
C estable y contribuyendo a la mitigación del cambio climático global. Esta
afirmación se soporta con las correlaciones positivas y altamente significativas
entre el almacenamiento de C y aromaticidad, rendimiento, relación C/H y la
correlación negativa y altamente significativa con la relación E4/E6.
El cambio a pastura produce disminución altamente significativa del C almacenado
en el suelo, asociado a la disminución en el espesor del horizonte A por
procesos de compactación que impiden una adecuada transformación a MOH estable.
El pastoreo en estos suelos es extensivo por lo tanto el aporte de MO
proveniente del ganado no se ve reflejado en el almacenamiento de C ni en la
calidad de los AH. El carbono almacenado en el AH-bosque I es inferior que en
los AH de los otros dos bosques, aun cuando tiene superior aromaticidad, porque
el rendimiento es inferior (Tabla 2).
Conclusões
La calidad de los AH de suelos altoandinos de la cuenca Andina de alta montaña, es
baja considerando el bajo grado de aromaticidad y demuestra un proceso de
humificación incipiente, atribuible a condiciones climáticas y a propiedades
químicas adversas que impiden un adecuado proceso enzimático. El cambio de uso de
suelo influye en la composición química de ácidos húmicos, el cambio a cultivo
evidencia un efecto positivo incrementando la calidad de los AH en grado de
condensación y aromaticidad, está asociado al mejoramiento en las propiedades del
suelo. El cambio de uso de bosque a pastura no es favorable, porque disminuye la
calidad de los AH.
El almacenamiento de C en AH depende de la calidad pero también de la cantidad y
el cambio de uso influye drásticamente en el almacenamiento de C en estas
moléculas. Si bien es cierto que el aporte de AH al almacenamiento de C dentro de
la MOH no es superior al 31.4%, el carbono fijado en ellos es altamente resistente
a proceso de erosión, actividades antrópicas, compactación y manejo del suelo,
demostrado por altos índices de hidrofobicidad estabilidad y madurez,
constituyendo un aporte considerable a la mitigación del cambio climático.
Agradecimentos
Al Departamento de Edafología y Química Agrícola de la UGR (España). A la
Vicerrectoría de investigaciones (VRI) de la Universidad del Cauca, al grupo de
Agroquímica, a la fundación Rio Piedras.
Referências
AVILA, E.; MARTÍNEZ, L.; LEIVA, F. Influencia del uso de la tierra sobre el almacenamiento de carbono orgánico en dos Andisoles de la Coordillera Oriental Andina. Sociedad Colombiana de la Ciencia del Suelo. Bogotá, 2012; p 128.
CARVALHO, J. L. N.; CERRI, C. E. P.; FEIGL, B. J.; PICCOLO, M. C.; GODINHO, V. P.; CERRI, C. C. Carbon sequestration in agricultural soils in the Cerrado region of the Brazilian Amazon. En: Soil and Tillage Research. 2009.Vol 103, p. 342-349.
DELGADILLO, M. & QUECHULPA, S. Manual de Monitoreo de carbono en sistemas agroforestales. En: Comisión Nacional Forestal Mexico. 2006.
DING, G.; NOVAK, J.; AMARASIRIWARDENA, D.; HUNT, P.; XING, B. Soil Organic Matter Characteristics as Affected by Tillage Management. En: Soil Sci. Soc. Am. J. 2002. vol. 66, no., p. 421-429.
GHABBOUR, E. ; DAVIES, G. Humic substances Natures, Most Versatile Materials. . New York. 2005; p 1-5.
HAYES, M.; TSENG, Y. ; WANG, M. Chemistry of Soil Organic Matter. En: Taiwan J For Sci. 2007. vol. 22 (3), p. 215-26.
IGAC. Estudio General de Suelos y Zonificación de Tierras Departamento del Cauca. Escala 1:100.000 Bogotá: Imprenta Nacional de Colombia, 2009.
JARAMILLO, J. Caracterización de la materia orgánica del horizonte superficial de un andisol hidromórfico del oriente antioqueño (Colombia). En: Rev. Acad. Colomb. Cienc. 2011. vol. 35 no. 134, p. 23-33.
KANG, S.; AMARASIRIWARDENA, D.; VENEMAN, P.; XING, B. Characterization of ten sequentially extracted humic acids and a humin from a soil in Western Massachusetts. En: Soil Science. 2003. vol. 168, no. 12, p. 880-887.
KANG, S. Characterization of Adsorbed Organic Matter on Mineral Surfaces. ProQuest LLC: United States, 2008.
KNICKER, H.; GONZALES, F.; POLVILLO, O.; GONZALES, J.; ALMENDROS, G. Fire-induced transformation of C- and N- forms in different organic soil fractions from a Dystric Cambisol under a Mediterranean pine forest (Pinus pinaster). En: Soil Biology and Biochemistry. 2005. vol. 37, no. 4, p. 701-718. ISSN 0038-0717.
LÓPEZ, L.; LO MÓNACO, S.; MÉNDEZ, B. Caracterización de la materia orgánica extraída de suelos por diferentes técnicas. En: Rev.Fac.Agro(Maracay). 2003. vol. 29, p. 257-283.
MACIAS, F.; CAMPS, A. Soil carbon sequestration in a changing global environment. En: Mitigation and Adaptation Strategies for Global Change. 2010. vol. 15, no. 6, p. 511. ISSN 13812386.
NAAFS, D.F.W. What are humic substances? A molecular approach to the study of organic matter in acid soils. Utrecht Holanda: 2004. p 1-19, 87-98.
NIEROP, K.; VAN LARGEN, B.; BUURMAN, P. Composition of plant tissues and soil organic matter in the first stages of a vegetation succession. En: Geoderma. 2001. vol. 100, no. 1-2, p. 1-24. ISSN 0016-7061.
NIEROP, K. NaOH and Na4P2O7 extractable organic matter in two allophanic volcanic ash soils of the Azores Islands—a pyrolysis GC/MS study. En: Geoderma. 2005. vol. 127, no. 1-2, p. 36-51. ISSN 0016-7061.
PEARSON, T.; WALKER, S.; BROWN, S. Sourcebook for Land use, land-use change and forestry project. [online]. Winrock, I.,Ed. 2005. Available from internet:<http://www.winrock.org/ecosystems/files/winrock-biocarbon_fund_sourcebook-compressed.pdf21.
PICCOLO, A. Humic Substances in Terrestrial Ecosystems.. Amsterdam: Elsevier Science B.V., 1996. p. 689. ISBN 978-0-444-81516-3
POIRIER, N.; SOHI, S.; GAUNT, J.; MAHIEU, N.; RANDALL, E.; POWLSON, D.; EVERSHED, R. The chemical composition of measurable soil organic matter pools En: Organic Geochemistry 2005. vol. 36, p. 1174-1189.
SENESI, N.; DORAZIO, V.; RICCA, G. Humic acids in the first generation of EUROSOILS. En: Geoderma. 2003. vol. 116, p. 325-344.
SILVA M, F. Fundamentos para la interpretación de análisis de los suelos, plantas y aguas de riego.tercera edición. Sociedad Colombiana de la Ciencia del Suelo: Santafé de Bogotá, D.C. Colombia, 2000.
SOIL SURVEY STAFF. Keys to Soil Taxonomy. Eleventh Edition. U SD Washington DC. 2010.
SPACCINI, R.; PICCOLO, A. Molecular characteristics of humic acids extracted from compost at increasing maturity stages. En: Soil Biology and Biochemistry. 2009. vol. 41, no. 6, p. 1164-1172. ISSN 0038-0717.
VAN DER KAMP, J.; YASSIR, I.; BUURMAN, P. Soil carbon changes upon secondary succession in Imperata grasslands (East Kalimantan, Indonesia). En: Geoderma. 2009. vol. 149, no. 1-2, p. 76-83. ISSN 0016-7061.
















